多发脑转移瘤行固定野逆向调强放疗与γ射线立体定向放疗剂量差异
2015-12-02吕海鹏胡范祥王会宇王海青
吕海鹏,吴 雁,刘 晓,胡范祥,王会宇,王海青,李 翊
脑转移瘤是成年人最常见的颅内肿瘤之一,约8.5%~40%肿瘤会出现脑转移,尤其是肺癌和乳腺癌,这些脑转移瘤患者中约72%发生在确诊为肿瘤1 年内,且 50%的脑转移瘤患者为多发[1-3]。放射治疗是脑转移瘤的重要治疗手段。不做任何治疗的脑转移瘤患者的中位生存时间约为1个月,实施全脑放疗(whole-brain radiotherapy,WBRT)生存时间可延长至6个月[4]。随着放疗技术的迅速发展,立体定向放疗技术以及调强技术日趋成熟,对于提高脑转移瘤患者的局部控制率及生存期起到了积极地作用。多个学者的研究结果确定了γ射线立体定向放疗对脑转移瘤治疗的重要地位[5-7],患者的平均生存时间达到12个月。Edwards等[8]论述了固定野逆向调强放疗 (intensity modulated radiotherapy,IMRT)配合WBRT治疗脑转移瘤所取得的初步积极成果,从局部控制率和治疗费用等方面提出了IMRT代替SRS的可能性,提高了可见转移瘤的剂量且全部患者无放射性脑损伤。本文所介绍的γ射线立体定向放疗(Gamma ray stereotactic radiothe-rapy,γ-ray SRT)由于剂量率和治疗精度的限制无法做到上述SRS类似手术的单次治疗模式,通常采用大剂量、多分次的方式。通过对脑转移瘤γ-ray SRT及IMRT治疗计划比较研究,评估两种治疗技术对于脑转移瘤放疗的优劣,从而为临床应用提供参考。
1 资料与方法
1.1 病例选取 选取笔者所在医院2009年7月—2010年6月10例脑转移瘤患者。10例患者年龄为52~74岁,中位年龄65岁,转移瘤个数1~4个,转移瘤总数29个,病灶直径2~4 cm。
1.2 体位固定与CT扫描 患者仰卧位于头部固定装置上,采用热塑面膜固定。东芝Aquilion-one CT平扫和增强扫描,增强扫描延时50 s,层厚为3 mm,扫描范围由头顶至第二颈椎。增强药物采用拜尔公司生产优维显80 ml,高压注射速率2~3 ml/s,根据患者的年龄、体质略有调整。
1.3 设备 调强计划采用美国 Varian公司Eclipse7.3.10 计划系统,Varian21EX 加速器,120 片多 叶 准 直 器 (Millennium MultileafCollimator,MLC),空间分辨率中心20 cm为5 mm,外围2 cm×10 cm为10 mm,叶片最大运动速度为2.5 cm/s,6 MV X射线。γ-SRT计划采用中国海博公司超级伽马刀系统(super gamma system)SGS-1型全身伽玛刀(图1),孔直径为 1.5、2.5、4.0、5.5 cm 的 4 组准直器 (terminal collimators)联合使用可治疗直径1~10cm的肿瘤。其治疗原理是:位于同一球面的18颗60Co围绕球心在垂直治疗床(图1-a-③)的平面上旋转,球心即γ射线辐射的焦点。通过可三维运动的治疗床使需照射的靶点移动到辐射焦点,然后源体(图1-a-①)中的18颗60Co产生的γ射线经过准直体(图1-a-②)限束,沿着圆形轨道旋转照射病灶,根据转移瘤的个数及大小选择准直器的组合方式及靶点的个数。60Co衰变产生的γ射线的等效能量是 1.25 MV。
1.4 靶区勾画 扫描后CT图像经网络传输至Varian Eclipse计划系统与超级伽马刀计划系统,根据ICRU-50号报告[9],由同一名放疗医师在两套计划系统中分别勾画靶区(表1)。其中,GTV为CT断层图像上被强化的可见病灶;GTV均匀外放3mm得到PTV。危及器官包括晶状体、眼球、脑干、视神经、正常脑组织。PTV和危及器官都经过修正使两计划系统所勾画体积一致(表2)。

图1 γ射线立体定向治疗装置及原理示意图
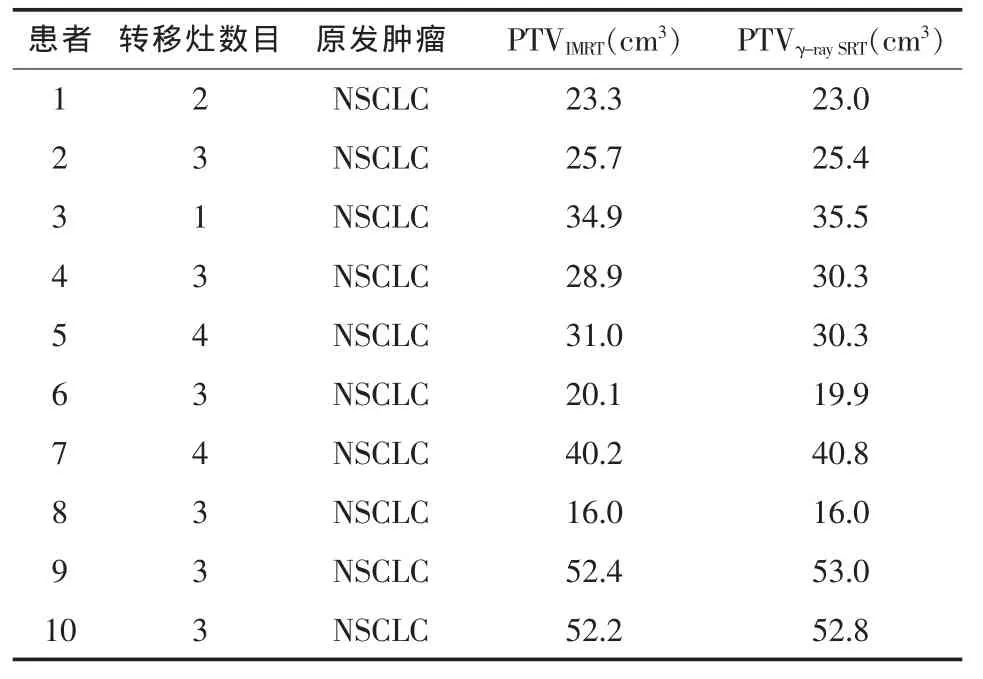
表1 患者基本数据
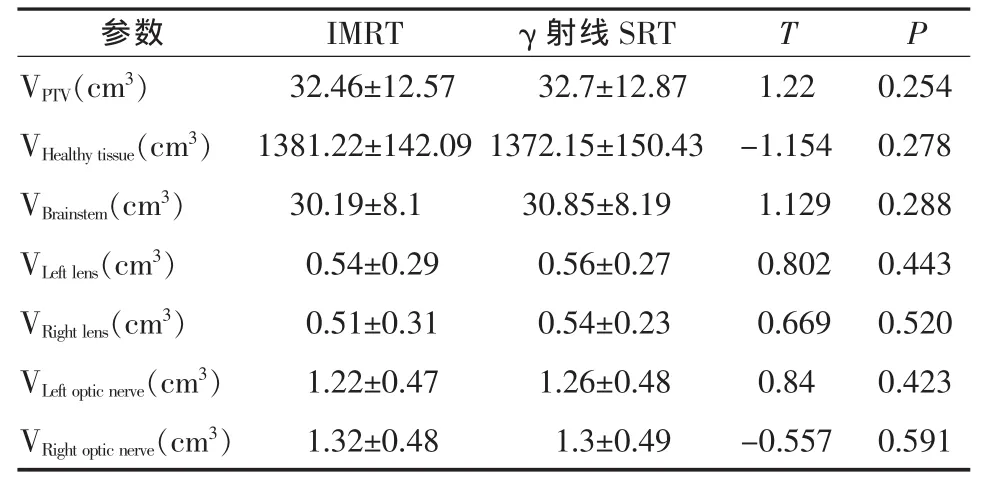
表2 靶区、正常脑组织和危及器官勾画情况
1.5 计划设计 针对10例患者的CT扫描图像,分别利用Varian Eclipse计划系统和超级伽马刀计划系统设计两套不同的计划。具体办法如下:①逆向调强计划(IMRT):采用传统调强方式并采用“step and shoot”的方式传输剂量,6MV X射线,设7个共面照射野行等中心照射,射野角度平均间隔52°,小机头、床角均为 0°;照射野的剂量率为300 MU/min;优化过程中通过调整相对优先值使系统满足目标要求;在PTV外围采用2个“环”使PTV外围剂量迅速跌落,每个环的宽度为1 cm;另外,使用正常组织的目标函数降低剂量水平,并防止热点出现在靶区之外;剂量计算采用anisotropic analytical algorithm(AAA)算法,计算网格大小为 2.5 mm;②γ-ray SRT计划:根据肿瘤的大小选择不同尺寸的准直器(15、25、40、55 mm)行多靶点非共面照射;计划设计要求尽量减少危及器官及正常脑组织的不必要照射,50%~60%的等剂量曲线包绕95%的靶区体积,并用合适的等剂量曲线进行归一;剂量计算采用Narrow Beam算法,计算网格为2.5 mm。
1.6 计划评估 处方剂量为50 Gy,5Gy/次,共10次。所有计划要求至少95%靶区体积达到处方剂量,至少98%靶区体积达到95%的处方剂量;IMRT允许5%体积靶区剂量超过110%,不限制γ-ray SRT计划的靶区最高剂量。危及器官的最大耐受量按 α/β=3 Gy 校正为脑干 30 Gy、晶状体 6 Gy、视神经30 Gy。
1.7 评价工具 基于两种计划的体积剂量直方图(dose-volume histogram,DVH)分析剂量学参数。使用D2%和D98%描述靶区的最大剂量和最小剂量(2%和98%的靶区体积接受的剂量),另外还采用V95%、V107%和V110%评价靶区体积与剂量的关系(接受超过95%、107%、和110%的处方剂量的靶区体积)。
使用Paddick CI[10]比较两种计划处方剂量与靶区适形程度。公式定义如下:
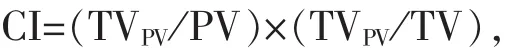
式中,TV为靶区体积,TVPV为参考等剂量曲线所包绕的靶区体积,PV为参考等剂量曲线所包绕的所有区域的体积[10,11]。Paddick CI数值范围 0~1,越接近1适形度越高。
靶区剂量的均匀性HI用D5~D95表示,式中,D5、D95分别为DVH图中5%和95%的靶区体积对应的剂量,所得的数值越小靶区剂量的均匀度越好。
所有危及器官采用最大剂量(用D2%表示)和平均剂量Dmean进行评估,正常脑组织用平均剂量Dmean和Vx(接受至少xGy的靶区体积)描述剂量和体积关系。
2 结 果
2.1 靶区体积及剂量评估 两个计划系统勾画的靶区体积在统计学上相同(t=1.22,P=0.254)。给予相同的处方剂量的条件下,γ-ray SRT的最大剂量远大于 IMRT(t=17.898,P=0),最小剂量与 IMRT 无统计学差异 (t=0.398,P=0.700);γ-ray SRT 计划超过处方剂量的靶区体积(V107%、V110%)比 IMRT 大(t=11.391、28.864,P=0); 靶区适形指数 IMRT 好于 γray SRT(t=-11.47,P=0);不均匀指数 γ-ray SRT 远高于 IMRT(t=19.496,P=0),见表1。
2.2 正常脑组织和危及器官受照情况 两种计划所勾画的正常脑组织和危及器官体积无统计学差异(t=-0.557~1.129,P=0.278~0.591)。二者 V5相似(t=-0.7,P=0.123),除此之外,全脑平均剂量、V10、V15、V20、V25、V30γ -ray SRT 均 低 于 IMRT (t=-3.975~-6.535,P<0.005),约为 IMRT 的 59%~79%。两种方法的眼球、晶体、视神经、脑干的最大剂量和平均剂量差异均不大 (t=-2.399~0.196,P=0.04~0.849),且均未超过最大剂量限值,见表3、4。图2、图3分别是1例患者在IMRT和γ-ray SRT两种方法中的靶区及正常脑组织等剂量曲线图和DVH比较。
2.3 单次剂量5 Gy照射时间 IMRT的照射时间为(7.18±0.52) min,γ-ray SRT 为(14.65±5.65) min,IMRT平均照射时间为γ-ray SRT的49%。
表3 2种计划靶区剂量参数(±s)
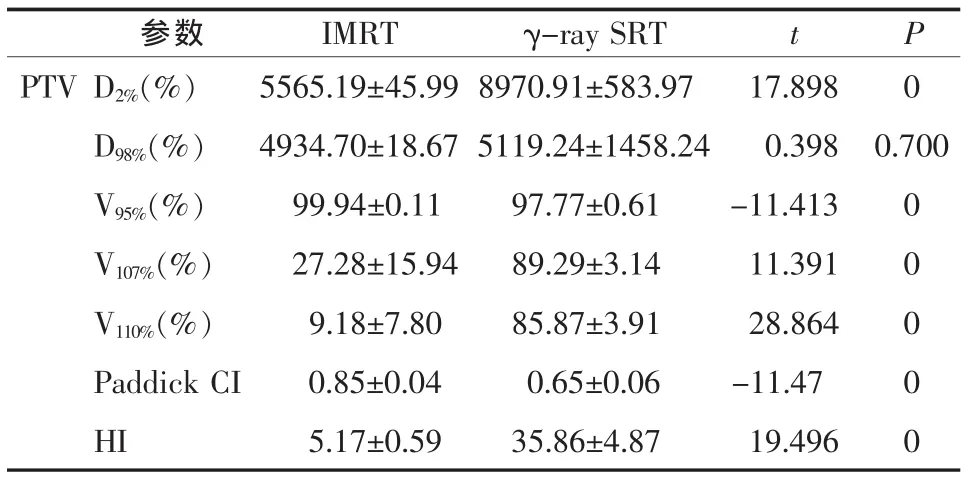
表3 2种计划靶区剂量参数(±s)
参数 IMRT γ-ray SRT t P PTV D2%(%) 5565.19±45.99 8970.91±583.97 17.898 0 D98%(%) 4934.70±18.67 5119.24±1458.24 0.398 0.700 V95%(%) 99.94±0.11 97.77±0.61 -11.413 0 V107%(%) 27.28±15.94 89.29±3.14 11.391 0 V110%(%) 9.18±7.80 85.87±3.91 28.864 0 Paddick CI 0.85±0.04 0.65±0.06 -11.47 0 HI 5.17±0.59 35.86±4.87 19.496 0
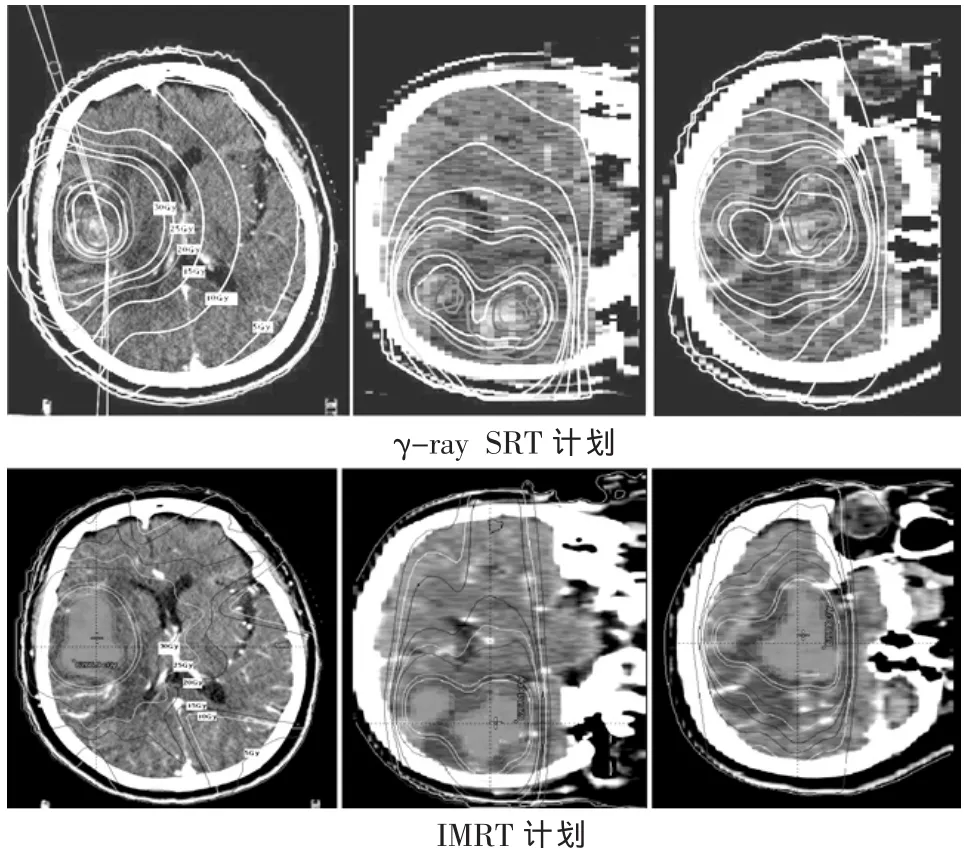
图2 1例患者两种计划正常脑组织等剂量曲线分布情况
表4 正常脑组织和危及器官剂量参数(±s)
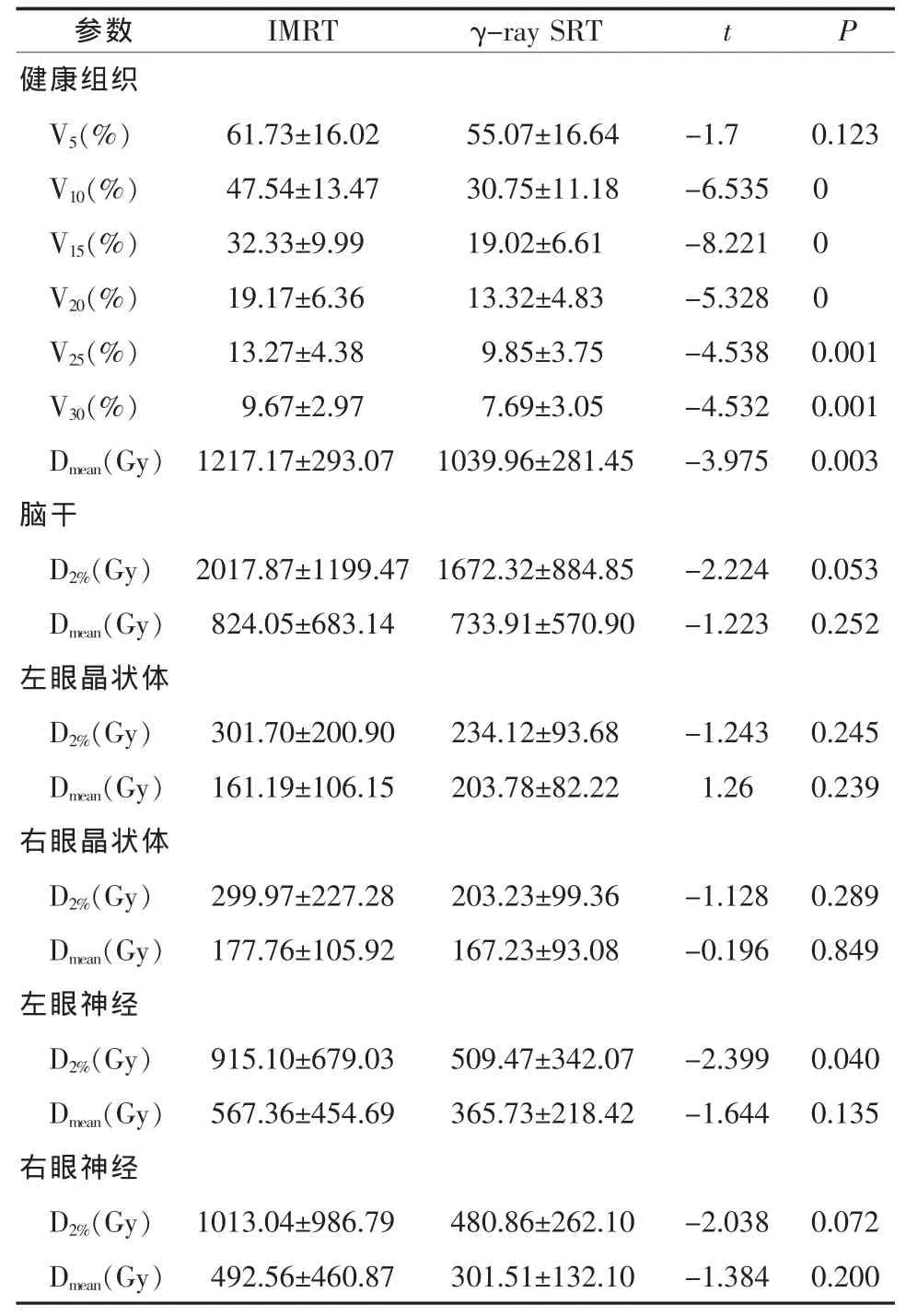
表4 正常脑组织和危及器官剂量参数(±s)
参数 IMRT γ-ray SRT t P健康组织V5(%) 61.73±16.02 55.07±16.64 -1.7 0.123 V10(%) 47.54±13.47 30.75±11.18 -6.535 0 V15(%) 32.33±9.99 19.02±6.61 -8.221 0 V20(%) 19.17±6.36 13.32±4.83 -5.328 0 V25(%) 13.27±4.38 9.85±3.75 -4.538 0.001 V30(%) 9.67±2.97 7.69±3.05 -4.532 0.001 Dmean(Gy) 1217.17±293.07 1039.96±281.45 -3.975 0.003脑干D2%(Gy) 2017.87±1199.47 1672.32±884.85 -2.224 0.053 Dmean(Gy) 824.05±683.14 733.91±570.90 -1.223 0.252左眼晶状体D2%(Gy) 301.70±200.90 234.12±93.68 -1.243 0.245 Dmean(Gy) 161.19±106.15 203.78±82.22 1.26 0.239右眼晶状体D2%(Gy) 299.97±227.28 203.23±99.36 -1.128 0.289 Dmean(Gy) 177.76±105.92 167.23±93.08 -0.196 0.849左眼神经D2%(Gy) 915.10±679.03 509.47±342.07 -2.399 0.040 Dmean(Gy) 567.36±454.69 365.73±218.42 -1.644 0.135右眼神经D2%(Gy) 1013.04±986.79 480.86±262.10 -2.038 0.072 Dmean(Gy) 492.56±460.87 301.51±132.10 -1.384 0.200
3 讨 论
Xia 等[12]报道过国产 γ-ray SRT 治疗Ⅰ、Ⅱ期非小细胞肺癌的积极成果,但是国产γ-ray SRT治疗脑转移瘤的相关研究鲜见报道。本研究使用的中国海博公司生产的伽马射线立体定向放疗系统(γ ray stereotactic radiotherapy,γ-ray SRT) 采用位于同一球面的18颗60Co作为放射源,围绕等中心旋转照射,制定计划时,根据靶区的大小和形状选取一个或多个合适孔径的圆柱形准直器,调整各个旋转弧段的权重、起始和终止的角度、等中心点的位置使合适的等剂量曲线与靶区形状尽量一致。剂量强度从焦点处向周围递减,GTV剂量最高,PTV次之,周围正常组织最低。γ-ray SRT这种高剂量梯度特性导致靶区内高HI,本文结果验证了这一特性,γ-ray SRT 的 HI(35.86±4.87)远高于 IMRT(5.17±0.59)。一般情况下,靶区中心肿瘤细胞密度大,乏氧细胞集中,γ-ray SRT高HI的特点使靶区中心等效生物剂量高于周边,对肿瘤细胞的杀伤作用增强。IMRT计划由于靶区目标函数的设置使靶区剂量的HI得到很好控制,其大小很大程度上受计划设计者及医师临床需求的影响。
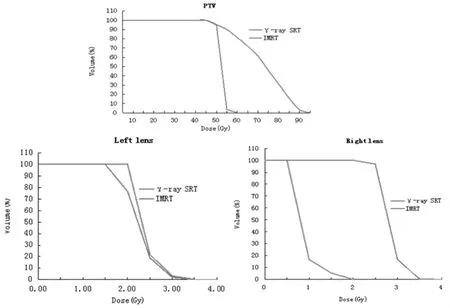
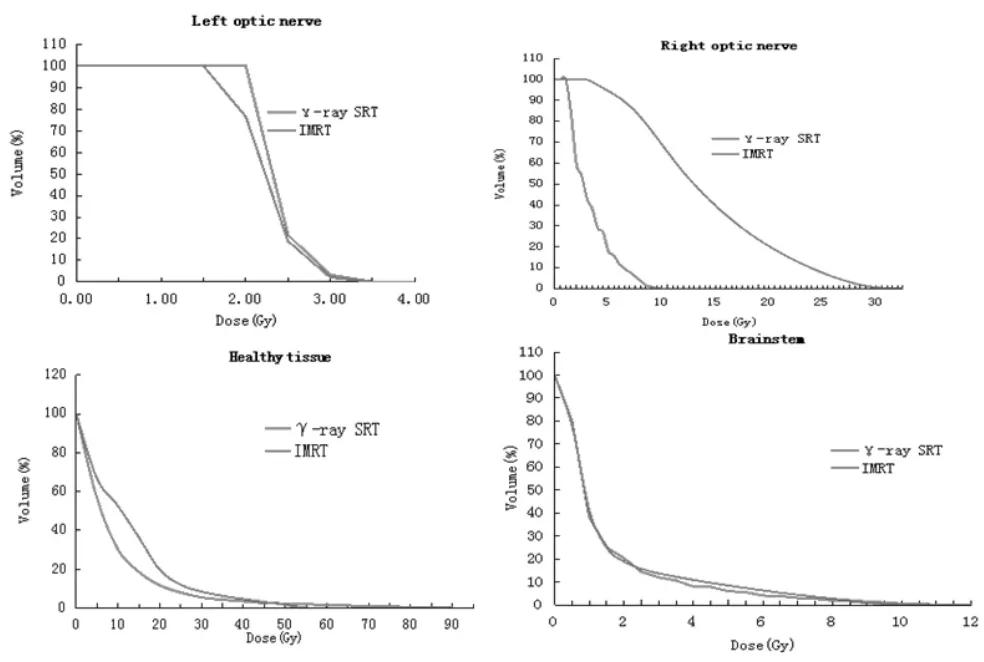
图3 IMRT与γ-射线SRT在PTV、脑干、眼晶状体、眼神经及健康组织的平均累加DVH比较
γ-ray SRT的CI较差。γ-ray SRT的等剂量曲线主要是圆形或椭圆形,虽然在制定计划时能够通过各种参数的调整组合出不同形状的等剂量线并尽量考虑对靶区附近危及器官的防护,但是当靶区形状不规则时γ-ray SRT的CI大幅度降低。另外,由于γ-ray SRT计划采用正向计算,CI的结果或多或少受到人为因素的影响。IMRT凭借其逆向设计思路通过多叶准直器的遮挡实现射线强度的不均匀输出,使靶区的剂量分布更趋向于合理,表现出更好的CI,同时对邻近重要组织有较好的保护作用[13,14]。
γ-ray SRT计划设计者通过主动避让较好的保护危及器官,IMRT在计划优化过程中通过目标函数的设置也能将危及器官剂量限定在合理的范围内,二者统计结果无显著性差异。值得注意的是,在做IMRT计划时,在正常组织耐受的范围内为了显著提高靶区适形性和靶区剂量包绕,很可能会放宽正常组织的条件,从而很可能会降低IMRT在正常组织保护方面的优势。如果从尽量限制正常组织受量为主要目的进行设计,理论上IMRT可以在视神经、晶体等的保护上做得更好,但很可能会使靶区的适形性优势有所降低。
γ-ray SRT从焦点到外围陡峭的剂量梯度类似外科手术刀锋利的边缘,对保护周围正常组织大有益处[12],本文结果显示 γ-ray SRT 比 IMRT 减少了21%~41%正常脑组织10~30 Gy剂量区域照射体积。这一结论与Ma等[15]研究的5~30 Gy剂量区域照射体积在旋转调强(rapid arc,RA)与固定野调强(IMRT)之间的差异类似。Ma等研究结果显示RA的10~30 Gy剂量区域照射体积比IMRT小,而5 Gy剂量区域照射体积比IMRT大。另外由于γ-ray SRT的CI较差导致靶区周边部分正常脑组织剂量较高,在正常脑组织DVH中有所体现。
相比于 RA治疗脑转移瘤 1.25~2.5的照射时间[15],γ-ray SRT 和 IMRT 所需要的照射时间要长得多,分别为(14.65±5.65) min 和(7.18±0.52) min。IMRT的照射时间相对固定,γ-ray SRT则不同。γray SRT的治疗时间首先受到脑转移瘤个数的影响,肿瘤个数越少需要的靶点数就越少,照射时间也就越少。其次,γ-ray SRT使用60Co作为放射源,治疗时间受到初装放射源总活度和使用年限的影响,随着使用年限的延长,治疗时间越来越长。另外对单次总治疗时间的评估还需要考虑以下几个方面:①治疗前的准备:放疗技师的摆位过程以及治疗前的位置验证过程;②治疗过程中2次照射之间设备的重新准备:例如IMRT治疗大机架(Gantry)从某一治疗位置转到下一治疗位置,MLC分割的多子野导致MU数的增加(deliver split fields with more,MUs),γ-ray SRT 治疗中两靶点之间治疗床的移动等。除个别单发脑转移瘤,γ-ray SRT在治疗时间上是没有优势的。治疗时间的延长降低了患者在紧绷的固定面罩下的舒适性,增加了患者治疗中位移的风险。随着设备使用年数的增加,γ-ray SRT的治疗效率逐渐减低。
综上所述,γ-ray SRT和IMRT均能达到脑转移瘤放疗所要求的剂量学要求,凭借高剂量分布梯度,γ-ray SRT能够更有效地保护正常脑组织,并能提高靶区的等效生物剂量,但靶区适形度稍差,这对靶区周边正常组织有不同程度的损伤。γ-ray SRT和IMRT均需花费较长的治疗时间,尤其是γray SRT。治疗时间延长增加治疗中患者移动的概率从而导致治疗精度的降低[16]。跳数(monitor units,MU)的增加和更大面积的正常组织暴露于低剂量辐射,提高了放疗结束后二次肿瘤的风险[17],这种风险需更多模型的建立和临床研究来证实。
[1] Schouten LJ,Rutten J,Huveneers HAM,et al.Incidence of brain metastases in a cohort of patients with carcinoma of the breast,colon,kidney,and lung and melanoma[J].Cancer,2002,94(24):2698-2705,2002.
[2] Nussbaum ES,Djalilian HR,Cho KH,et al.Brain metastases.Histology,multiplicity,surgery,and survival[J].Cancer,1996,78(8):1781-1788.
[3] Gavrilovic IT,Posner JB.Brain metastases:epidemiology and pathophysiology[J].J Neurooncol,2005,75(1):5-14.
[4] Gaspar L,Scott C,Rotman M,et al.Recursive partitioning analysis(RPA) of prognostic factors in three Radiation Therapy Oncology Group (RTOG) brain metastases trials[J].Int J Radiat Oncol Biol Phys,1997,37(7):745-751.
[5] Jawahar A,Shaya M,Campbell P,et al.Role of stereotactic radiosurgery as a primary treatment option in the management of newly diagnosed multiple(3-6) intracranial metastases[J].Surg Neurol,2005,64(3):207-212.
[6] Serizawa T.Radiosurgery for metastatic brain tumors[J].Int J Clin Oncol,2009,14(4):289-298.
[7] Bhatnagar AK,Flickinger JC,Kondziolka D,et al.Stereotactic radiosurgery for four or more intracranial metastases[J].Int J Radiat Oncol Biol Phys,2006,64(3):898-903.
[8] Edwards AA,Keggin E,Plowman PN.The developing role for intensity modulated radiation therapy (IMRT) in the nonsurgical treatment of brain metastases[J].Br J Radiol,2010,83(986):133-136.
[9] International Commision on Radiation Units and Measurements.Prescribing,Recording and Reporting Photon Beam Therapy[M].ICUR 50,1993.Bethesda.
[10] Paddick,B.I.A simple scoring ratio to index the conformity of radio-surgical treatment plans.Technical note[J].J Neurosurg,2000,93(Suppl 3):219-222.
[11] Kim SH,Kang MK,Yea JW,et al.The impact of beam angle configuration of intensity-modulated radiotherapy in the hepatocellular carcinoma[J].Radiat Oncol J,2012,30(3):146-151.
[12] Xia T,Li H,Sun Q,et al.Promising clinical outcome of stereotactic body radiation therapy for patients with inoperable Stage I/II non-small-cell lung cancer[J].Int J Radiat Oncol Biol Phys,2006,66(2):117-125.
[13] Esiashvili N,Koshy M,Landry J.Intensity modulated radiation therapy[J].Curr Probl Cancer,2004,28(2):47-84.
[14] Bucci MK,Bevan A,Roach MI.Advances in radiation therapy:conventional to 3D,to IMRT,to 4D,and beyond[J].CA Cancer J Clin,2005,55(2):117-134.
[15] Ma Y,Li M,Yin Y,et al.Hypofractionated stereotactic radiotherapy for brain metastases: a dosimetric and treatment efficiency comparison between volumetric modulated arc therapy and intensity modulated radiotherapy[J].Technol Cancer Res Treat,2010,9(5):499-507.
[16] Hoogeman MS,Nuyttens JJ,Levendag PC,et al.Time dependence of intrafraction patient motion assessed by repeat stereoscopic imaging[J].Int J Radiat Oncol Biol Phys,2008,70(6):609-618.
[17] Hall EJ.Intensity-modulated radiation therapy,protons,and the risk of second cancers[J].Int J Radiat Oncol Biol Phys,2006,65(1):1-7.
