酵母菌发酵人参药渣产物对肠道黏膜损伤小鼠肠道IgA分泌的影响*
2015-12-02练高登冯佳婷
练高登,谢 辉,冯佳婷,肖 丹
(长春工业大学)
0 引言
近代以来,中药告别了传统的单一个体应用的时代,开始了中药制剂、中成药等企业化、规模化生产,随之产生的中药药渣也以每年数十万吨递增、积累.据文献报道,中药药渣中残留约30%~40%的药用指标成分外,还大量的粗蛋白、粗脂肪、有机物、微量元素及一些未知的促生长物质.李艳军等[1]对藿香正气药渣中的营养物质含量进行测定,结果表明粗蛋白含量约为13%,粗脂肪约为3%,各种纤维含量约为60%,钙磷含量约为7%左右.将其按一定比例添加到泌乳母兔的饲料中,对母兔的泌乳及仔兔的生长性能都有提高.由此表明,直接将加工后的中药药渣直接添加与饲料中,会影响到饲料的适口性,甚至会产生毒性.借助于微生物的分解作用可以降低药物的毒副作用,同时可以促进中药中的一些大分子如纤维素等的生物转化,提高小分子蛋白和游离氨基酸的含量[2-3].王兵等[4]利用白腐菌对中药渣进行固态发酵,其蛋白质量分数高71%,而粗纤维质量分数降低了12%.利用微生物对药渣进行发酵,提前能把药渣中营养早分离早分解,提高吸收率,同时发酵药渣中含有大量的益生菌存在,促进肠道微生态的平衡.因此最终得到的产品具有中草药和微生物的双重功效.微生物发酵中药药渣在当今动物生产上的应用与开发将成为人们研究的一大热点[5].
人参提取工艺多采用醇提法提取含皂苷等活性成分,研究表明用60%乙醇提取人参后的药渣,含有大量的人参总皂苷及多糖,同时还含有大量的人参木质素及纤维、蛋白质、淀粉.杨东川等[6]研究发现利用枯草杆菌发酵红参药渣后对小鼠的繁殖性能具有一定的促进作用.酵母菌是一些单细胞真菌,是人类文明史中被应用得最早的微生物.该菌种因分布广泛,培养简单,易于分离,耐热,抗逆性强等特点而成为微生物发酵研究的热点[7-8],同时酵母菌也是肠道微生态的调节剂.肠道微生态一直被认为广泛地参与了宿主营养吸收,肠道与免疫系统的发育等重要的生理过程,其变化与多种疾病的发生,发展和转归密切相关.刘艳艳等研究表明灌胃人参皂苷后小鼠肠道菌群结构发生改变,荧光假单胞菌和丁酸梭菌数量明显增加[9].但有关于人参药渣对肠道黏膜保护作用的研究的尚未有报道.
该研究采用环磷酰胺腹腔注射小鼠,构建肠道黏膜损伤的动物模型,研究酵母菌发酵人参药渣后的产物对肠道黏膜免疫保护作用.以期为开发动物肠道黏膜损伤性疾病的功能性饲料及中药渣发酵产物的再利用提供依据.
1 材料和方法
1.1 材料
1.1.1 实验动物
BALB/c小鼠(健康,体重18~22 g,6~8周龄),购自吉林大学实验动物中心.
1.1.2 实验药品
酵母菌(Bacillussubtilis,由长春工业大学制药教研室提供);人参中药渣(由吉林省人参科学院提供);环磷酰胺购自吉林省药品监督所;,Mouse SIgA ELISA Kit,小鼠单克隆β-actin-HRP,羊抗鼠IgA-HRP等购自北京宝泰克公司.
牛肉浸膏、蛋白胨、氯化钠、磷酸二氢钾、氢氧化钠SDS、甘氨酸、过硫酸铵(APS)等购自上海浩然生物制品有限公司.
1.1.3 主要仪器
电子天平(上海卓精电子科技有限公司);高压灭菌锅(德国IRM公司);电热鼓风干燥箱(上海典晟试验实验仪器厂);粉碎机(潍坊设备厂);XSP-35TV光学显微镜(深圳博士达光学仪器有限公司);ELx808酶标仪(美国伯腾公司;Gel Doc XR+凝胶成像分析系统(美国伯乐);卧式恒温摇床(上海典晟试验实验仪器厂).
1.2 方法
1.2.1 液体培养基制备
分别称取牛肉浸膏 5.0 g、蛋白胨 10.0 g、氯化钠5.0 g置于 1000 mL烧杯,加入蒸馏水800 mL,加热搅拌至混匀.静置冷却至室温,加入氢氧化钠溶液调 pH=7.2~7.4后加水至1000 mL.将制备好的液体培养基平均分装于3个锥形瓶,于121℃、0.1MP条件下灭菌30 min.
1.2.2 种子液制备
取适量酵母菌接种于上述培养基中,置于摇床中震荡培养过夜(37℃﹑160 r/min).采用麦氏比浊法测定菌液浓度,菌液浓度达1×109cfu/mL可用于发酵试验.
1.2.3 人参药渣的发酵
将醇提过的人参药渣烘干后粉碎过筛,取20 g药渣于100 mL锥形瓶,加入12 mL的蒸馏水(W/V=0.6放于高压灭菌锅内121℃灭菌30 min.冷却至37℃后,接种培养好的酵母菌菌液(接种量约为5%).将接种后的锥形瓶中液体混匀置于37℃下发酵培养5~7d后烘干(25~30℃).
1.2.4 阳性对照药品用量确定
人参皂苷Rg3具有提高人体免疫力的功能,临床上常用来辅助治疗肿瘤.根据关于人参皂苷Rg3提高免疫力的相关报道[10-12],经实验表明选取Rg3的剂量为15 mg/kg(与体重比)为阳性对照药的用药剂量.
1.2.5 人参药渣发酵产物最佳添加比例的确定
选取24只BALB/c小鼠饲养一周后,随机分成4组,每组6只.依次按1%﹑3%﹑5%的比例在饲料中添加发酵后的人参药渣,并设置空白对照组.在保证次日投料有剩余的前提下,相同饲喂量饲喂一周.观察各组采食,饮水,排便及体重变化,比较料重比及日增重得出药渣最佳添加比例.
1.2.6 动物模型的建立及饲喂试验
选取32只BALB/c小鼠,适应性应性饲喂一周后,随机分为4组,每组8只.分别按照表1进行小鼠的饲喂试验.发酵人参药渣按试验1.2.5得出的最佳添加的比例与饲料混合.在相同的条件下饲喂各组小鼠,每天定时记录各组小鼠的饲料消耗,计算平均日采食量.饲喂一周后对各组小鼠进行体重测定,计算各组小鼠平均的日增重及料重比.分别将模型组,阳性对照组及人参药渣组的小鼠腹腔注射环磷酰胺(5 mg/g),正常组注射等体积的灭菌生理盐水.相同条件下连续饲养三周后,将小鼠禁食不禁水24 h,进行各项指标检测.
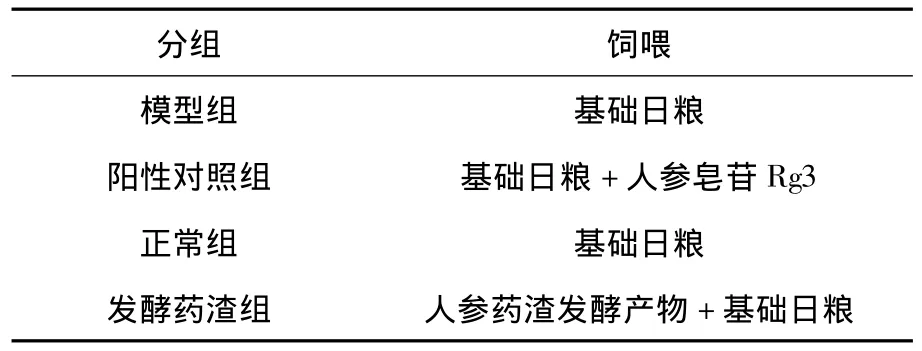
表1 小鼠分组饲喂情况
1.2.7 小肠黏膜SIgA含量测定
参照文献[13]申金雁等方法剪取空肠段约5 cm,轻轻去除内容物后,用灭菌的生理盐水冲洗.纵向剪开肠壁,用载玻片刮取肠黏膜.准确称取1g的黏膜液,加入18 mL PBS(pH=7.4)漂洗冰浴匀浆,5000 r/min离心10 min.收集上清液即为10%的黏膜液,按鼠SIgA-ELISA试剂盒说明书,测定单位质量小肠SIgA的含量.
1.2.8 Western-blotting检测小肠 IgA 的表达量
在肠道分泌物中存在大量的分泌型的IgA(SIgA),约占IgA总量的60%以上,在粘膜免疫中发挥重要作用.为进一步研究发酵人参药渣对小肠黏膜IgA抗体表的影响及与小肠SIgA的相关性,对各组小鼠中IgA抗体含量进行检测.按1.2.7方法取出约0.2g小肠,用生理盐水反复冲洗肠腔至无血迹,用组织剪剪碎.按每100mg组织加入1 mL的含0.01 mmol/L PMSF的RIPA组织裂解液.用组织匀浆机混匀,置于冰浴中裂解20 min后,12000 r/min离心取上清(10min).BCA法测定蛋白样品浓度并将蛋白浓度调节至10 mg/mL.将按文献方法[14]进行的蛋白质 SDS-PAGE电泳及 Western-blotting检测.选用5%的脱脂奶粉为封闭2液,抗稀释比分别IgA为1∶3000;β -actin 为 1∶2000.ECL 显色,暗室中压片曝光.将胶片扫描拍照后,利用灰度扫描比对软件进行比对.记录各试验组的IgA条带与β-actin条带的积分光密度值,每个蛋白重复3次.用两者平均值的比值表示该样本IgA的相对表达量.
1.2.9 数据统计学分析
试验数据采用 SPSS 20.0统计软件分析进行单因素方差分析,F检验比较组间差异.(P<0.05为差异显著,P <0.01为差异极显著).
2 结果与分析
2.1 小鼠体质量变化
由图1可知,未注射环磷酰前,各组小鼠体质量(相对体重的百分比)变化不大,增加缓慢.一周后进行腹腔注射环磷酰胺造模药物后,模型组、阳性对照组及药渣组小鼠于三周后(第26天)体质量均出现显著下降.提示酰胺对正常小鼠肠道黏膜造成损伤,影响了肠道正常化吸收功能,从而导致小鼠体质量下降.由图2可知造模前后各组小鼠体质量的相对变化率,结果表明与模型组相比,阳性对照组及药渣组体质量降低率低,但未呈现显著性差异.
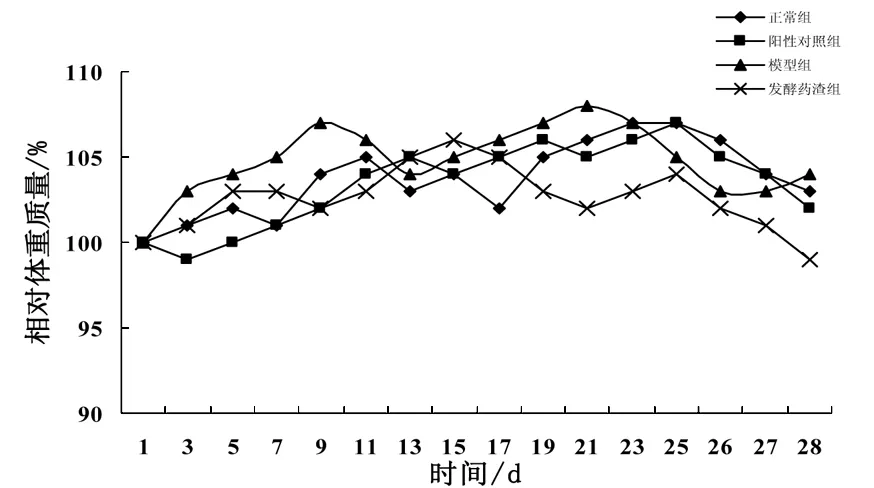
图1 小鼠体质量的变化情况(±S,n=8)

图2 造模后小鼠体质量的变化±s,n=8)
2.2 肠黏膜SIgA含量
肠道黏膜免疫系统损伤时一些密切相关的免疫因子如SIgA也会有所变化.由图3数据可知,模型组与正常组小鼠肠道SIgA的含量相比差异极显著(P<0.01)且降低了32.81%,表明成功构建了肠黏膜免疫屏障损伤的小鼠模型.发酵人参药渣组SIgA含量相比模型组差异极显著(P<0.01)且提高了43.43%,与阳性对照组和正常组相比差异不显著.阳性对照组与模型组相比,其SIgA含量含量提高了47.57%.投喂发酵人参药渣后小鼠黏膜SIgA的相对含量显著升高,表明发酵的人参药渣对肠黏膜损伤小鼠具有促进SIgA分泌的作用,SIgA分泌量的变化揭示了肠道免疫屏的改变.因此,该试验结果表明发酵人参药渣对肠道免疫屏障起到一定保护作用.
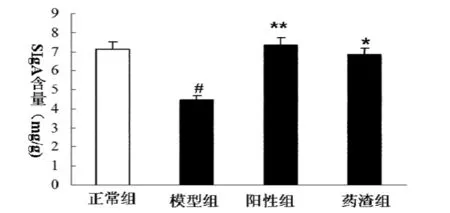
图3 肠黏膜SIgA含量±s,n=8)
2.3 小肠IgA蛋白表达量
小肠IgA蛋白表达水平揭示了肠道免疫水平.由图4可知,在造模后模型组肠道内IgA蛋白表达量与正常组相比显著降低,差异极显著(P<0.01).在进行饲喂试验后,投喂人参药渣组与模型组相比表达量显著提高,两组间差异显著(P<0.05),而与阳性对照组相比差异不显著.表明发酵人参药渣组可提高IgA蛋白表达量,从而提高肠道粘膜免疫的水平.不同试验组中IgA蛋白表达量的变化与小鼠肠道黏膜SIgA抗体变化一致,表明两者之间正相关.该试验结果表明,投喂人参药渣可以促进小鼠肠道黏膜SIgA分泌,这可能与小肠IgA的表达量上升相关.

图4 小肠IgA蛋白相对表达量±s,n=3)
3 讨论
肠黏膜免疫屏障是机体抵制外来病原微生物侵扰的重要防线,当其损伤等应激情况下,肠黏膜结构及免疫功能会受到损伤,如SIgA含量减少等[15].环磷酰胺(cyclophosvnamide,CTX)是一种化疗药物,在杀伤癌症细胞的同时,可对肠粘膜屏障造成损伤,并损伤免疫功能.周华等详细阐明了环磷酸酰胺对小鼠肠黏膜免疫功能的影响[16].目前利用该药物已成为首选的药物被应用于构建小鼠肠黏膜损伤的模型.该研究采用常规方法,腹腔注射环磷酰胺构建小鼠肠道粘膜损伤模型.通过检测不同试验组中SIgA含量及IgA蛋白的表达量,比较分析发酵人参药渣对小鼠肠道粘膜免疫的作用.该研究结果表明,投喂发酵人参药渣组小鼠肠道SIgA含量与模型组相比显著升高(p<0.01),与阳性对照组相比差异不显著.SIgA是肠黏膜免疫屏障的主要效应因子,不但有防御和清除病原体和毒素的作用,还能减弱免疫耐受的形成[17-18].肠道内SIgA主要由肠黏膜中的成熟浆细胞分泌,笔者认为发酵人参药渣可同通过非特异性的免疫刺激,刺激了浆细胞分泌SIgA,使肠道SlgA维持在一个较高的水平,改善肠道局部免疫功能.
研究表明,sIgA介导的肠黏膜免疫应答在很大程度上依赖于细胞因子的参与如GALT的T细胞和白细胞介素、转化生长因子等[19].但关于SIgA与IgA含量在相同环境中的变化及相关性的报道很少,该研究进一步表明发酵人参药渣不但促进SIgA分泌量,还可以显著提高小肠组织的IgA蛋白表达量.提示发酵药渣可能通过促进肠道浆细胞分泌IgA蛋白的同时促进sIgA的分泌,但是IgA的含量变化与SIgA的增加量并未呈现线性关系,推测SIgA的分泌可能受多方面因素的影响,除了受IgA含量的影响外,还可能与其它蛋白(pIgR)及细胞转运功能有关.
该研究结果表明发酵人参药渣可增强肠道免疫机能,提高肠道粘膜免疫能力,进而可改善环磷酰胺诱导的小鼠肠黏膜损伤.其作用机理是促进了肠道分泌IgA和SIgA蛋白.该研究为人参药渣的综合利用提供了技术支撑和理论依据,同时为肠道分泌IgA和SIgA蛋白的机制研究奠定基础.
[1] 李艳军两种复方中药药渣饲用和药用价值评价及利用研究.[M].河南农业大学硕士论文,2011.
[2] 王建芳,徐春,徐萌萌,等.利用香菇发酵中药废渣提高利用价值的研究[J].四川大学学报,2007,44(2):451-454.
[3] 尹小良.中草药渣饲料添加剂开发利用研究进展[J].现代农业科技,2011(5):322-323.
[4] 王兵,王向东,秦岭,等.中药渣固态发酵生产蛋白饲料[J].食品与生物技术学报,2007,26(4):77-82.
[5] 陈庆森,刘剑虹,蔡红远,等.多菌种共发酵生物转化天然纤维素材料的研究[J].天津商学院学报,2000,20(3):l-6.
[6] 杨东川,古江,昝述海,等.枯草芽孢杆菌发酵红参药渣产物对小鼠生长和繁殖性能的影响[J].四川农业大学学报,2014,32(4):446-450.
[7]朱德文.农作物秸秆用作动物饲料-可行性与限制性因素分析[J].饲料研究,2003,2:14-15.
[8] Yang S Y,Ji K S,Baik Y H,et al.Lactic acid fermentation of food waste for swine feed [J].Bioresour Technol,2006,97(15):1858-64.
[9] 刘艳艳,张凯,关家伟,等.人参皂苷对BALB/c小鼠肠道菌群的影响.现代生物医学进展,2015,6:23-26.
[10]赵文杰.创新抗癌药物20(s)-人参皂苷Rg3的研究.吉林大学博士论文,2009.
[11] Keum Ys,Han S S,Chun K S,et al.Inhibitory effects of the ginsenoside Rg3 on phorbol ester-induced cycloxygenase-2 espression,NF-kappaB activation and tumor promotion[16].Mutat Res,2003,523-524:75-85.
[12] Patrick Y K,Yue,Daisy Y l,Wong P K,et al.The angiosupressive effects of 20(R)-ginsenoside Rg3[J].Biochemical Pharmacology,2006,72(4):437-445.
[13]申金雁,孟晓丽,殷国荣,等.弓形虫感染鼠小肠IgA分泌细胞数量与IgA水平动态变化[J].中国寄生虫学与寄生虫病杂志,2010,1:21-25.
[14]张任飞.幽门螺杆菌重组VacACtxB蛋白原核表达及免疫原性研究.[M].重庆医科大学硕士论文,2007.
[15] Resta L S,Barret K E.Live probiotics protect intestinal epithelial cells from the effects of infection with enteroinvasive.Escherichia coli(EIEC)[J].Gut,2003,52(7):988-997.
[16]周华,王培训,刘良.等.环磷酰胺对小鼠Peyer's结和肠道黏膜相关淋巴细胞的影响[J].中国免疫学杂志,2000,17(6):81-83.
[17] Jiraphoeakal S.Influnce of a Dried Bacullus subtilis culture and antibiotics on performance and intentinal microflora in turkeys[J].Tultry Aciencl,1996,69(11):1966-1973.
[18] Bertoloni G,Iapochino G,Radrizzani D,et a1.Early enteral immnnonutrition in patients with severe sepsis[J].Intensive Care Medicine,2003,29(5):834-840.
[19]Motegi Y,Kita H.Interaction with secretory component stimulates effector functions of human eosinophils but not of neutrophils.J Immunol,1998,161(87):4340-4346.
