辽宁沿海菲律宾蛤仔不同地理群体形态差异研究
2015-12-02牛泓博聂鸿涛赵力强霍忠明闫喜武
牛泓博, 聂鸿涛, , 赵力强, 霍忠明, 杨 凤, 闫喜武
(1. 大连海洋大学, 辽宁省贝类良种繁育工程技术研究中心, 辽宁 大连 116023; 2. 大连海洋大学, 农业部北方海水增养殖重点实验室, 辽宁 大连 116023)
菲律宾蛤仔(Ruditapes philippinarum), 俗称蚬子、蛤喇、花蛤等, 属软体动物门(Mollusca), 双壳纲(Bivalvia), 帘蛤目(Veneroida), 帘蛤科(Veneridae),蛤仔属(Ruditapes), 是广温、广盐、广分布的亚热带种, 为人们喜爱的海产贝类之一, 在食用贝类中占有相当重要的地位。据联合国粮食及农业组织(Food and Agriculture Organization, FAO)统计, 全球菲律宾蛤仔的产量占世界贝类总产量的1/5[1]。我国蛤仔年产量在300 万t左右, 占世界菲律宾蛤仔产量的90%以上[2]。由于其营养丰富、味道鲜美, 近年来市场需求量也日益增大。然而由于不注重资源保护, 过度采捕,环境污染严重等原因, 菲律宾蛤仔的产量和品质受到影响。另外, 菲律宾蛤仔产业发展存在的问题还包括良种缺乏, 苗种自给率低以及产品附加值低等[2]。
近年来菲律宾蛤仔养殖业迅猛发展, 北方调入南方苗种频繁, 导致群体间混杂, 容易造成杂交污染, 甚至会导致土著群体的灭绝[2]。因此, 有必要对我国北方沿海菲律宾蛤仔种质资源现状进行评估,而外部形态是种质资源鉴定最简单直观的重要方法之一。国内外学者围绕菲律宾蛤仔所开展的研究工作主要集中在繁殖生物学[3-5]、养殖生态学[6-8]、遗传育种[9-12]以及生理生化[13-14]等方面, 而有关菲律宾蛤仔不同地理群体间形态差异的分析研究, 除邹琰[15]对山东沿海菲律宾蛤仔不同地理群体进行了形态学研究外少有报道。本实验利用形态学指标对辽宁沿海8个菲律宾蛤仔野生群体进行形态学变异分析,查明各群体的形态差异, 为菲律宾蛤仔种质资源的保护以及遗传育种提供依据。
1 材料与方法
1.1 实验材料
本实验所用的菲律宾蛤仔野生群体于2012年11月至 2013年 10月, 分别采自远离养殖区的长兴岛(简称 CXD)、旅顺(LS)、营口(YK)、盘锦(PJ)、锦州(JZH)、海洋岛(HYD)、黑石礁(HSJ)以及金州(JZ)。样品信息见表1。活体样品带回辽宁省贝类良种繁育工程技术研究中心实验室暂养, 并进行生物学测定。
1.2 性状测量及形态指标的设定
每个群体随机选取51个个体, 用游标卡尺对壳长(LS)、壳宽(WS)、壳高(HS)、前缘长(LE)、后缘长(LT)、外韧带长(LY)、外韧带槽宽(WY)、壳厚(TS)等8个指标(图1)进行测量, 精确到0.0l mm。总质量(WT)、软体质量(WM)、壳质量(WSW)用电子天平进行称量, 精确到0.0l g。并观察统计各群体的放射肋条数, 壳内面颜色, 壳面颜色和花纹等性状。8个群体共测定了408个有效样本。为消除菲律宾蛤仔规格不同对形态指标的影响, 以各性状指标的比值作为菲律宾蛤仔形态的分析指标, 依次考量了壳高/壳长、壳宽/壳长、壳宽/壳高、前缘长/后缘长、外韧带槽宽/外韧带长、壳厚/壳长、总重/壳长、软体重/壳长、壳重/壳长等9个指标。
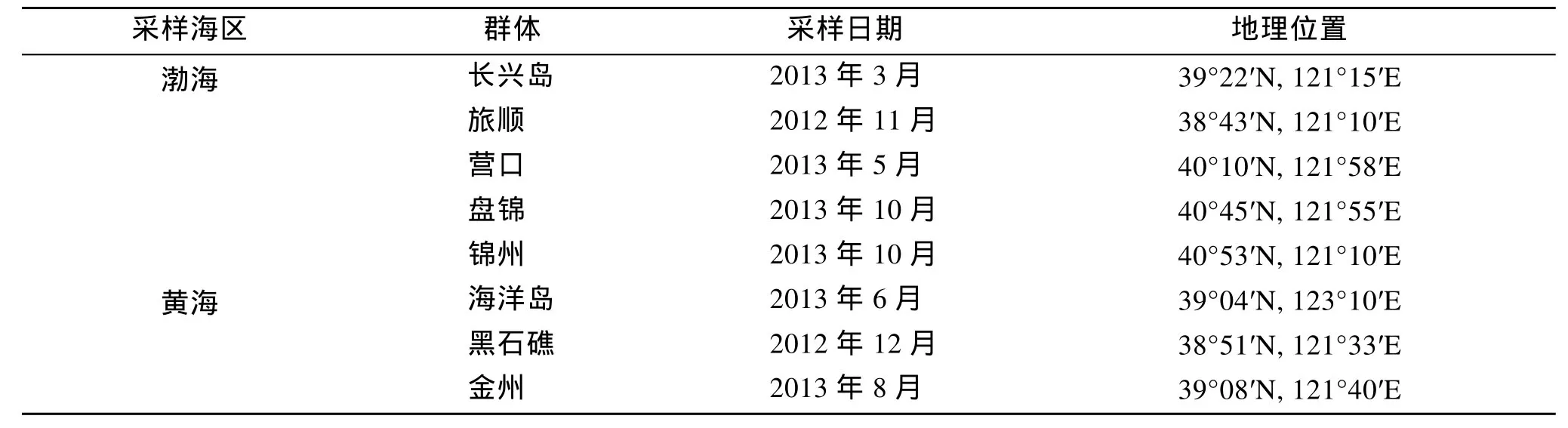
表1 菲律宾蛤仔8个野生群体的样本信息Tab. 1 Information of the eight sampled wild populations of the manila clam Ruditapes philippinarum
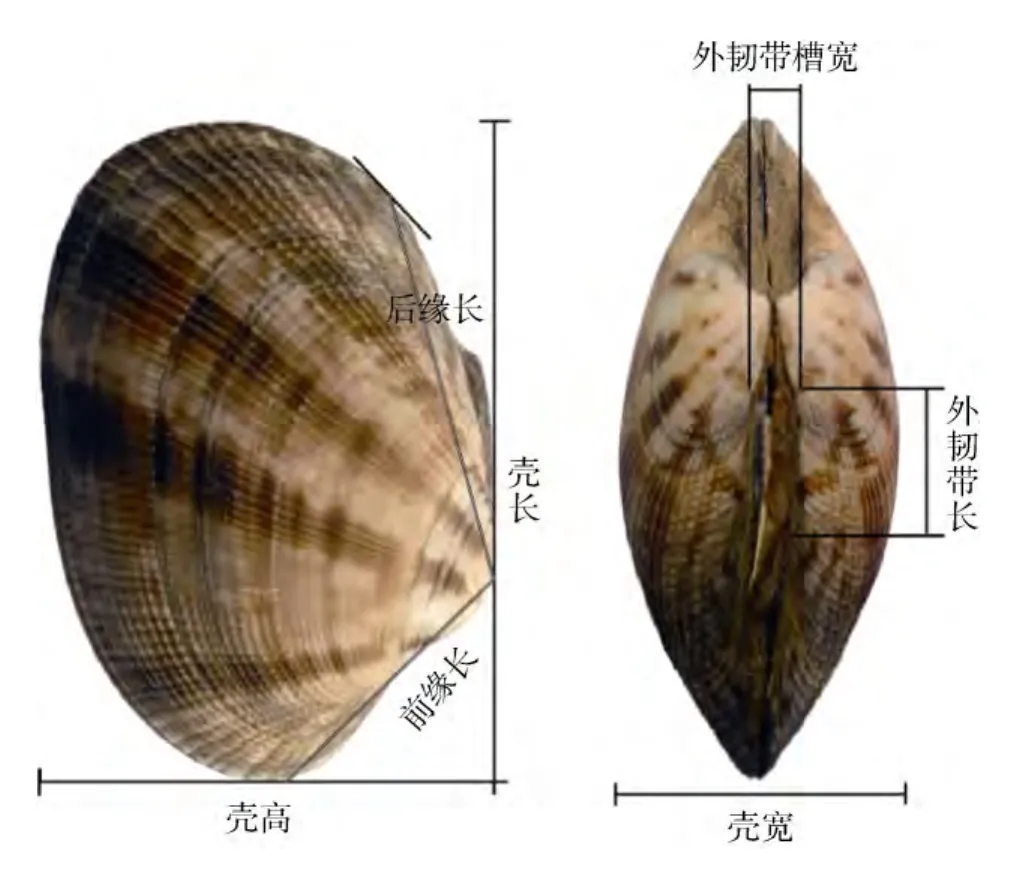
图1 菲律宾蛤仔形态学指标测量Fig.1 Morphological measurements of Ruditapes philippinarum
1.3 统计分析
利用Excel2007计算8个群体的形态学性状的标准差(s)、平均值(x)和变异系数(CV)等基本统计量。按Mayr等[16]的方法进行变异系数的计算, 如变异系数≥1.28, 可视为亚种以上水平的差异。为消除个体大小差异对各参数的影响, 因此将各测定参数转化为性状比例参数进行矫正[17]。利用 SPSS20.0软件,对菲律宾蛤仔群体间各形态学性状差异进行单因素方差(One-way ANOVE)分析和Tukey多重比较。采用SPSS20.0软件对8个菲律宾蛤仔群体形态学差异进行主成分分析[18], 获得影响蛤仔群体间形态差异的主要综合因子。利用各群体 9个形态学指标的均值, 根据欧氏距离的最短距离法采用NCSS 2007统计软件进行系统聚类, 绘制形态差异树状图。
2 结果
2.1 各群体形态指标分析
对不同群体的菲律宾蛤仔12个形态学指标进行测量。统计结果表明, 8个菲律宾蛤仔群体中, 长兴岛群体在壳长、前缘长、后缘长、壳重和壳厚的平均值最大; 金州群体的壳宽, 壳高, 外韧带槽宽和总重4个指标最大; 营口群体的软体重最大; 锦州群体的放射肋条数最多, 平均为80条。在所有群体中, 除了放射肋条数指标外, 盘锦群体的所有指标均为最小。
2.2 各群体形态指标变异分析
8个菲律宾蛤仔群体的9个主要形态指标的统计分析结果见表2。由表2可知, 8个群体菲律宾蛤仔的壳高都小于壳长, 其中长兴岛群体壳高系数(HS/LS)平均值最小, 为 0.687(壳型较扁), 盘锦平均值最大, 为 0.776(壳型较圆); 锦州壳宽系数(WS/LS)较小, 平均值为 0.464, 说明贝壳隆起程度低, 而金州群体平均值最大为 0.507, 贝壳隆起程度最高; 在壳厚性状上, 海洋岛群体的壳厚系数平均值最大为0.036, 黑石礁群体最小为 0.023; 在 8个群体中, 壳厚、总质量、软体质量和壳质量, 变异系数均超过了10%, 部分值超过了20%, 说明这4个性状在群体内个体间具有广泛的变异。

表2 菲律宾蛤仔8个群体主要形态性状的统计量Tab. 2 Variations of individual morphological traits among eight populaions of R. philippinarum
2.3 方差分析
8个群体菲律宾蛤仔各形态学变量的单因子方差分析结果见表3。通过检验结果可以看出, 各群体的形态学变量在群体间的差异均成极显著(P<0.01),说明群体间的形态差异是真实存在的, 在这些形态指标上对群体进行鉴别提供了可能。

表3 菲律宾蛤仔8个群体形态性状的方差分析Tab. 3 ANOVA analysis of nine morphological parameters among eight populations of R. philippinarum
2.4 主成分分析
为明确菲律宾蛤仔 8个群体形态差异的主成分因子, 采用SPSS20.0统计软件对校正获得的菲律宾蛤仔形态学指标进行综合运算, 获得3个互不关联的主成分, 主成分分析结果见表4。3个主成分的方差贡献率分别为: 主成分 1的贡献率为 40.21%, 主成分 2 的贡献率为 19.98 %, 主成分 3的贡献率为 11.57 %, 累积贡献率为71.75%, 获得的3个主成分可解析群体间形态学变异的 71.75%。在主成分 1中, 总质量/壳长影响最大, 其贡献率为和 89.70%,其次为壳宽/壳高影响也较大为和85.10%; 在主成分2中, 壳宽/壳长的影响最大, 其贡献率为 75.70%,其次为壳高/壳长影响较大为71.40%; 在主成分3中,壳质量/壳长影响最大, 其贡献率为65.20%。
2.5 聚类分析
根据不同海区的 8个菲律宾蛤仔野生群体聚类分析的结果可以看出旅顺、锦州、盘锦之间形态差异不大较为接近, 其中旅顺群体和锦州群体形态最为接近, 而与黑石礁群体差异较大。营口群体的趋异程度最大, 与其他7个群体的形态差异最大。长兴岛群体、金州群体和海洋岛群体的趋异程度居中(图2)。
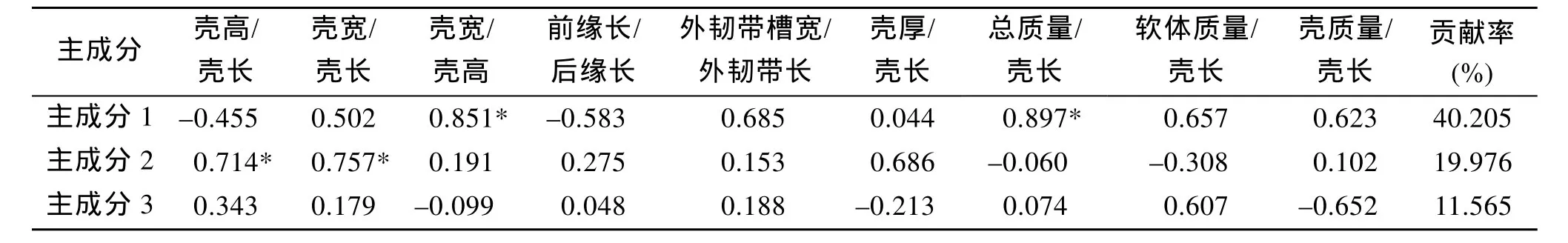
表4 菲律宾蛤仔8个群体形态性状的主成分贡献率及负荷值Tab. 4 Contribution ratios and loading of principal components for nine morphological traits of eight populations of R.philippinarum
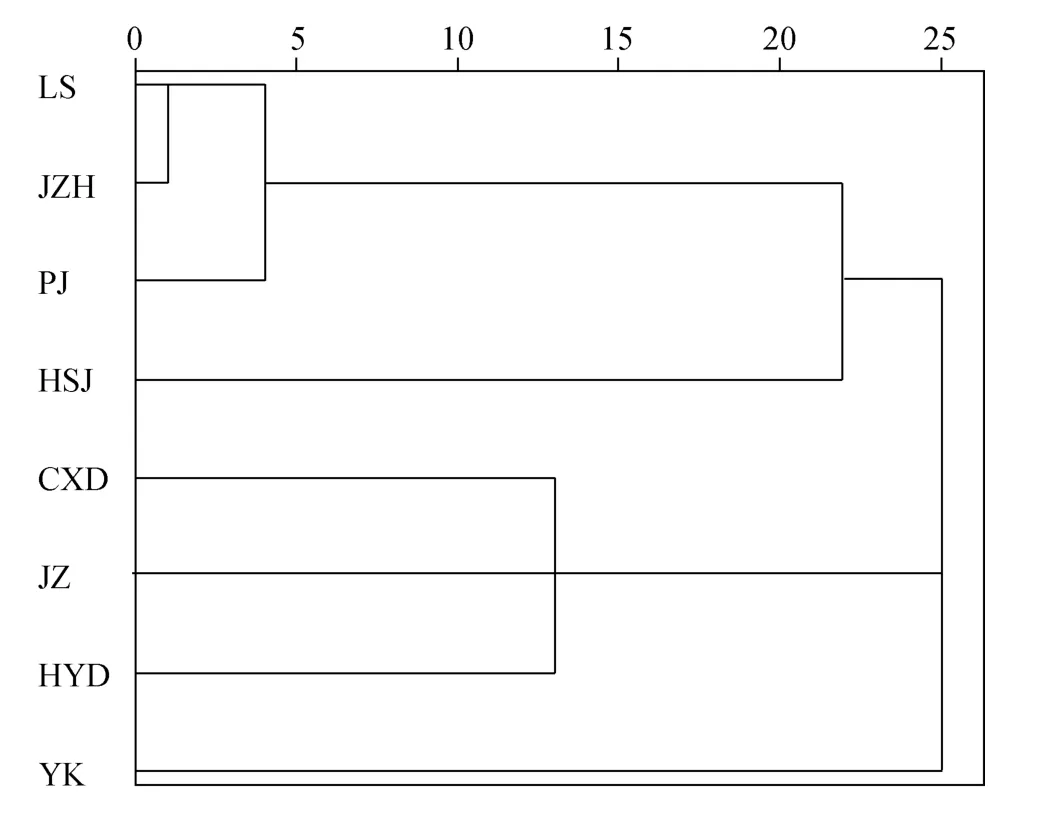
图2 菲律宾蛤仔8个群体形态性状聚类图Fig. 2 Clustering dendrogram by morphological traits from eight populations of Ruditapes philippinarum
3 讨论
3.1 菲律宾蛤仔不同地理群体的形态差异
菲律宾蛤仔属于广分布性海洋贝类, 各海域生态环境的均有差异, 造成不同海域菲律宾蛤仔群体之间的差异。不同菲律宾蛤仔群体的壳内颜色以及壳面颜色和花纹都有一定的差异。本研究显示, 盘锦、海洋岛、黑石礁和金州群体壳内面颜色为白色,其他四个群体为橙色或浅橙色; 长兴岛、海洋岛、黑石礁和金州群体的壳面颜色较深, 另外 4个群体颜色较浅为黄褐色或浅褐色; 8个群体壳面花纹主要呈斑块状, 点状和锯齿状。由此可见, 不同海区的菲律宾蛤仔形态特征有所不同, 渤海海区菲律宾蛤仔壳内面颜色较深, 呈橙色或是黄色, 壳面颜色较浅; 黄海海区菲律宾蛤仔群体壳内面颜色大多为白色,壳面颜色较深。说明壳内颜色和壳面颜色也是区别菲律宾蛤仔不同群体的特征之一。壳色作为可遗传的性状, 可能与贝类的遗传、生理特性以及生态环境有关[19]。
菲律宾蛤仔 8个野生群体在形态上显示一定程度的差异。长兴岛群体壳型最扁, 贝壳较厚且重; 旅顺群体壳型偏圆, 壳长偏向生长程度最大; 营口群体贝壳较薄, 壳型“凸”型较明显, 软体部最饱满, 贝壳较轻; 盘锦群体壳型最扁, 壳型“凸”型较不明显,软体部偏瘦, 贝壳轻, 质量最小; 锦州群体壳型较圆,壳型“凸”型最不明显, 贝壳较厚; 海洋岛群体壳型“凸”型较明显, 贝壳最重, 壳长偏向生长程度最小;黑石礁群体贝壳最薄但偏重; 金州群体壳型“凸”型最明显, 质量大, 软体部较饱满, 贝壳最重。
通过主成分分析、聚类分析, 结果显示, 旅顺、锦州、盘锦和黑石礁群体间差异较小, 旅顺和锦州的形态差异最小; 长兴岛、金州和海洋岛群体间差异次之; 而营口群体形态差异最大, 显示出较为独立的类群。蛤仔 8个野生群体之间的 9项形态比例参数中4个参数的变异系数均小于1.28 (表2), 说明各群体间壳长, 壳宽, 壳高, 前缘长和后缘长5个形态学性状差异尚未达到亚种水平, 属于不同地理群体之间的差异。
3.2 环境条件对菲律宾蛤仔群体的形态影响
贝类不同地理群体的形态存在一定的差异, 这与温度、盐度、饵料、底质、密度等环境因子有关, 贝类形态的变异是一种生态适应。多数学者认为, 贝类形态变异的原因是对生活环境长期适应的结果, 是遗传因子和环境因子共同作用的结果。么宗利等[20]认为我国沿海青蛤地理群体形态差异的主要因素是温度和盐度, 冯建彬等[21]认为影响我国 4个海区文蛤形态差异的主要原因是温度、盐度、底质和饵料,宋菲菲等[22]认为毛蚶群体变异程度可能与地理距离有一定关系, 同时受到栖息地环境的影响。Laudien等[23]认为浪蛤的形态差异是由地理环境特性决定的,而群体间的遗传相似性则是基因交流, 选择压力和进化造成的。
本实验结果表明, 营口群体菲律宾蛤仔与其他群体差异程度最高, 显示为较独立的类群, 说明菲律宾蛤仔不同群体间的形态变异程度与地理距离有一定关系, 但主要受栖息地环境的影响。菲律宾蛤仔迁移能力较差, 对生活环境有较强的依赖性, 菲律宾蛤仔幼虫的浮游期也较短一般在10 d左右, 因此,地理差异造成的生活环境的不同可能对菲律宾蛤仔的形态有一定的影响。由于贝类对其生活环境的长期适应, 温度、底质以及摄食饵料的种类成为决定变异的主要因子[24-26]。辽宁沿海海岸曲折, 地理条件各异, 形成了多样的生态环境, 使得不同海区生态环境差异明显。例如, 河口海域由于入海河流带来大量冲淡水, 盐度相对较低, 但营养盐丰富。渤海辽东湾为粒质较细的粉砂质土软泥, 黄海西海岸为黏土质软泥。这些环境差异很可能影响到菲律宾蛤仔的生长发育速度, 从而反映为外形量度特征的差异。菲律宾蛤仔 8个野生群体的地理距离与形态差异无明显关联, 应该和生活环境息息相关, 对栖息地不同生态环境的长期适应以及地理隔离使不同群体间基因流受阻可能是导致菲律宾蛤仔各群体形态学差异原因。
3.3 菲律宾蛤仔种质资源的保护与利用
近年来随着我国海水贝类养殖业的发展, 越来越多的生物学家开始重视贝类遗传多样性、遗传育种以及稀缺贝类保护等研究。菲律宾蛤仔在我国分布极广, 由于长期的地理和生殖隔离, 具有较高的杂合性和变异度。辽宁省是我国贝类的主要产区, 由于辽宁地区苗种覆盖率低, 自给率低, 所以需要从南方引进菲律宾蛤仔苗种进行人工养殖。由于养殖品种的外流, 使得本地种群遗传多样性降低, 容易造成杂交污染, 甚至导致土著群体的灭绝。为了保护辽宁地区菲律宾蛤仔土著群体, 评估辽宁沿海菲律宾蛤仔种质资源现状十分必要。本实验运用多个数量性状测量值, 用比例参数来消除可能带来的差异,采用方差和多重比较分析、主成分分析、聚类分析等多种统计方法, 分析各群体的形态指标, 结果相似, 从不同角度反映了菲律宾蛤仔不同群体间的形态差异。本研究通过分析辽宁沿海 8个不同群体的形态差异来对菲律宾蛤仔的种质资源进行评估, 进而提供保护依据。然而只用贝类的形态指标不能完全反映各群体的特性[27], 在后续研究中, 我们又通过与分子遗传学相结合可以更全面地反映群体间的遗传关系[28]。从而保证当地品种区系的组成和生物多样性, 以保证其自然资源的可持续利用。同时对推动辽宁菲律宾蛤仔养殖产业健康可持续发展和辽宁海洋农业的发展提供重要支持。
[1] Food and Agriculture Organization. Fisheries and Aquaculture Department[EB/OL]. [2013-10-17]. http: //www.fao.org/fishery/culturedspecies/Ruditapes_philipp inarum/en.
[2] 张国范, 闫喜武. 蛤仔养殖学[M]. 北京: 科学出版社, 2010.
[3] 梁峻, 闫喜武, 李霞, 等. 菲律宾蛤仔性腺发育生物学零度的研究[J]. 海洋科学, 2007, 31(9): 67-72.
[4] Drummond L, Mulcahy M, Culloty S. The reproductive biology of the Manila clam,Ruditapes philippinarum,from the NorthWest of Ireland [J]. Aquaculture, 2006,254: 326-340.
[5] Lee J S, Park J S, Shin Y K, et al. Sequential hermaphroditism in Manila clamRuditapes philippinarum(Bivalvia: Veneridae) [J]. Invertebrate Reproduction & Development, 2013, 57(3): 185-188.
[6] Yan Xiwu, Zhang Guofan, Yang Feng. Effects of diet,stocking density, and environmental factors on growth,survival, and metamorphosis of Manila clamRuditapes philippinarumlarvae [J]. Aquaculture, 2006, 253:350-358.
[7] Yan Xiwu, Zhang Yuehuan, Huo Zhongming, et al. Effects of starvation on larval growth, survival and metamorphosis of Manila clamRuditapes philippinarum[J]. Acta Ecologica Sinica, 2009, 29(6): 327-334.
[8] Yang Feng, Yao Tuo, Huo Zhongming, et al. Effects of starvation on growth, survival, and body biochemical composition of different sizes of Manila clamRuditapes philippinarum[J]. Acta Ecologica Sinica,2010, 30(3): 135-140.
[9] Yan Xiwu, Huo Zhongming, Yang Feng, et al.Heritability of larval and juvenile growth for two stocks of Manila clamRuditapesphilippinarum[J].Aquaculture Research, 2014, 45: 484-490.
[10] Zhao Liqiang, Yan Xiwu, Huo Zhongming, et al.Divergent selection for shell length in the Manila clam,Ruditapes philippinarum[J]. Journal of the World Aquaculture Society, 2012, 43(6): 878-884.
[11] 赵力强, 闫喜武, 霍忠明, 等. 蛤仔回交家系建立及早期生长发育比较[J]. 海洋科学, 2013, 37(1): 70-75.
[12] 高鑫, 闫喜武, 张辉, 等. 蛤仔南北方养殖群体杂交子代早期生长发育的研究[J]. 大连海洋大学学报,2013, 28(1): 39-43.
[13] 丁鉴锋, 王锐, 闫喜武, 等. 菲律宾蛤仔 3种壳色群体低盐耐受能力的比较研究[J]. 大连海洋大学学报,2013, 28(3): 264-268.
[14] Zhao Liqiang, Zhang Yu, Liang Jian, et al. Environmental cadmium exposure impacts physiological responses in Manila clams[J]. Biol Trace Elem Res, 2014, 159:241-253.
[15] 邹琰. 山东沿海菲律宾蛤仔形态学特征和群体遗传研究[D].青岛: 中国海洋大学, 2010.
[16] Mayr E. Methods and principles of systematic zoology[M]. New York, Toronto London: McGraw-hill book company inc., 1953.
[17] 钱荣华, 李家乐, 董志国, 等. 中国五大湖三角帆蚌形态差异分析[J]. 海洋与湖沼, 2003, 34(4): 436-443.
[18] 刘阳, 赵建, 朱新平, 等. 中华鳖 5个不同群体的形态差异分析[J]. 大连海洋大学学报, 2013, 28(2): 174-178.
[19] 张跃环, 闫喜武, 杨凤, 等. 贝类壳色多态研究概况及展望[J]. 水产科学, 2008, 27(12): 681-684.
[20] 么宗利, 王慧, 周凯, 等. 我国 5 个青蛤地理群体形态差异分析[J]. 海洋水产研究, 2007, 28(2): 63-70.
[21] 冯建彬, 李家乐, 王美珍, 等. 我国四海区不同群体文蛤形态差异与判别分析[J]. 浙江海洋学院学报,2005, 24(4): 318-323.
[22] 宋菲菲, 王其翔, 刘名, 等. 不同地区毛蚶群体的形态差异的比较研究[J]. 中国海洋大学学报, 2012,42(11): 40-45.
[23] Laudien J, Flint N S, van der Bank F H, et al. Genetic and morphological variation in four populations of the surf clamDonax serra(Rding) from southern African sandy beach [J]. Biochemical Systematics and Ecology,2003, 31(7): 751-772.
[24] Esterenet A, L’Martin P. Shell interpopulation variation and its origin inPomacea eanaliculata(Gastopoda:Ampullariidae) from southern Pampas, Argentina [J].Journal of Mollusk Studies, 2003, 69: 301-310.
[25] Innes D J, Bates J A. Morphological variation ofMytilus edulisandM. trossulusin eastern Newfoundland[J]. Marine Biology, 1999, 133: 691-699.
[26] Oniwa K, Kijima A, Fujio Y. Relationship between genetic variability and quantitative traits in Japanese scallop,Patinopecten yessoensis[J]. Tohoku Journal of Agriculture Research, 1994, 45: l-l0.
[27] 尤仲杰, 包永波, 张爱菊. 中国沿海西施舌 5个自然群体形态差异和 RAPD分析[J]. 海洋学报, 2007,29(3): 98-104.
[28] Alberto G M. Morphological variation of horse mackerel (Trachurus trachurus) in the Iberrian and North African Atlantic: Implications for identification[J]. ICES Journal of Marine Science, 2000, 57(4): 1.
