Cu2+对青蛤的胁迫效应
2015-12-02雷雅雲李永仁郭永军邢克智
梁 健, 雷雅雲, 李永仁, 郭永军, 邢克智
(天津农学院 水产学院, 天津市水产生态及养殖重点实验室, 天津 300384)
青蛤(Cyclina sinensis)属帘蛤目、帘蛤科、环文蛤属。主要分布于朝鲜半岛、中国大陆、台湾海区, 常栖息在近高潮区和中潮区的泥沙滩中[1-2]。青蛤生长速度快, 适应能力强, 分布广泛, 种群密度大, 是重要的经济贝类。另外, 由于青蛤成体移动性差, 活动范围较小, 且为滤食性, 易蓄积环境中的重金属离子, 造成自身损害[2]。近年随沿海经济的飞速发展,工业和生活污水的排放量增大, 近岸海域重金属污染日趋严重。有关重金属对滩涂贝类的毒性、免疫指标的报道很多, 如 Cd2+[3]、Pb2+[4]、Hg2+[5]、Zn2+[6]、Cu2+[7]等。但对于铜离子在青蛤体内不同组织的蓄积及对免疫机能的影响尚未见报道。铜作为一种生物体必须元素, 在自然界中少量的存在不会直接威胁到生物体的生存, 但会通过食物链的蓄积作用间接威胁到末端生物的健康。本研究在测定 Cu2+对青蛤的半致死浓度和安全浓度基础上, 观察在不同浓度Cu2+的胁迫下青蛤各组织中蓄积情况及血淋巴液中免疫指标的变化趋势, 探索青蛤的应激反应机制,以期为青蛤健康养殖奠定理论基础。
1 材料与方法
1.1 材料
青蛤取自天津独流减河河口, 个体健康、大小相似, 平均壳长35.32 mm±0.89 mm。在室内暂养5 d,养殖用水为砂滤海水, 盐度25, 温度25~28℃, 暂养期间连续充氧, 每天全量换水1次, 投喂小球藻。暂养后选择闭壳能力强、反应迅速的个体作为试验用贝。
1.2 Cu2+对青蛤的急性毒性实验
根据预实验结果, 参照周永欣等[8]的等对数间距法设置Cu2+离子6个浓度, 分别为0.03、0.06、0.13、0.25、0.50和1.00 mg/L, 及空白对照, 试验设3个平行。每组饲养青蛤10枚, 实验期间不投饵、不充气,每天半量换水1次, 及时挑出死亡个体。实验开始后24、48、72、96 h统计各组青蛤死亡数。贝壳张开, 外套膜收缩, 用玻璃棒轻轻触碰长时间未反应的个体视为死亡。
1.3 青蛤对Cu2+的蓄积实验
1.3.1 实验设计
将健康青蛤暴露在 Cu2+的半致死浓度和安全浓度两种浓度(由前面实验所得出)的养殖环境中, 设 3个平行, 每组150个个体。实验期间不投饵、不充气,每天半量换水1次, 及时挑出死亡个体。实验开始后6、12、36、72、96、120和168 h, 各实验组解剖青蛤5个, 分离鳃和内脏团并称重记录。
1.3.2 Cu2+含量测定
消化试管加入样品和消化液(硝酸和高氯酸 4∶1), 加热消化至液体澄清, 用 1%的硝酸定容。利用天津农学院农业分析测试中心提供的原子吸收分光光度计测定Cu2+浓度。
1.4 免疫指标测定
在蓄积实验中, 分别在 6、12、24、36、48、72、96、120、144、168 h时间点取样, 并设自然海水为对照。每组随机选取5枚青蛤, 从围心腔抽取血淋巴液并混合。在6 000 r/min、4℃下离心10 min, 取上清液, 使用南京建成生物工程公司提供的试剂盒测定超氧物歧化酶(SOD)、过氧化氢酶(CAT)、酸性磷酸酶(ACP)的活性及总蛋白的含量。
1.5 数据处理
用SPSS17.0软件对实验数据进行线性回归分析,计算半致死浓度、95%置信区间和相关系数R。并用T-test对实验数据进行进行显著性检验(P<0.05)。
安全浓度的计算参照公式[9]:
安全浓度(SC)=96h LC50×AF
其中: AF为应用系数, 设为0.01。
2 结果
2.1 Cu2+对青蛤的急性毒性
通过线性回归统计分析, 得到死亡率概率单位与Cu2+浓度对数的相关方程为y=0.146+1.568x, 相关系数R2=0.897。半致死浓度LC50=0.807 mg/L, 95%置信区间为0.548~1.533 mg/L, 安全浓度为0.008 07 mg/L。
2.2 青蛤对Cu2+的蓄积
半致死浓度胁迫下, 青蛤外壳紧闭, 活动逐渐减少。由表2可知, Cu2+在青蛤鳃和内脏团的含量随时间延长而升高, 在鳃中 72~120 h增长迅速, 随后变得平稳, 在 168 h达 8.95μg/g, 平均蓄积速度0.053μg/(g·h)。Cu2+在内脏团中蓄积缓慢, 168 h 达到6.28μg/g, 平均蓄积速度为 0.037μg/(g·h)。整个过程中, 鳃中的Cu2+含量始终高于内脏团。
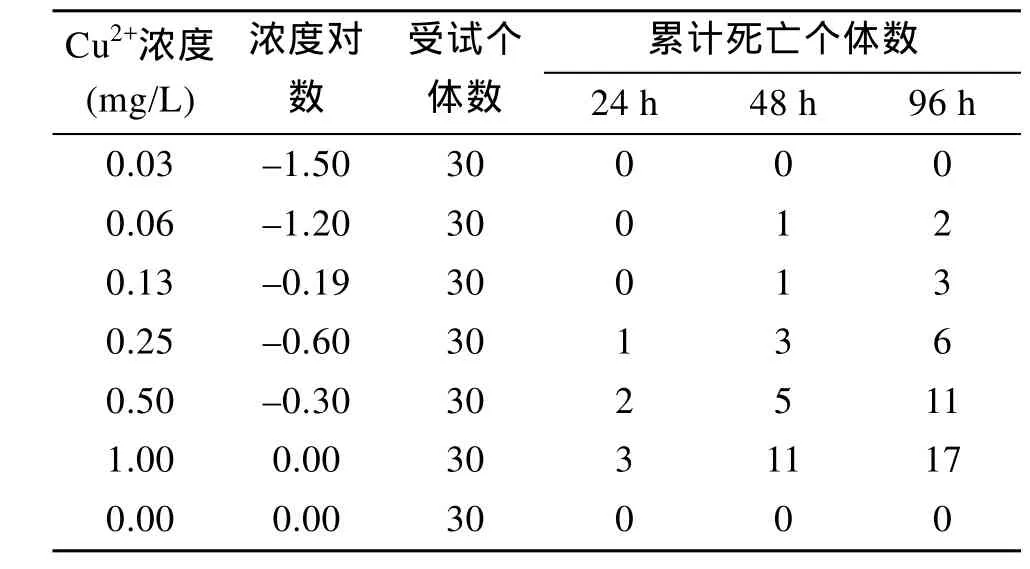
表1 不同浓度Cu2+对青蛤的急性毒性Tab.1 Mortality of C. sinensis exposed to different concentrations of Cu2+
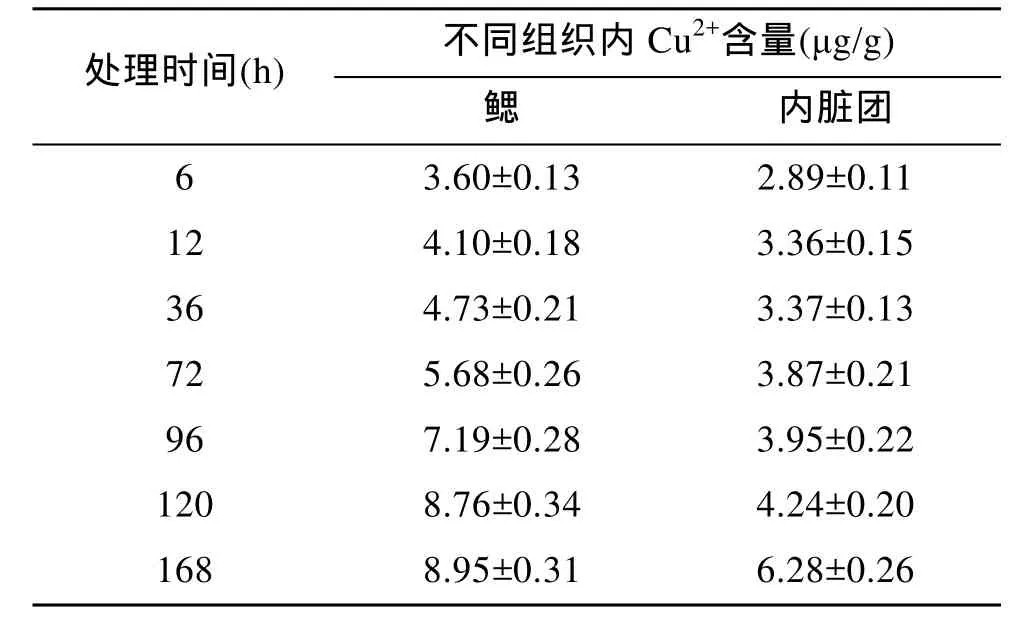
表2 半致死浓度(0.807 mg/L)胁迫下青蛤各组织内Cu2+含量Tab. 2 Cu2+ contents in different tissues of C. sinensis at LC50 (0.807 mg/L)
由表3可知, 安全浓度下, 6 h时鳃和内脏团Cu2+的含量分别为3.8μg/g和2.01μg/g, 且在12 h内增加明显, 随后随处理时间延长缓慢升高。在鳃中的平均蓄积速度为0.033μg/(g·h), 内脏团中平均蓄积速度为0.014μg/(g·h), 鳃组织中Cu2+的含量始终高于内脏团。

表3 安全浓度胁迫(0.008 07 mg/L)下青蛤各组织内Cu2+含量Tab. 3 Cu2+ contents in different tissues of C. sinensis at the safe concentration (0.00 807 mg/L)
2.3 Cu2+对青蛤生化指标的影响
由图1可知, 两实验组SOD活性均高于对照组,半致死浓度处理组从6 h起SOD活性与对照组差异显著(P<0.05), 且逐渐增加, 并于 24 h时达峰值81.55 U/mg; 随后SOD活性下降, 在144 h时与对照组差异不显著(P>0.05); 该处理组全程 SOD活性变化呈“诱导-抑制”趋势。安全浓度处理组SOD活性稳定, 且显著高于对照组(P<0.05)。

图1 不同浓度下Cu2+的青蛤血淋巴SOD活性比较Fig.1 Comparison of the SOD activity of haemolymph in C.sinensis with different concentrations of Cu2+
图2可知, 在36~72 h, 处理组CAT活性显著高于对照组(P<0.05)。半致死浓度处理组在12~48 h内CAT活性增长缓慢, 在72 h达峰值12.35 U/mg, 在96~168 h阶段, 与对照组差异不显著。安全浓度处理组在6~48 h内变化不大, 在72 h达峰值12.26 U/mg。表现出“诱导-抑制-诱导”趋势。

图2 不同浓度下Cu2+的青蛤血淋巴CAT活性比较Fig.2 Comparison of the CAT activity of haemolymph in C.sinensis with different concentrations of Cu2+
图3可知, 6~72 h阶段, 处理组ACP活性与对照组差异显著(P<0.05), 且半致死浓度处理组诱导效应更为明显, 在24 h时出现峰值3.25 U/mg; 安全浓度处理组ACP活性保持稳定, 且高于对照组。
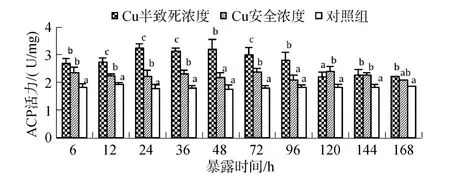
图3 不同浓度下Cu2+的青蛤血淋巴ACP活性比较Fig.3 Comparison of the ACP activity of haemolymph in C.sinensis with different concentrations of Cu2+
3 讨论
3.1 Cu2+在青蛤体内的蓄积
本研究中得到的Cu2+对青蛤的96 h半致死浓度LC50=0.807 mg/L, 安全浓度为0.008 07 mg/L, 张丽岩等[3]研究中指出 Cd2+对青蛤的半致死浓度为LC50=20.09 mg/L, 安全浓度为 0.201 mg/L, 这个数值是Cu2+的近24倍, 说明青蛤对于Cu2+的耐受性远远低于Cd2+。
在半致死浓度和安全浓度胁迫下, 青蛤对 Cu2+的蓄积能力顺序为鳃>内脏团, 这可能与贝类自身生理特性有关。重金属在贝类组织内的蓄积通常有以下几种方式: 一是在呼吸过程中由表皮渗透入鳃组织中, 通过血液循环被输送到其他组织器官; 二是在摄食消化过程中间接地被贝类所摄入。鳃作为呼吸器官直接接触到环境中的 Cu2+, 而在试验过程中不投喂饵料, 降低内脏团通过食物对 Cu2+的蓄积量,导致鳃对 Cu2+的蓄积能力大于内脏团。体表与水体的渗透交换作用是重金属进入贝类体内的一个重要途径[10], 主要有以下的两种模型: 高亲和力的重金属和蛋白结合后被水生生物摄入体内; 重金属离子通过活性泵作用运输到水生生物体内。这导致试验期间未投喂饵料而内脏团具有对Cu2+的蓄积作用。
本试验中所得出的 Cu2+安全浓度(0.008 07 mg/L),未超出国家农业部发布的《无公害食品标准——淡水海水养殖水质》中所要求的0.01 mg/L[11], 而张丽岩等[13]研究 Cd2+对青蛤的安全浓度为 0.201 mg/L, 高于国家标准(0.005 mg/L)40倍。
3.2 Cu2+对青蛤抗氧化酶活性的影响
贝类的免疫主要是其血淋巴液中的细胞免疫和体液免疫, 其中, 血细胞是贝类执行细胞免疫的主要功能因子, 是无脊椎动物免疫系统的首道防线,外界环境的变化会对血细胞的免疫能力产生巨大影响[12]。
一些研究表明, 当贝类受到污染胁迫时, 能够通过呼吸爆发作用产生大量活性氧, 用以帮助机体清除进入体内的病原, 但过量的活性氧会导致生物体体内细胞膜的脂质化程度加快, 造成损伤, 此时,生物体会自动激活体内的抗氧化系统, 以避免活性氧对自身细胞的伤害[13-14]。丁鉴峰等[15]发现, 随着不同地区的污染程度加重SOD活性逐渐升高, 但当污染程度达到一定时, SOD活性会急剧下降, 生物体内出现大量氧自由基, 损伤机体。陈林林等[5]的研究结果表明, 重金属能够在短期内增加紫贻贝抗氧化酶的活性, 但随着胁迫时间的延长, 便会抑制相关抗氧化酶的活性。在本研究中, 半致死浓度(0.807 mg/L)胁迫下青蛤血淋巴液中SOD和CAT的活性均出现了先诱导再抑制的趋势, 这一现象与上述的研究结论相一致。在胁迫初期, 体内迅速产生活性氧, 激活其抗氧化能力, 体内SOD和CAT活性上升, 以保证其细胞膜的脂质氧化程度最低。随着时间的延长, 过多的活性氧便会抑制SOD和 CAT的产生和活性, 便会出现试验后期SOD活性降低的趋势。贝类在长时间重金属胁迫下, SOD、CAT活性则在一段时间后出现大幅度的降低, 表明高浓度金属离子胁迫下抗氧化酶的活性抑制。
而在安全浓度(0.008 07 mg/L)下, 处理组表现出SOD、CAT活性水平高于对照组, 但诱导趋势不及半致死浓度处理组显著。说明 Cu2+胁迫对 SOD、CAT活性的诱导与浓度相关, 在较低浓度时, 诱导效应和抑制效应较弱, 随浓度增加, 诱导效应加强, 达峰值后, 抑制效应也表现显著。
3.3 Cu2+对青蛤水解酶活性的影响
磷酸水解酶(ACP), 简称磷酸酶, 是一类酸性水解酶, 存在于贝类血细胞溶酶体中, 当外来异物进入体内或环境发生变化时, 变可以通过胞内和胞外途径, 催化有机磷酸水解, 释放磷酸根离子, 参与对异物以及病原的杀伤和清除[15]。本研究中, 半致死浓度胁迫下青蛤血淋巴液中ACP活性呈现出先升高后抑制的趋势, 胁迫初期产生诱导现象的原因可能与抗氧化酶机制一致; 胁迫后期ACP活性的降低可能通过以下两条途径所导致: 一是由于污染物造成的贝类血细胞溶解, 导致含有 ACP的溶酶体失活; 二是污染物可能改变血细胞内溶酶体的膜通透性, 导致ACP渗漏[16]。
综上所述, 青蛤养殖环境中的重金属 Cu2+能够产生蓄积作用, 且鳃的蓄积能力要远远强于内脏团;Cu2+对青蛤的安全浓度并未超过国标中海水淡水养殖水质标准的规定; 高浓度 Cu2+能够诱导青蛤产生免疫抑制并导致其抗病能力下降, 加之其他污染物的影响可能是导致夏季青蛤大规模死亡的重要诱因。因此维护养殖环境, 减少重金属的排放, 是防止青蛤爆发性死亡的有效途径。
[1] 庄启谦.中国动物志, 软体动物门, 双壳纲, 帘蛤科[M].北京: 科学出版社, 236-241.
[2] 王兴强, 曹梅, 阎斌伦, 等.青蛤的生物学及其繁殖[J]. 水产科学, 2006, 25(6): 312-316.
[3] 张丽岩, 宋欣, 高玮玮, 等.Cd2+对青蛤的急性毒性及蓄积过程研究[J].海洋与湖沼, 2010, 3(5): 41-43.
[4] 于庆云, 王悠, 徐彦, 等.镉和铅对菲律宾蛤仔脂质过氧化及抗氧化酶活性的影响[J].生态毒理学报,2013, 8(4): 504-512.
[5] 陈琳琳, 张高生, 陈静, 等.汞、硒暴露对紫贻贝(Mytilus edulis)抗氧化酶系统的影响[J].生态毒理学报, 2011, 6(4): 383-388.
[6] 周凯, 么宗利, 来琦芳, 等.重金属Zn2+、Cd2+对青蛤幼虫的致毒效应[J].海洋渔业, 2007, 29(1): 63-67.
[7] 李华, 李磊.铜离子对栉孔扇贝幼贝几种免疫因子的影响[J].生命科学仪器, 2009, 7(8): 29-32.
[8] 周永欣, 章宗涉.水生生物毒性试验方法[M].北京:农业出版社, 1989: 109-191.
[9] 张宜奎, 宋秀凯, 刘爱英, 等.重金属Cd2+、Cu2+对文蛤的急性毒性 [J].海洋湖沼通报, 2011, 3: 51-56.
[10] 张传永, 刘庆, 陈燕妮.重金属对水生生物毒性作用研究进展[J].生命科学仪器, 2008, 6: 3-7.
[11] 国家质量监督检验检疫总局.农产品安全质量无公害水产品安全要求.GB/18406.4-2001.
[12] Cheng T. Bivalves: Invertebrate blood cells. New York:Invertebrate Blood, 1981: 233-300.
[13] Canesi L, Viarengo A, Leonzio C, et al. Heavy metals and glutathione metabolism in mussel tissues[J].Aquatic Toxicology, 1999, 46(1): 67-76.
[14] Luna-Acosta A, Kanan R, Le Floch S, et al. Enhanced immunological and detoxification responses in Pacific oysters,Crassostrea gigas, exposed to chemically dispersed oil[J]. Water Reseach, 2011, 45(14): 4130-4118.
[15] 丁鉴峰, 闫喜武. 赵立强. 等. 海洋污染物对菲律宾蛤仔的免疫毒性[J]. 生态学报, 2013, 33(17):5419-5425.
[16] Gagne F, Auclair J, Turcotte P, et al. Ecotoxicity of CdTe quantum dots to freshwater mussels: Impacts on immune system, oxidative stress and genotoxicity.Aquatic Toxicology, 2008, 86(3): 333-340.
