紫贻贝贝壳和脉红螺厣中色素的提取与鉴定
2015-12-02郝世鑫孙东方于文超王晓通
郝世鑫 , 侯 鑫, 孙东方 于文超 何 成 王晓通
(1. 鲁东大学 农学院, 山东 烟台 264025; 2. 山东海洋资源与环境研究院, 山东 烟台 264006; 3. 鲁东大学生命科学学院, 山东 烟台 264025)
紫贻贝(Mytilus edulis)隶属于软体动物门(Mollusca)、瓣鳃纲(Lamellibranchia)、异柱目(Anisomyaria)、贻贝科(Mytilidae)、贻贝属(Mytilus)。贻贝种类很多, 仅中国沿海就有 30多种, 其中经济价值较高的有10多种。脉红螺(Rapana venosa)属软体动物门(Mollusca)、腹足纲(Gastropoda)、新腹足目(Neogastropoda)、骨螺科(Muricidae)、红螺属(Rapana),自然分布于西北太平洋的日本海、渤海、黄海、东海等海域, 是重要的经济物种。
黑色素(Melanin)主要是由酪氨酸氧化反应, 随后通过聚合反应, 而产生的一种生物多聚体, 是生物色素中分布范围最广的色素之一[1], 一般呈黑色或棕褐色, 广泛存在于动植物中, 是一种难溶于水、酸及有机溶剂的生物大分子[2]。随着对天然黑色素的深入研究, 人们发现, 天然的黑色素存在巨大的潜在价值和药理, 在化妆品和功能性食品等领域有广泛应用[3]。目前人们对细菌、海绵(Spongiatia)[4]、真菌[5]、鲶鱼(Heteropneustes fossilis)[6]、乌鸡(Gallus gallus)[7]中的黑色素都有一定程度的研究与开发。本研究团队曾经发现长牡蛎外套膜、贝壳和闭壳肌痕处均存在黑色素, 但黑色素在贝类的其他器官或者其他贝类中是否存在, 目前尚不明确。
作者发现紫贻贝的贝壳和脉红螺的厣呈现黑色或黑红色, 但目前还没有实验证明其中的黑色物质是何种成分, 本实验计划提取这两处部位中的黑色物质并进行鉴定, 希望可以确定紫贻贝贝壳和脉红螺厣中是否含有黑色素。
1 材料与方法
1.1 试验样品
本实验选取山东省烟台市海滨的紫贻贝与脉红螺为实验材料, 购于鲁东大学农贸市场。紫贻贝贝壳与脉红螺厣的示意图如图1所示。
1.2 实验仪器与试剂
TU-1810紫外分光光度计、傅里叶红外光谱仪、电热恒温水浴锅、电热套、电子密度天平、冷凝管、烧杯、索氏提取器、抽滤器、研钵、布氏漏斗、玻璃棒等。所用实验试剂包括盐酸、氢氧化钠、溴化钾、乙醚、蒸馏水等。

图1 紫贻贝贝壳与脉红螺厣的示意图Fig.1 Shells of Mytilus edulis and operculum of Rapana venosa
1.3 两种实验样品中色素的提取
1.3.1 材料处理
分别将紫贻贝贝壳和脉红螺厣清理干净。
1.3.2 粉碎
在60 ℃烘箱中烘干一夜, 至完全去除水分, 用研钵将2份样品分别研磨成精细的粉末。
1.3.3 浸泡水解
1.3.3.1 贻贝贝壳
共称量贝壳粉末140 g平分两份各置于1 000 mL的烧杯中, 分别将280 mL的6 mol/L的盐酸缓慢倒入两烧瓶中, 边倒边用玻璃棒搅拌; 此步骤应格外注意, 倒入盐酸时要缓缓倒入, 否则会因反应过于剧烈而溢出烧杯; 置12 h以上使其充分反应。
1.3.3.2 脉红螺厣
共取厣粉末32.5 g置于1 000 mL的烧杯中, 将130 mL的6 mol/L的盐酸缓慢倒入烧瓶中; 进行此步骤时, 不会像使用盐酸浸泡贻贝贝壳一样反应剧烈, 其原因可能是两样品中成分有所差异造成的;置12h以上使其充分反应。
1.3.4 沸水浴
1.3.4.1 贻贝贝壳
经 12 h浸泡, 贝壳壳粉能被溶解大部分, 将浸泡过贝壳粉末的盐酸溶液弃去少许, 留残渣, 将带有残渣的剩余液体倒入1 000 mL 圆底烧瓶中, 再加6 mol/L 盐酸溶液 420 mL, 安装上冷凝管装置置于电热套上沸水浴加热1 h; 目的是进一步增加反应完全度, 这一步也可以使壳中可能存在的微量蛋白质彻底变性而沉淀, 以免对实验结果产生影响。经此步骤, 残渣基本完全溶解, 只留有微量的固体物质。
1.3.4.2 脉红螺厣
经 12 h以上的浸泡之后, 仍残留大量残渣, 将浸泡过厣粉末的盐酸溶液弃去上清留残渣, 将残渣倒入1 000 mL 圆底烧瓶中再加6 mol/L 盐酸溶液195 mL, 安装上冷凝管装置置于电热套上沸水浴加热 1 h, 使其进一步反应充分。在沸水浴结束时, 同贻贝贝壳一样, 只留有些许固体物质, 其余都已溶解。
1.3.5 抽滤
取下圆底烧瓶, 待冷却后, 将瓶内的液体用布氏漏斗抽滤, 弃去滤液, 保留滤渣。注意上述步骤中是将贻贝贝壳均分为 2份同时进行的, 所以在此步骤抽滤时也应两份同时抽滤。
1.3.6 脱脂
将滤渣用滤纸包好, 置于索氏提取器中, 用乙醚在42 ℃左右的水浴中脱脂, 待索氏管中乙醚呈现出澄清状态, 约为1 h左右, 脱脂结束, 再将滤纸包取出, 在抽滤装置上用蒸馏水反复洗涤多次。
1.3.7 干燥
最后在 80 ℃恒温干燥箱中烘干滤纸包, 取下滤纸上的黑色固体物质。
1.4 样品部位处色素的鉴定
1.4.1 紫外光谱鉴定
将紫贻贝贝壳和脉红螺厣中提取的黑色固体物质各取微量, 分别溶解在少量的 0.01 mol/L氢氧化钠水溶液中, 并用同样的氢氧化钠水溶液作为空白对照, 在 190~500 nm的范围内进行紫外光谱扫描,得到的数据使用Origin软件制作吸收曲线。
1.4.2 红外光谱鉴定
按照1∶100比例各取微量两种样品提取的黑色固体粉末与 KBr干粉混合, 研磨均匀后压片, 测定500~4 000 cm–1的红外光谱, 然后进行对比分析。
1.5 色素提取率的计算
色素提取率即提取得到的色素量占样品总量的百分比, 计算公式为

2 结果与分析
2.1 2份样品中的色素提取率
2.1.1 紫贻贝贝壳色素提取率
本次实验取贻贝贝壳共140 g, 经实验提取, 得到0.092 g的色素样品, 所以贻贝贝壳的色素提取率为0.066%。
2.1.2 脉红螺厣色素提取率
本次试验取脉红螺厣共 32.5 g , 经实验提取,得到0.011 g的色素样品, 所以脉红螺厣的色素提取率为0.034%。
2.2 紫贻贝贝壳中色素的光谱特征
2.2.1 紫贻贝贝壳中色素的紫外光谱特征
紫贻贝贝壳中色素的紫外光谱扫描结果如图 2所示。光谱扫描结果表明, 紫贻贝贝壳中的色素在紫外波长下存在明显吸收特征, 并有最大吸收峰, 其最大值在214 nm处(图2), 并且随着波长的增加, 其吸光值也下降, 与Bell[8]报道的黑色素紫外吸收特征一致。
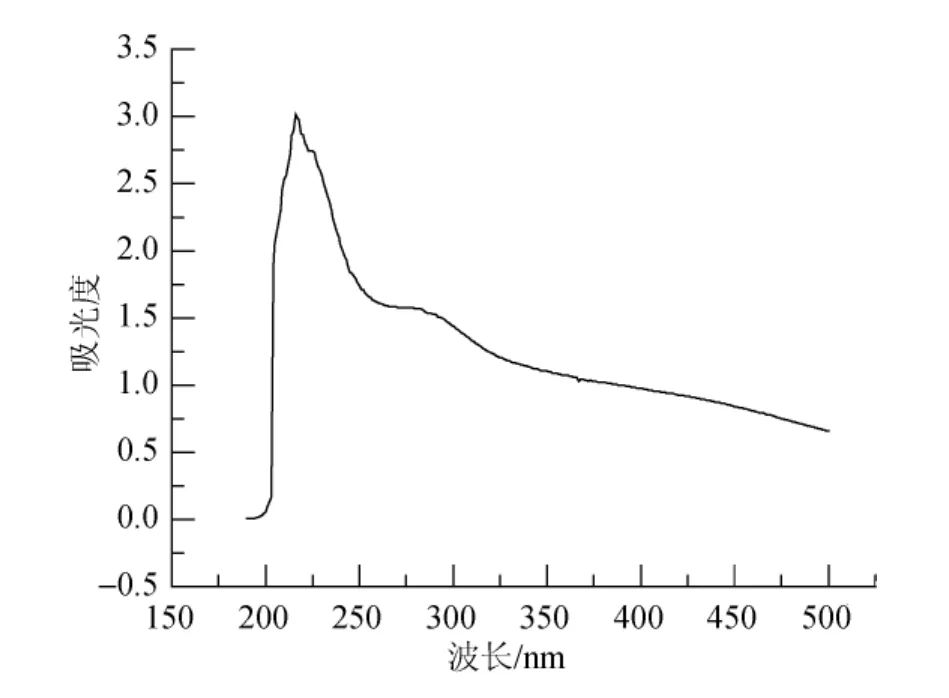
图2 紫贻贝贝壳中色素的紫外扫描图谱Fig.2 UV absorption spectra: pigment in the Mytilus edulis shells
2.2.2 紫贻贝贝壳中色素的红外光谱特征
紫贻贝贝壳中色素的红外光谱扫描结果如图 3所示。从图中可见, 本实验所提取的紫贻贝贝壳中色素的特征吸收峰主要集中在以下3组峰: 3 500~3 300 cm–1、1 620~1 600 cm–1和 1 150~1 000 cm–1,其中3440 cm–1处强吸收峰是由O—H和吲哚的N—H伸缩振动产生的, 1 630 cm–1附近吸收峰为真黑色素的吲哚环归属, 1 095 cm–1处的吸收峰, 部分由烷烃中C—CH3的弯曲和骨架振动吸收参与形成[9-10]。动物源黑色素多属吲哚型, 根据构成黑色素结构单元骨架是吲哚还是苯丙噻嗪, 又将动物黑色素分为真黑色素和脱黑色素两大类[11], 而根据图 3中的吸收峰特征, 可以判断紫贻贝贝壳中提取的色素为真黑色素。

图3 紫贻贝贝壳中色素的红外扫描图谱Fig.3 IR spectra: Pigment in the Mytilus edulis shells
2.3 脉红螺厣中色素的光谱特征
2.3.1 脉红螺厣中色素的紫外光谱特征
脉红螺厣中色素的紫外光谱扫描结果如图 4所示。光谱扫描结果表明, 脉红螺厣中色素在紫外波长下存在明显吸收特征, 并有最大吸收峰, 其最大值在216 nm处(图4), 并且随着波长的增加, 其吸光值也下降, 与紫贻贝贝壳中色素的紫外光谱相似, 也与Bell[8]报道的黑色素紫外吸收特征基本一致。
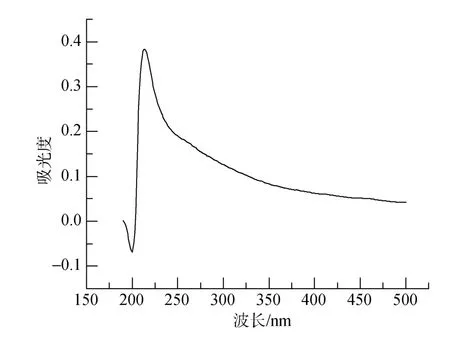
图4 脉红螺厣中色素的紫外扫描图谱Fig.4 UV absorption spectra: Pigment in the Rapana venosa operculum
2.3.2 脉红螺厣中色素的红外光谱特征
脉红螺厣中色素的红外光谱扫描结果如图 5所示。从图5可见, 本实验所制备的脉红螺厣中色素的特征吸收峰也主要集中在以下3组峰: 3 500~3 300 cm–1、1 620~1 600 cm–1和 1 150~1 000 cm–1, 我们知道, 3 440 cm–1处强吸收峰是由O—H和吲哚的N—H伸缩振动产生的, 1 630 cm–1附近吸收峰为真黑色素的吲哚环归属, 1 095 cm–1处的吸收峰, 部分由烷烃中 C—CH3的弯曲和骨架振动吸收参与形成[9-11],与紫贻贝贝壳中色素的红外吸收特征一致, 因此作者判定, 紫贻贝贝壳中的色素与脉红螺厣中的色素均为真黑色素。

图5 脉红螺厣中色素的红外扫描图谱Fig.5 IR spectra: Pigment in the Rapana venosa operculum
3 讨论与结论
实验结果表明, 紫贻贝贝壳与脉红螺厣中均含有黑色素, 说明黑色素在贝类中的具有较广泛的分布, 除了在长牡蛎外套膜、贝壳和闭壳肌痕处均存在黑色素之外(本课题组未发表的数据), 黑色素在其他贝类或贝类的其他器官中均存在。贝类含有黑色素对于贝类自身有何影响、有何生物学意义, 是一个值得研究的问题。
研究黑色素对于贝类育种也具有重要价值。迄今, 已有对贝类其他色素的提取和利用并取得了一定的研究成果, 如扇贝贝壳和闭壳肌中类胡萝卜素的提取和鉴定已有报道[12-13], 并育成了颜色明亮、营养价值较高的虾夷扇贝( Patinopecten yessoensis )和华贵栉孔扇贝(Chlamys nobilis )新品(种)系。黑色素也具有抗氧化、抗衰老的作用[14], 与胡萝卜素的生理作用相似, 本研究对贻贝贝壳中黑色素成功的进行了提取、鉴定, 证明了紫贻贝贝壳中也存在黑色素,对于紫贻贝的壳色育种具有重要的参考价值。另外,已有研究表明在长牡蛎壳中含有黑色素这一物质,而紫贻贝与牡蛎同为双壳纲(Bivalvia)贝类, 说明黑色素在双壳纲贝类中的存在可能是比较广泛的。
脉红螺的厣是一种比较特殊的矿化结构, 厣是腹足纲贝类着生于后足上面的板状结构, 软体部缩入贝壳内后藉此堵封壳口。本次实验提取并验证了厣中的黑色物质也为黑色素, 这是首次对腹足纲动物矿化结构所含色素进行提取和鉴定, 也说明黑色素在双壳纲和腹足纲贝类都是存在的。另外, 黑色素在头足纲动物中的存在早已得到确定[15], 结合本次实验的结果, 可以推测黑色素在软体动物中是广泛存在的一种色素。
[1] Kollosa N. New trends in photobiology, phytoprotection by melanins[J]. Phytochem Photobiol, 1991, 9(1):135-160.
[2] Bassam S E, Benhamou N, Carisse O, et al. The role of melan in in the an tagonistic interaction between the apple scab pathogen Venturia inaequalis and Microsphaeropsis ochracea[J]. Canadian Journal of Microbiolog, 2002, 48(4): 349-358.
[3] Zhang M, Xiao G, Thring R W, et al.Production and characterization of melanin by submerged culture of culinary and medicinal fungi Auricularia auricula[J].Appl Biochem Biotechnol, 2015, 176(1): 253-266.
[4] Araujo M, Xavier J R, Nunes C D, et al. Marine sponge melanin: a new source of an old biopolymer[J].Structural Chemistry, 2012, 23(1): 115-122.
[5] Langfelder K, Streibel M, Jahn B, et al.Biosynthesis of fungal melanins and their importance for human pathogenic fungi[J]. Fungal Genet Biol, 2003, 38(2):143-158.
[6] Kumar R, Joy K P. Melanins as biomarkers of ovarian follicular atresia in the catfish Heteropneustes fossilis:biochemical and histochemical characterization,seasonal variation and hormone effects[J].Fish Physiol Biochem, 2015, 41(3): 761-772.
[7] Chen S R, Jiang B, Zheng J X , et al. Isolation and characterization of natural melanin derived from silky fowl (Gallus gallus domesticus Brisson)[J]. Food Chemistry, 2008, 111(3): 745-749.
[8] Bell A A, Wheeler M H. Biosynthesis and functions of fungal melanins[J]. Ann Hev Phytopathol, 1986, 24:411-451.
[9] 王岩, 刘学惠, 尹佩玉, 等.几种天然黑色素分子结构的红外光谱表征研究[J].分析试验室, 1996, 15(6):63-65.
[10] 赵肃清, 孙明远, 蔡燕飞, 等.香蕉皮黑色素的鉴定及其抗氧化作用研究[J].中草药, 2002, 33(6):496-498.
[11] Nicolaurs R A, Piattellim, F E. The syructure of melanin and melanogenesis-IV: On some natural melanins[J]. Tetrahedron, 20(5): 1163-1172.
[12] Li N, Hu J J, Wang S, et al. Isolation and identification of the main carotenoid pigment from the rare orange muscle of the Yesso scallop[J]. Food Chemistry, 2010,118(3): 616-619.
[13] Zheng H P, Liu H L, Zhang T, et al. Total carotenoid differences in scallop tissues of Chlamys nobilis(Bivalve: Pectinidae) with regard to gender and shell colour[J]. Food Chemistry, 2010, 122(4): 1164-1167.
[14] Lu Y, Ye M, Song S, et al. Isolation, purification, and anti-aging activity of melanin from Lachnum singerianum[J]. Applied Biochemistry and Biotechnology,2014, 174(2): 762-771.
[15] Derby C D. Cephalopod ink: production, chemistry,functions and applications[J]. Marine Drugs, 2014,12(5): 2700-2730.
