不同环境因素影响下直链藻垂向分布特性研究
2015-12-02卢金锁
卢金锁, 杨 喆, 张 旭, 张 博
(西安建筑科技大学 环境与市政工程学院, 陕西 西安 710055)
近年来水库逐渐成为重要的供水水源[1], 水库富营养化和库区内原水质恶化现象较为常见[2-3]。研究表明[4-6]夏秋两季是水库内藻类高发季节, 富营养化水库受分层影响而营养盐含量失衡, 当某一环境因素改变时, 水库内的藻类短时间内大量繁殖并聚集在水体表层造成水华现象, 对库区水体水质及原水水质造成严重的危害[7-8]。
库区藻类分布受光照、降雨和水动力条件等多种环境因素影响[9], 目前关于诱发藻类形成水华主要从水体内营养盐含量[10]、光照影响[11-12]和水动力条件[13-14]等环境因素角度研究, 作者以北方地区的峡谷型深水库水源——金盆水库中夏秋两季优势藻种之一的直链藻为代表[15], 在实验室的自制沉降柱条件下模拟不同环境因素对水中直链藻时空分布的影响, 总结出对应直链藻的时空分布规律, 统计方差分析得出各环境因素对藻类分布的影响程度, 以对水库取水规避藻类应用借鉴。
1 材料和方法
1.1 藻种来源与培养条件
直链藻(Melosira)在分类学上属于硅藻门(Bacillariophyta), 链状群体, 藻细胞呈圆柱形。链长一般为 8~35 μm, 由一个个节状壳面连接, 一般为 3~15节, 常见于湖泊、水库等淡水系统中[16]。直链藻从中国淡水藻种库(FACHB-Collection)处购买。将其置于光照培养箱中, 利用CSI培养基进行培养, 箱内温度控制在(25±1)℃, 光强设置在(3000±100)lx 左右, 光照时间设置为L∶D=12 h∶12 h, 每天摇晃3次, 达到稳定期的周期在30 d左右[17-18]。
1.2 实验装置设定
本实验的主体实验装置为一个自制的圆柱形有机玻璃沉降柱, 如图1所示。柱高4 300 mm, 直径150 mm, 在侧外壁从上至下设置了17个直径为8 mm的取样口, 相隔取样口之间的距离为35 cm。取样管向柱内伸至10 mm处, 为了避免取到吸附在内壁上的直链藻造成取样误差; 沉降柱上方设置多级可调控灯箱可设置不同光照强度, 灯箱内设置喷头用于模拟降雨实验和设置风扇用于散热; 沉降柱底部设置阀门和流量计用于调节出流流量。将沉降柱内水体上部300 mm设为隔热区域, 下部4 000 mm为实验水体区域, 并用5 mm厚黑色保温膜包裹沉降柱表面覆盖整个实验水体区域, 起到遮光保温的作用。

图1 沉降柱装置示意图Fig.1 Settling column device schematic diagram
1.3 测定方法
沉降柱上方及柱内水体光强由光照计进行测量。实验前配制不同直链藻含量的水, 用多参数水质监测仪(HydrolabDS5)测定其叶绿素 a浓度, 并用丙酮萃取-紫外分光光度法进行校核[19], 并使用可见紫外分光光度计(HydrolabDR5000)测其在650 nm波长时的吸光值, 建立直链藻的叶绿素 a浓度与吸光值之间线性方程[20]即: y=1569x+0.596(R²=0.999), 以便实验中只需取少量水样检测其吸光值, 计算对应的叶绿素a。
1.4 实验方法
沉降柱内水将金盆水库原水经过孔径为 0.45 μm微孔纤维滤膜过滤, 为避免滤膜中的有机物质对实验结果产生影响, 使用前对滤膜进行煮沸处理; 为使沉降柱内的原水充分均匀混合并使其杂质沉淀,在实验开始前12 h便将其注入进沉降柱内, 注水量约为 70.7 L; 为了能够同时模拟直链藻上浮和下沉特性, 将已培养至稳定期的直链藻液利用注射器从7号取样口缓慢注入沉降柱内, 将沉降柱以 7号取样口为界分为上浮区和下沉区(图 1), 分别通过改变沉降柱上部灯数量、下部出流水量和上部喷头出流量,形成 5组不同的光照、取水出流引起的水动力和降雨条件下, 研究直链藻悬浮特性。
2 结果与分析
2.1 不同光照条件对直链藻垂向分布影响
直链藻液从沉降柱中部 7号取样口被注入进沉降柱后, 调整灯箱开启灯数量, 使其在沉降柱水面处光强分别为0、1 000、3 000、7 000、10 000 lx, 间隔0.5~4 h在上浮区2号和下沉区15号取样口进行取样,实验设计时间周期为2 d。在不同光照条件下上浮区直链藻随时间的分布如图2a所示, 在不同光照条件下下沉区直链藻随时间的分布如图2b所示。
由图2a可知, 在高浓度藻液加入后, 0.5 h之内直链藻迅速向表层扩散, 使表层水体中藻类浓度提高, 说明直链藻在光的诱导下明显上浮, 呈现一定趋光性, 这与 Lashaway[21]研究结论一致。但在不同光强呈现不同上浮特性, 在光强为1 000 lx时, 表层达到最大需要0.5 h, 而在光强为10 000 lx时表层达到最大需要 2.5 h, 说明在较强光强时由于光可到达较深, 直链藻无需上浮至表层, 上浮速度较慢。在上浮区直链藻分布稳定时, 光强在3 000 lx时表层直链藻浓度最大, 其次为 7 000 lx, 最小为无光强, 说明直链藻适合在3 000 lx左右生长, Wang[22]研究表明直链藻适合在低光强环境下生长, 其最适光强为2 800 lx左右。
由图 2b可知, 实验开始后下沉区内直链藻的浓度变化缓慢且在24 h之后达到平衡, 其中在最大光强10 000 lx达到平衡时, 底部直链藻的浓度最低,表明在顶部高光强下, 沉降柱内整体光强较高, 直链藻在深度上分布广泛, 在顶部低光强下, 直链藻难以在沉降柱内生长, 而沉降至底部。这一点也可在表1中得出。由表1可知, 在0~3 000 lx光强时上浮区和下沉区内各个取样点的浓度值大致相同,在7 000和10 000 lx光强时上浮区内位于沉降柱中部的6号取样点的浓度值分别为53、60 μg/L要高于其余的取样点浓度值, 而光强为10 000 lx时下沉区内同样位于沉降柱中部的 8、9号取样点浓度值分别为63、66以及66、70 μg/L要高于其余的取样点浓度值。

图2 不同光照条件下直链藻的垂向分布分析图Fig.2 Vertical distribution diagram of Melosira under different light conditions

表1 不同光照直链藻浓度在稳定时间时垂向分布情况(单位: μg/L)Tab.1 Vertical distribution of different light Melosira concentrations at stable time (unit: μg/L)
2.2 不同水动力条件对直链藻垂向分布影响
直链藻液从沉降柱中部 7号取样口被注入进沉降柱后, 改变沉降柱底部出流流量分别为8、15、23、30和36 mL/min, 每次实验间隔5~8 h在上浮区2号和5号以及下沉区9号和15号取样口进行取样, 4个取样点的藻液浓度值随时间分布如图3a~e所示。
由图3a~e可知, 在实验过程中4个取样点的藻浓度差值由开始时的相差较大到结束时的相差不大,越接近结束时间时 4个取样点间的藻浓度分布趋势基本不变且测得的各自取样点藻浓度基本不变。对比图2与图3, 以上浮区的2号取样点和下沉区的15号取样点为例, 光强设置为3 000 lx。由图2可知, 当沉降柱底部没有出流时, 实验进行2 d后沉降柱内直链藻浓度趋于稳定且光强为3 000 lx时, 15号取样点的藻浓度为78 μg/L; 由图3可知, 受到实验开始时投加直链藻液浓度不同的影响, 实验结束时15号取样点的藻浓度范围为 55~70 μg/L, 当改变沉降柱底部出流流量时, 实验平衡时间大大缩短, 出流流量最小即8 mL/min时实验平衡时间为8 h, 而出流流量最大即36 mL/min时实验平衡时间为5 h, 说明随着出流流量的逐渐增大促使对应水域内直链藻被动迁移加快, 能够在越短的时间内聚集, 这与 Wang[23]的研究结论一致。同时对比图2和图3可以发现, 无论沉降柱底部出流流量是否发生改变, 在相同实验环境以及实验时间内 2号取样点的藻浓度变化趋势基本一致, 说明沉降柱底部出流流量的改变对下沉区内直链藻垂向分布的影响要大于对上浮区内的, 由此可以推断出随着水深的增加, 越靠近出流流量改变的水层其对应的直链藻垂向分布越受其影响。
2.3 不同降雨条件对直链藻垂向分布影响
直链藻液从沉降柱中部 7号取样口被注入进沉降柱后, 1 h后进行降雨实验模拟时, 模拟降雨强度分别为1.67、5、8.33、11.67和15 mm/min, 降雨持续45 min, 降雨期间取样间隔15 min, 第二次模拟降雨在第一次结束4.5 h后进行, 间隔7 h在上浮区2号和5号以及下沉区9号和15号取样口进行取样, 4个取样点的藻液浓度值在不同降雨条件下随时间的分布如图4a~d所示。
由图4a可知, 实验开始后1 h之内没有开始降雨, 上浮区内直链藻受到光照影响迅速上浮, 之后降雨开始上浮区内直链藻向下层迁移, 降雨 45 min后的降雨间隔期内, 上浮区内直链藻受到光照影响再次向表层迁移, 二次降雨开始后, 上浮区内直链藻再次向下层迁移。测得 2号取样点的藻浓度在降雨期间, 降雨强度最小即1.67 mm/min时藻浓度下降幅度为23%, 而降雨强度最大即15 mm/min时藻浓度下降幅度为 49%, 说明随着降雨强度增大, 降雨开始后表层直链藻的下降幅度也增大。由图4b可知,实验开始未发生降雨时, 上浮区内直链藻受到光照影响迅速上浮, 而发生降雨时, 表层直链藻向下层迁移,测得5号取样点的藻浓度在降雨期间, 降雨强度最小即1.67 mm/min时藻浓度下降幅度为3.5%, 而降雨强度最大即15 mm/min时藻浓度上升幅度为11.8%。
结合图4a和4b可知, 随着降雨强度增大越靠近表层水体的直链藻对应的垂向分布越受其影响且降雨强度越大趋势越明显, 同时受降雨影响的水深也随降雨强度的增大而增大。相对于预防水华现象发生来说, 降雨对水中直链藻的垂向分布产生的影响是正面的影响, 是否可以采用人工降雨的方式来阻止或推迟水华现象的发生, 关于这一观点是否可行目前国内外学者没有做过相关研究得出过类似结论, 还需要对其进行进一步的实验研究来验证此观点的正确性。
由图4c和4d可知, 在5组不同降雨模拟的整个实验过程中, 9号和15号取样点的藻浓度变化没有明显波动, 仅受自重影响而递减和递增, 说明降雨对水中直链藻垂向分布的影响是存在范围的, 随着水深的增加降雨对沉降柱内直链藻的垂向分布影响减弱。
2.4 直链藻垂向分布与环境因素定量分析
利用单因素方差分析方法对上浮区以及下沉区内的直链藻在光照、水动力以及降雨这3个环境因素影响下测得的叶绿素a浓度值进行分析并运用SPSS19.0软件进行统计, 从中得出光照、水动力以及降雨这3个环境因素哪一个对上浮区内的直链藻垂向分布影响最大,哪一个因素对下沉区内的直链藻垂向分布影响最大。

图4 不同降雨条件下直链藻的垂向分布Fig.4 Vertical distribution diagram of Melosira with different amount of rainfall
表2、表3分别表示的是3个环境因素对上浮区以及下沉区内直链藻垂向分布的影响程度, 其中组别1表示的是光照条件、组别2表示的是底部出流流量条件、组别 3表示的是降雨条件。从表中显著性影响一行中的数据可知, 光照以及降雨条件对上浮区内直链藻的垂向分布具有显著影响, 而底部出流流量条件则对下沉区内直链藻的垂向分布具有显著影响。其中, 光照条件的改变促进上浮区内的直链藻垂向向水体表层迁移, 而降雨条件的改变则抑制上浮区内的直链藻垂向向水体表层迁移。
3 结论
直链藻具有较强的趋光性且适合在低光强环境下生长, 实验模拟确定直链藻的最适光强为3 000 lx,光强的改变对沉降柱内直链藻的垂向分布具有显著影响, 随着水深的增加, 光强对水中直链藻垂向分布影响减弱。
沉降柱底部出流流量的改变对下层水体内直链藻的垂向分布具有显著影响, 且随着出流流量的增大, 对应的直链藻垂向分布变化波动越明显, 同时越靠近底部出流流量改变的水层, 其对应的直链藻垂向分布越受其影响, 能够在越短的时间内聚集,当出流流量最小即8 mL/min时对应的实验稳定时间为8 h, 而当出流流量达到最大即36 mL/min时对应的实验稳定时间为5 h。
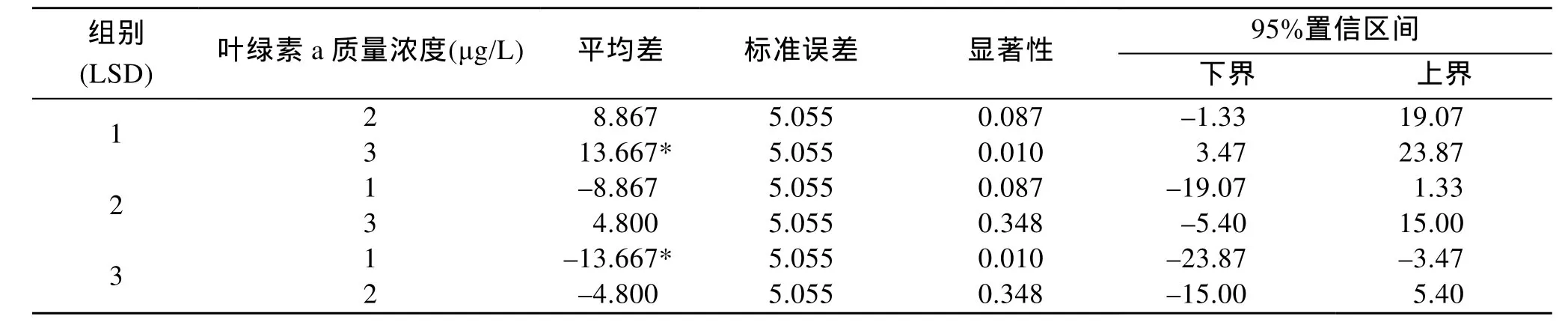
表2 单因素方差分析3种环境因素对上浮区内直链藻垂向分布的影响Tab.2 Effect of three kinds of environmental factors on the vertical distribution of Melosira in the floating zone analyzed by one-way ANOVA

表3 单因素方差分析3种环境因素对下沉区内直链藻垂向分布的影响Tab.3 Effect of three kinds of environmental factors on the vertical distribution of Melosira in the sinking zone analyzed by one-way ANOVA
降雨强度的改变对表层水体内直链藻的垂向分布具有显著影响, 对于聚集在表层的直链藻来说,降雨对其产生抑制作用, 降雨强度越大, 表层水体内直链藻就越偏离水体表层, 同时随着水深的增加,降雨对直链藻的垂向分布影响减弱。
[1] Wang C, Sun Q, Wang P, et al. An optimization approach to runoff regulation for potential estuarine eutrophication control: Model development and a case study of Yangtze Estuary, China[J]. Ecological Modelling, 2013, 251: 199-210.
[2] Liu Y, Wang Y, Sheng H, et al. Quantitative evaluation of lake eutrophication responses under alternative water diversion scenarios: A water quality modeling based statistical analysis approach[J]. Science of the Total Environment, 2014, 468: 219-227.
[3] O’Neil J M, Davis T W, Burford M A, et al. The rise of harmful cyanobacteria blooms: The potential roles of eutrophication and climate change[J]. Harmful Algae,2012, 14: 313-334.
[4] Kolada A. The effect of lake morphology on aquatic vegetation development and changes under the influence of eutrophication[J]. Ecological Indicators,2014, 38: 282-293.
[5] Béchet Q, Shilton A, Guieysse B. Modeling the effects of light and temperature on algae growth: State of the art and critical assessment for productivity prediction during outdoor cultivation[J]. Biotechnology Advances,2013, 31(8): 1648-1663.
[6] 孔繁翔, 高光. 大型浅水富营养化湖泊中蓝藻水华形成机理的思考[J]. 生态学报, 2005, 25(3): 589-595.
[7] Yu H, Zhao M, Agarwal R P. Stability and dynamics analysis of time delayed eutrophication ecological model based upon the Zeya reservoir[J]. Mathematics and Computers in Simulation, 2014, 97: 53-67.
[8] Chen X, He S, Huang Y, et al. Laboratory investigation of reducing two algae from eutrophic water treated with light-shading plus aeration[J]. Chemosphere, 2009,76(9): 1303-1307.
[9] 杨正健, 刘德富, 易仲强, 等.三峡水库香溪河库湾拟多甲藻的昼夜垂直迁移特性[J].环境科学研究,2010, 23(1): 26-32.
[10] 龙天渝, 郑敏, 郭蔚华, 等.生态幅在重庆嘉陵江主城段营养盐限制因子中的应用[J].重庆大学学报(自然科学版), 2007, 30(2): 81-85.
[11] Li W, Guo Y, Fu K. Enclosure experiment for influence on algae growth by shading light[J]. Procedia Environmental Sciences, 2011, 10: 1823-1828.
[12] 刘春光, 金相灿, 邱金泉, 等. 光照与磷的交互作用对两种淡水藻类生长的影响[J].中国环境科学, 2005,25(1): 32-36.
[13] 颜润润, 逄勇, 赵伟, 等.环流型水域水动力对藻类生长的影响[J].中国环境科学, 2008, 28(9): 813-817.
[14] 丁玲, 逄勇, 李凌, 等.水动力条件下藻类动态模拟[J]. 生态学报, 2005, 25(8): 1863-1868.
[15] 邱二生. 黑河水库水质及藻类监测和水体分层研究[D].西安: 西安建筑科技大学, 2010.
[16] 胡鸿钧, 魏印心.中国淡水藻类——系统、分类及生态[M].北京: 科学出版社, 2006.
[17] 王珺, 王爱雯, 陈国华, 等.几种主要营养元素对直链藻生长速率的影响[J]. 海南大学学报(自然科学版),2013, 31(3): 218-223.
[18] 赵玉明. 底栖硅藻生产性培养中的理论与实践[J].中国农学通报, 2010, 26(15): 402-406.
[19] 陈宇炜, 陈开宁, 胡耀辉.浮游植物叶绿素 a测定的“热乙醇法”及其测定误差的探讨[J]. 湖泊科学, 2006,18(5): 550-552.
[20] 于海燕, 周斌, 胡尊英, 等.生物监测中叶绿素a浓度与藻类密度的关联性研究[J].中国环境监测, 2009,25(6): 40-43.
[21] Lashaway A R, Carrick H J. Effects of light,temperature and habitat quality on meroplanktonic diatom rejuvenation in Lake Erie: implications for seasonal hypoxia[J]. Journal of Plankton Research,2010, 32(4): 479-490.
[22] Wang J, Xing Y, Chen G, et al. Effects of different ecological factors on the growth of Melosira sp.[J].Journal of Tropical Organisms, 2010, 3: 008.
[23] Wang P, Shen H, Xie P. Can hydrodynamics change phosphorus strategies of diatoms?—nutrient levels and diatom blooms in lotic and lentic ecosystems[J].Microbial Ecology, 2012, 63(2): 369-382.
