星突江鲽胰岛素样生长因子I的体外重组表达及生物活性分析
2015-12-02徐永江柳学周陈圣毅
徐永江,臧 坤,2,柳学周,史 宝,陈圣毅,2
(1.农业部海洋渔业可持续发展重点实验室,中国水产科学研究院黄海水产研究所,山东青岛266071;2.上海海洋大学水产与生命学院,上海201306)
星突江鲽胰岛素样生长因子I的体外重组表达及生物活性分析
徐永江1,臧 坤1,2,柳学周1,史 宝1,陈圣毅1,2
(1.农业部海洋渔业可持续发展重点实验室,中国水产科学研究院黄海水产研究所,山东青岛266071;2.上海海洋大学水产与生命学院,上海201306)
为了在蛋白水平认识星突江鲽(Platichthys stellatus)胰岛素样生长因子I(IGF-I)的生长调控作用及机制,采用RT-PCR方法扩增了其成熟肽片段,利用原核表达载体pET-28a成功构建了重组星突江鲽IGFI/pET-28a质粒,转化至大肠杆菌BL21(DE3)后经IPTG诱导获得了N端含6个组氨酸的重组星突江鲽IGFI蛋白。获得的重组IGF-I蛋白大小为12.1 kD,37℃下用0.5 mmol/L的异丙基-β-D-硫代半乳糖苷(IPTG)诱导3 h时目的蛋白表达量最高,占菌体总蛋白的39.8%,主要以包涵体形式存在。Western blotting免疫印迹表明星突江鲽IGF-I重组蛋白均可被6×His抗体特异性识别。包涵体经6 mol/L盐酸胍变性、Ni2+离子亲和柱纯化和尿素梯度复性后,可获得高纯度的IGF-I重组蛋白。细胞增殖试验结果显示0.6 μg/mL的星突江鲽IGF-I重组蛋白能显著促进人胚胎肾细胞HEK293T的增殖而大于1.8 μg/mL时则表现出抑制作用。本研究成功构建了星突江鲽IGF-I体外高效表达系统,并获得具有细胞水平生物活性的星突江鲽IGF-I重组蛋白,结果可为深入探究IGF-I在星突江鲽生长发育中的作用机制及研制高效绿色的促生长制剂提供基础资料。
星突江鲽;胰岛素样生长因子I;原核表达;生物活性
1 前言
鱼类生长激素-胰岛素样生长因子(GH-IGFs)轴在生长调控中起着非常重要的生理作用。IGF-I是重要的GH下游调控因子,注射GH可显著提高鱼类肝脏中IGF-ImRNA表达量和血浆IGF-I浓度[1,2]。血浆IGF-I浓度与鱼类生长速度表现出较高相关性,Picha等[3]已将其作为指示鱼类生长的指标之一。此外,IGF-I在鱼类生殖[4]、早期发育[5,6]、免疫应答[7]和渗透压调节[8]等方面均发挥重要作用。目前,研究人员在大肠杆菌中成功实现了鲈鱼[9]、罗非鱼(Oreochromis Niloticus)[10]、草鱼[11]、虹鳟(Oncorhynchus mykiss)[12]和大菱鲆(Scophthalmus maximus)[13]等 IGF-I的体外重组表达,并通过细胞增殖诱导试验证明了所获得IGF-I重组蛋白的生物活性。近期Li等[14]首次在毕赤酵母中实现了斜带石斑鱼IGF-I的重组蛋白表达,为鱼类IGF-I进一步在养殖中的开发应用奠定了基础。
星突江鲽(Platichthys stellatus)属鲽形目(Pleuronectiformes)、鲽科(Pleuronectidae)、江鲽属(Platichthys),分布于我国、日本、俄罗斯、加拿大及美国太平洋沿岸,是一种具有较高经济价值的鲆鲽类鱼种,具有营养丰富、经济价值高、广温广盐、耐受性强等特点,在东亚地区深受消费者喜爱[15]。近年来,我国突破了星突江鲽的人工繁育技术[16],养殖产业正在逐步兴起。本研究利用原核表达载体构建了星突江鲽IGF-I成熟肽重组质粒,实现了IGF-I重组蛋白的体外高效表达,并分析了重组psIGF-I蛋白生物活性,以期为深入解析IGF-I在星突江鲽生长发育中的调控作用机制和绿色高效促生长制剂的开发提供基础资料。
2 试验部分
2.1 试验用鱼
星突江鲽雌鱼3尾(体长32~35 cm、体重1 014~1 025 g)取自日照市海洋水产资源增殖站,以MS-222(280 mg/L)麻醉处死,迅速取其垂体和肝脏组织于液氮中(-196℃)速冻后转入-80℃保存,用于总RNA提取。
2.2 RNA提取和cDNA第一链的合成
利用RNAiso Plus(TaKaRa)提取星突江鲽垂体和肝脏总RNA,通过1%琼脂糖凝胶电泳检测质量,使用微量核酸测定仪(Nanodrop ND2000)检测浓度。利用PrimeScript 1st Strand cDNA Synthesis试剂盒(TaKaRa)反转录合成cDNA第一链。
2.3 IGF-I/pET-28a重组质粒的构建
根据星突江鲽IGF-I的cDNA序列(GenBank序列号KC709503),参照pET-28a载体(Invitrogen)上的多克隆位点排列特点,选取BamH I和Hind III作为酶切位点,设计特异性引物GAAATGGCCTCGGCGGAG-3′和 IGF-IR:5′-TAATTCGGACTTGGCGGGTTTG-3′扩增IGF-I成熟肽片段。在上游引物IGF-IF的5′端分别加入了酶切位点BamH I(方框标注),在下游引物IGF-IR的5′端中加入酶切位点Hind III(方框标注)和强终止密码子TAA(单下划线标注)。IGF-I成熟肽的PCR扩增使用肝脏cDNA为模板,PCR条件:94℃变性5 min;94℃30 s、61℃30 s、72℃50 s;34个循环;最后72℃延伸10 min。将扩增得到的成熟肽片段连接到pEASY-T1 Simple载体(TransGen)上,挑选阳性克隆送往上海生工公司测序验证。
利用质粒小提试剂盒(TaKaRa)提取IGF-I/ pEASY-T1质粒,用限制性内切酶BamH I和Hind III(TaKaRa)将IGF-I/pEASY-T1质粒和表达载体pET-28a双酶切,使用T4连接酶(TaKaRa)将双酶切后的目的片段连接到pET-28a上,得到重组质粒IGF-I/ pET-28a,转化至大肠杆菌DH5α(Invitrogen)中,菌液PCR验证后并测序。
2.4 重组IGF-I/pET-28a质粒在大肠杆菌中诱导表达
将测序正确的重组质粒转化到表达菌株BL21(Invitrogen),挑取阳性单克隆接种于含Kana(100 μg/mL)的5 mL LB培养基中,37℃振荡培养过夜。次日按1∶100扩大培养至OD600值为0.6~0.7,加入IPTG(1 mmol/L)继续培养,分别在诱导0 h、1 h、2 h、3 h、4 h、6 h和8 h时各取1 mL菌液,8 000 r/min 10 min离心收集菌体,PBS洗涤并重悬菌体,SDS-PAGE(15%分离胶)电泳检测,Sigma Scan Pro 5软件分析蛋白表达率。
菌液分别在21℃、29℃、37℃、45℃条件下IPTG(1 mmol/L)诱导6 h取样进行SDS-PAGE电泳分析,研究不同温度下蛋白表达的差异。
菌液在37℃条件下培养至OD600值为0.6~0.7时,加入IPTG使其终浓度分别为0.1 mmol/L、0.2 mmol/L、0.5 mmol/L、1.0 mmol/L、2.0 mmol/L、5.0 mmol/L诱导6h取样进行SDS-PAGE电泳分析,研究不同IPTG浓度对重组载体蛋白表达的诱导作用。
2.5 重组IGF-I蛋白western-blotting验证
分别收集诱导6h的重组GH和重组IGF-I菌体沉淀经SDS-PAGE电泳后,利用半干电转印法将蛋白转移至PVDF膜上并用5%BSA封闭,以鼠抗6×HisMonoclonal Antibody(TransGen)为一抗、HRP标记的山羊抗小鼠IgG(TransGen)为二抗,4℃下分别孵育过夜,使用HRP-DAB显色试剂(Solarbio)进行显色。
2.6 重组IGF-I蛋白纯化和复性
GH重组菌37℃条件下IPTG(1 mmol/L)诱导6 h,IGF-I重组菌37℃条件下IPTG(0.5 mmol/L)诱导3 h后,8 000 r/min 4℃离心10 min,PBS洗涤沉淀,用1/10体积的超声波破碎液(50 mmol/LTris-HCl pH 8.0、0.5 mol/L NaCl、1 mmol/L EDTA)重悬菌体,重悬后的菌液于冰浴中进行超声破碎,SDSPAGE检测沉淀和上清。破碎后的沉淀用包涵体洗涤液(50 mmol/L Tris-HCl pH8.0、0.5 mol/L NaCl、2 mol/L Urea、1%Triton X-100)洗涤2~3次,洗涤后的包涵体溶于裂解液(6 mol/L guanidine HCl pH6.5、0.4 mol/L NaH2PO4、0.4 mol/L Na2HPO4、0.5 mol/L NaCl)4℃搅动过夜变性,12 000 r/min离心10 min取上清,用0.8 μm和0.45 μm微孔滤膜过滤,Ni2+-NTA亲和层析柱(TaKaRa)分离纯化融合蛋白。
分离后的融合蛋白SDS-PAGE电泳检测后装入到透析袋中,分别用8 mol/L尿素梯度复性液(50 mmol/L Tris-HCl pH6.5、0.2 mol/L NaH2PO4、0.2 mol/L Na2HPO4、0.05 mol/L NaCl、8 mol/L Urea、1%Glycine、10%Glycerol、1 mmol/LEDTA)、6 mol/L尿素梯度复性液(50 mmol/L Tris-HCl pH6.5、0.2 mol/L Na2HPO4、0.2 mol/L NaH2PO4、0.05 mol/L NaCl、6 mol/L Urea、10%Glycerol、1 mmol/L EDTA)、6 mol/L尿素梯度复性液(50 mmol/L Tris-HClpH 6.5、0.2 mol/L Na2HPO4、0.2 mol/L NaH2PO4、0.05 mol/L NaCl、4 mol/L Urea、10% Glycerol、1 mmol/L EDTA)、2 mol/L尿素梯度复性液(50 mmol/L Tris-HCl pH6.5、0.2 mol/L Na2HPO4、0.2 mol/L NaH2PO4、0.05 mol/L NaCl、2 mol/L Urea、1 mmol/L EDTA)和PBS充分透析复性,用3 kD超滤管(millipore)进行超滤浓缩,SDS-PAGE电泳检测,-80℃超低温冰箱保存。
2.7 重组GH和IGF-I蛋白生物活性检测
利用BCA蛋白定量试剂盒(Thermo)检测纯化复性后的重组蛋白浓度,0.22 μm过滤除菌,用于检测重组GH和IGF-I蛋白在终浓度分别为0.2 μg/mL、0.6 μg/mL、1.8 μg/mL、5.4 μg/mL、16.2 μg/mL、48.6 μg/mL时对人胚胎肾细胞HEK293T的增殖作用。将生长状态良好的人胚胎肾细胞HEK293T以1×105/mL密度接种于96孔板(每孔200 μL),培养24 h后,弃掉培养基,加入含不同浓度重组蛋白的新鲜培养基,并设空白对照组,每组设4个平行。继续培养48 h后,弃上清,每孔加入90 μL新鲜培养液,再加入10 μL MTT(Sigma)溶液,继续培养4 h,弃上清,每孔加入100 μL二甲基亚砜(DMSO)摇床低速震荡10 min,酶标检测仪检测570 nm处的吸光度。
细胞增殖率(GSR)计算方法为:GSR(control)=Asample/Acontrol×100%,Asample为加入重组蛋白组,Acontrol为未加重组蛋白组。GSR数据用平均值±标准差(means±S.D.)来表示,采用SPSS 16.0软件进行单因素方差分析,当P<0.05时视为差异显著,当P<0.01时视为差异极显著。
3 结果与分析
3.1 IGF-I/pET-28a重组质粒的构建
将正确克隆的IGF-I成熟肽序列插入到原核表达质粒pET-28a上,得到重组质粒IGF-I/pET-28a,转化到大肠杆菌BL21中,菌液PCR得到与预期大小相符的特异条带(见图1)。
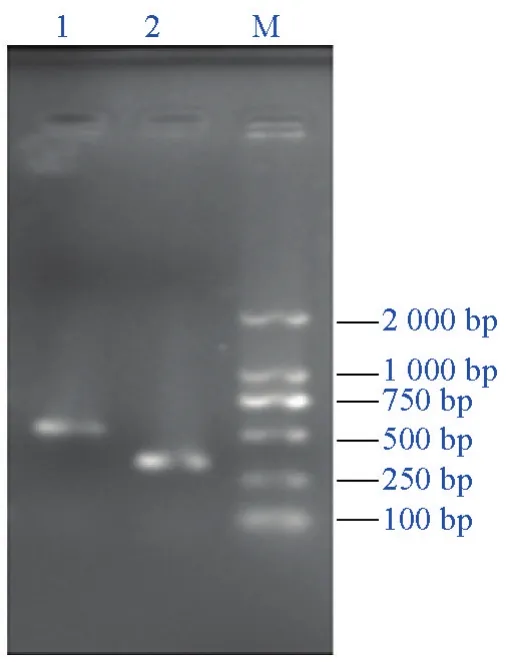
图1 IGF-I重组表达菌BL21的菌液PCR鉴定Fig.1 PCR verification of IGF-I recombinant plasmidin.E.coli BL21 cells
测序结果显示重组质粒GH/pET-28a和IGF-I/ pET-28a构建成功。IGF-I/pET-28a重组质粒(见图2)在大肠杆菌中将表达包含103个氨基酸的重组蛋白,分子量为12.1 kD,等电点为8.527。重组蛋白N端均含有6×His标签,可进行鉴定和蛋白纯化。

图2 星突江鲽IGF-I重组成熟肽序列Fig.2 The matured peptide sequence of IGF-I of Platichthys stellatus
3.2 重组质粒在大肠杆菌BL21(DE3)中的表达
将重组质粒IGF-I/pET-28a转化入大肠杆菌BL21(DE3)进行诱导表达,SDS-PAGE电泳显示,经IPTG诱导的IGF-I重组菌在10 kD和15 kD之间出现特异性条带,IGF-I重组蛋白大小为12.1 kD。SigmaScan pro 5软件分析显示,不同诱导条件下的重组菌蛋白表达量各不同,通过对诱导时间、诱导温度和IPTG诱导浓度条件的优化,得到重组IGF-I表达的最优条件为37℃、IPTG(0.5 mmol/L)诱导培养3 h,重组蛋白表达量占细菌总蛋白的39.8%(见图3~图5)。

图3 诱导时间对星突江鲽重组IGF-I蛋白表达的影响Fig.3 Effects of induction time on production of Platichthys stellatus recombinant IGF-I protein
3.3 IGF-I重组蛋白的western-blotting验证
采用western-blotting免疫印迹方法对37℃下0.5 mmol/L的IPTG诱导3 h的IGF-I重组菌分别进行检测,结果显示IGF-I重组菌则在PVDF膜上出现12.1 kD的单一印迹(见图6),说明重组菌表达的目的蛋白能被6×His抗体特异性识别,具有抗原活性,表明星突江鲽IGF-I重组蛋白分别表达成功。
3.4 IGF-I/pET-28a重组蛋白的纯化
取37℃下0.5 mmol/L的IPTG诱导3 h的重组IGF-I表达菌,超声波破碎后的菌液沉淀和上清,0.45 μm滤膜过滤后的蛋白液以及Ni2+-NTA亲和层析柱分离出的蛋白液进行SDS-PAGE电泳检测,结果显示重组菌所表达的蛋白主要以包涵体的形式存在于沉淀中,通过Ni2+-NTA亲和层析柱可对重组蛋白进行有效的分离纯化,纯化的IGF-I重组蛋白相对分子质量约为12.1 kD(见图7),与预期大小相符合。
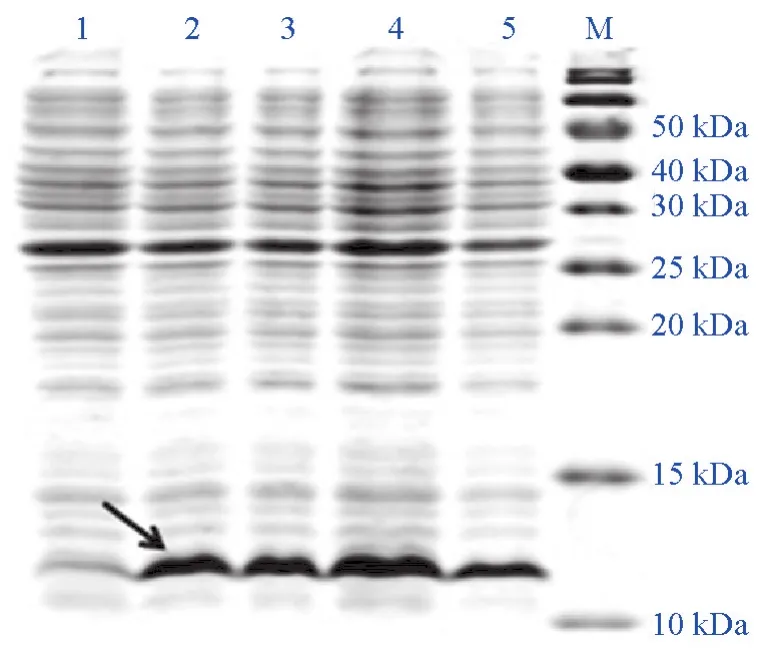
图4 温度对星突江鲽重组IGF-I蛋白表达的影响Fig.4 Effects of temperature on production of Platichthys stellatus recombinant IGF-I protein

图5 IPGT浓度对星突江鲽重组IGF-I蛋白表达的影响Fig.5 Effects of IPTG concentrations on production of Platichthys stellatus recombinant IGF-I protein
3.5 重组蛋白的生物活性检测
利用MTT法检测不同浓度的重组星突江鲽IGF-I蛋白对人胚胎肾细胞HEK293T增殖的影响。重组星突江鲽IGF-I蛋白在0.6 μg/mL时能显著促进人胚胎肾细胞HEK293T增殖(P<0.05),但浓度大于1.8 μg/mL时细胞的增殖速度却显著减慢(P<0.05),浓度为16.8 μg/mL时这种抑制效应更为明显(P<0.01,见图8)。

图6 星突江鲽重组IGF-I蛋白的western-blotting检测Fig.6 Western-blotting analysis of Platichthys stellatus recombinant IGF-I protein

图7 星突江鲽重组IGF-I蛋白的纯化Fig.7 Purification of Platichthys stellatus recombinant IGF-I protein

图8 重组星突江鲽IGF-I蛋白对人胚胎肾细胞HEK293T增殖速率的影响Fig.8 Effects of recombinant IGF-I protein fromPlatichthys stellatus on the proliferation of human embryo kidney cell HEK293T
4 讨论
本研究利用体外重组技术实现了星突江鲽IGF-I成熟肽在大肠杆菌中的表达,并纯化获得了具有细胞水平生物活性的IGF-I重组蛋白。由于IGF-I成熟肽在硬骨鱼类中高度保守[1],使得本研究结果不仅可以为星突江鲽IGF-I生长调控机制研究提供基础资料,也可为其他鱼类的IGF-I生理功能及调控机制研究提供借鉴。
本研究选用带有His标签的pET-28a载体作为星突江鲽IGF-I的重组表达载体,对于重组蛋白的Ni2+-NTA亲和层析和western-blotting验证具有重要作用,并且已有报道证实重组蛋白添加的组氨酸末端不会对目标蛋白生物活性产生影响[17,18]。此外,PET载体被认为是目前大肠杆菌表达重组蛋白的强大系统,其基础表达水平较低,利于实现目的蛋白的高效表达。原核表达系统中目的蛋白的表达量还受到重组蛋白分子量、重组菌浓度、诱导温度、诱导时间和诱导剂浓度等因素的影响[19],本研究中37℃作为大肠杆菌表达重组蛋白的最适宜温度与其他原核表达研究中相一致[20,21];最适宜的IPTG浓度也处于普遍报道使用的0.1~1.0 mmol/L浓度范围内;增加诱导时间并没有提高表达量,这可能因为宿主菌蛋白酶量随着诱导时间延长而增加导致表达蛋白产生降解作用[20]。
IGF-I成熟肽中包含的6个半胱氨酸形成3对二硫键,二硫键对于稳定蛋白三级结构具有重要作用,原核表达系统中由于缺少真核蛋白修饰体系导致二硫键易发生错配而形成包涵体[13]。重组蛋白以包涵体的形式表达优点稳定性高且具有较高的产量[22],并且可避免被宿主菌中的蛋白酶降解[10]。但缺点是后续需要通过合理的变性和复性过程以获得具有生物活性的重组目的蛋白,本研究使用6 mol/L盐酸胍溶解包涵体对其错配的二硫键进行变性[12],并利用尿素梯度复性的方法[23]成功获得了具有细胞水平生物活性的IGF-I重组蛋白。
先前报道表明重组虹鳟IGF-I能明显促进小鼠成纤维细胞的增殖[24],重组罗非鱼IGF-Ⅱ则可促进小鼠胚胎细胞和人类肺组织细胞生长[25]。本研究利用人胚胎肾细胞HEK293T检测重组星突江鲽IGF-I的生物学活性。MTT法检测显示重组IGF-I蛋白在0.6 μg/mL能够显著促进HEK293T细胞增殖,而在浓度大于1.8 μg/mL时出现抑制作用,表明本研究获得的IGF-I重组蛋白具有细胞水平的生物活性。曹诣斌等[26]报道裸鲤(Gymnocy prisprzewalskii)重组IGF-Ⅱ蛋白能促进人乳腺癌细胞MDA-MB-435生长,但超过一定浓度可能起抑制作用,Fu等[27]研究也表明IGFs既能促进部分细胞增殖又能诱导其凋亡。下一步,将在生产水平上验证重组星图江鲽IGF-I蛋白对养殖星图江鲽生长的调控作用。综上,本研究利用原核表达载体构建了星突江鲽IGF-I体外重组表达体系,获得了具有细胞水平生物活性的体外重组IGF-I蛋白,为星突江鲽及其他鱼种的IGF-I功能及机制研究奠定了基础,同时为绿色高效促生长剂的开发提供了基础资料和技术支持。
[1] Ponce M,Infante C,Funes V,et al.Molecular characterization and gene expression analysis of insulin-like growth factors I and II in the redbanded seabream,Pagrus auriga:transcriptional regulation by growth hormone[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2008,150(4):418-426.
[2] Peterson B C,Waldbieser G C,Bilodeau L.Effects of recombinant bovine somatotropin on growth and abundance of mRNA for IGF-I and IGF-II in channel catfish(Ictalurus punctatus)[J]. Journal of Animal Science,2005,83(4):816-824.
[3] Picha M E,Turano M J,Beckman B R,et al.Endocrine biomarkers of growth and applications to aquaculture:A minireview of growth hormone,insulin-like growth factor(IGF)-I,and IGF-binding proteins as potential growth indicators in fish [J].North American Journal of Aquaculture,2008,70(2):196-211.
[4] Reinecke M.Insulin-like growth factors and fish reproduction[J]. Biology of Reproduction,2010(82):656-661.
[5] Maures T,Chan S J,Xu B,et al.Structural,biochemical,and expression analysis of two distinct insulin-like growth factor I receptors and their ligands in zebrafish[J].Endocrinology,2002,143(5):1858-1871.
[6] 张俊玲,施志仪,付元帅,等.牙鲆变态中IGF-I基因表达及甲状腺激素对其的调节作用[J].水生生物学报,2011,35(2):355-359.
[7] Sitjà-Bobadilla A,Calduch-Giner J,Saera-Vila A,et al.Chronic exposure to the parasite Enteromyxum leei(Myxozoa:Myxosporea)modulates the immune response and the expression of growth,redox and immune relevant genes in gilthead sea bream,Sparus aurata L[J].Fish&Shellfish Immunology,2008,24(5):610-619.
[8] Mccormick S D.Endocrine control of osmoregulation in teleost fish[J].American Zoologist,2001,41(4):781-794.
[9] Degger B G,Richardson N,Collet C,et al.In vitro characterization and in vivo clearance of recombinant barramundi(Lates calcarifer)IGF-I[J].Aquaculture,1999,177(1):153-160.
[10] Chen J,Chen J,Chang C,et al.Expression of recombinant tilapia insulin-like growth factor-I and stimulation of juvenile tilapia growth by injection of recombinant IGFs polypeptides[J]. Aquaculture,2000,181(3):347-360.
[11] 叶 星,白俊杰,简 清,等.草鱼胰岛素样生长因子-I基因在大肠杆菌中的表达[J].中国生物化学与分子生物学报,2001,17(6):725-728.
[12] 张为民,张利红.虹鳟胰岛素样生长因子I和Ⅱ在大肠杆菌中的融合表达及促有丝分裂活性[J].动物学报,2003,49(2):266-271.
[13] 赵晓杰,陈松林,王 娜,等.大菱鲆胰岛素样生长因子-I成熟肽的克隆,重组表达及活性分析[J].水产学报,2010(1):1-7.
[14] Li Y,Wu S,Ouyang J,et al.Expression of insulin-like growth factor-1 of orange-spotted grouper(Epinephelus coioides)in yeast Pichia pastoris[J].Protein Expression and Purification,2012,84(1):80-85.
[15] 马爱军,庄志猛,李 晨,等.星突江鲽生物学特性及养殖前景[J].海洋水产研究,2006,27(5):91-95.
[16] 刘振华,王 波,姚振刚,等.星斑川鲽仔,稚,幼鱼的形态发育与生长[J].海洋科学进展,2008,26(1):90-97.
[17] Tian X C,Chen M J,Pantschenko A G,et al.Recombinant E-peptides of pro-IGF-I have mitogenicactivity[J].Endocrinology,1999,140:3387-3390.
[18] 杨 辉,张英起,颜 真,等.人血管形成素在大肠杆菌中的融合表达、纯化及活性测定[J].生物工程学报,2001,17(1):55-58.
[19] Amersham Pharmacia Biotech.GST Gene Fusion System[M]. Third Edition.Revision 2.Pharmacia Biotech,Inc,2001.
[20] 叶 星,白俊杰,劳海华,等.草鱼胰岛素样生长因子-I的融合表达、纯化和抗血清制备[J].水产学报,2002,26(2):122-126.
[21] 刘芝亮,徐永江,柳学周,等.半滑舌鳎类胰岛素生长因子-I的原核表达及活性分析[J].中国水产科学,2013,20(4):1-7.
[22] 杜 敏,朱美君,张莹夫,等.钙蛋白酶抑制蛋白功能结构域IV在大肠杆菌中的表达、纯化及其抗血清的制备[J].中国生物化学与分子生物学报,2000,16(1):23-27.
[23] 刘 侃,汪 炬,谢秋玲,等.重组类胰岛素样生长因子-I的纯化与复性[J].中国生物工程杂志,2006,26(2):29-33.
[24] Van Reeth T,Dreze P L,Szpirer J,et al.Positive selection vectors to generate fused genes for the expression of His-tagged proteins[J].Biotechniques,1998,25:898-904.
[25] Hu S,Wu J,Huang J.Production of tilapia insulin-like growth factor-2 in high cell density cultures of recombinant Escherichia coli[J].Journal of Biotechnology,2004,107(2):161-171.
[26] 曹诣斌,吴兰亲,邵邻相,等.青海湖裸鲤类胰岛素生长因子IGF-Ⅱ的原核表达[J].水生生物学报,2010(2):459-462.
[27] Fu P,Thompson J A,Leeding K S,et al.Insulin like growth factors induce apoptosis as well as proliferation in LIM 1215 colon cancer cells[J].Journal of Cellular Biochemistry,2007,100(1):58-68.
Prokaryotic expression and bioactivity analysis of growth hormone and insulin-like growth factor-I from Platichthys stellatus
Xu Yongjiang1,Zang Kun1,2,Liu Xuezhou1,Shi Bao1,Chen Shengyi1,2
(1.Key Laboratory of Sustainable Development of Marine Fisheries,Ministry of Agriculture,Yellow Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Qingdao,Shandong 266071,China;2.College of Fisheries and Life Science,Shanghai Ocean University,Shanghai 201306,China)
The mature peptide domain of insulin-like growth factor-I from Platichthys stellatus were amplified with specific primers based on its cDNA sequence.Then the matured peptide fragment was subcloned into the prokaryotic expression vector pET-28a to successfully construct IGF-I/pET-28a recombinant plasmid which were highly expressed in E.coli BL21(DE3)after being induced by IPTG with special fusion polypeptides containing His6 at their N-terminus.The obtained IGF-I polypeptide expressed in form of inclusion bodies with molecular weight of 12.1 kD and maximally accounted for 39.8%of the whole bacterial protein post 3 h induction with 0.5 mmol/L IPTG at 37℃.Western blotting analysis indicated fusion polypeptides had the antigenicity to His6 antibody.The inclusion bodies were denaturalized using 6 mol/L guanidine HCl,purified using Ni-NTA affinity chromatography and annealed by gradient dialysis in urea,then purified proteins with molecular weight of 12.1 kD which was obtained from IGF-I recombinant bacterium.The proliferation experiment showed recombinant IGF-I protein could significantly promote the proliferation of human embryonic kidney cells HEK293T at 0.6 μg/mL and inhibit the proliferation with 1.8 μg/mL which verified its biological activity. Therefore,the IGF-I prokaryotic expression system was successfully constructed in the present study and biologically active IGF-I fusion protein was obtained.The present results would be helpful for better understanding the roles of IGF-I in growth regulation and development of high effective additive for growth promotion of Platichthys stellatus.
Platichthys stellatus;insulin-like growth factor-I;prokaryotic expression;bioactivity
S96
A
1009-1742(2015)01-0067-07
2014-06-20
国家863计划项目(2012AA10A413);鲆鲽类现代产业技术体系项目(CARS-50);山东省自然科学基金项目(ZR2012CQ025)
徐永江,1981年出生,男,山东济南市人,副研究员,主要从事海水鱼类繁育理论与增养殖技术研究工作;E-mail:xuyj@ysfri.ac.cn
