右美托咪定对大鼠肾缺血再灌注不同时间心肌组织的影响
2015-12-02李新灵
李新灵,张 冰,雷 钟,杜 靖
0 引 言
肾缺血再灌注损伤(renal ischemia-reperfusion injury,RIRI)即肾脏在缺血的基础上恢复血流,组织损伤进一步加重[1],它是继急性肾损伤、肾动脉狭窄、低血压、心脏手术等许多疾病后出现的较为棘手的并发症。有数据指出,心血管大手术、肾移植术等大手术后的急性肾损伤发生率达30%,死亡率高达60%,术中肾血流灌注不足而引起缺血再灌注损伤是其主要原因[2],因此,RIRI已成为临床麻醉面临的一种常见的病理生理变化,受到广泛关注。许多研究显示,肾缺血再灌注损伤不仅限于损伤的局部组织,还会对远隔器官造成影响,严重影响着疾病的转归及预后[3-7]。因此,预防肾缺血再灌注损伤及对远隔器官的影响已成为临床亟待解决的问题。
右美托咪定(Dexmedetomidine,DEX)是一种高选择性的α2肾上腺素能受体激动剂,具有抗交感、镇静和镇痛等作用,现已广泛用于手术麻醉的辅助用药及重症监护室患者的镇静。多项研究显示,DEX可抑制炎症因子的释放,抑制氧化应激反应,具有脏器保护功能[8-10]。在缺血再灌注损伤领域,许多研究者已在动物及临床实验中证实,DEX不仅可减轻缺血再灌注脏器的损伤程度,还可减轻远隔器官的损伤,其机制可能与抑制心肌细胞凋亡和减轻脂质过氧化反应有关[3-6,11]。有研究表明,急性肾损伤患者因心力衰竭的死亡率高于因呼吸衰竭、肝功能衰竭而引起死亡[12-13]。因此,本研究拟探讨DEX对大鼠肾缺血再灌注不同时间心肌组织的影响。
1 材料与方法
1.1 实验材料 清洁级Wistar雄性大鼠40只(由新疆医科大学实验动物中心提供),体重250~300 g,实验动物合格证号:SCXK(新)2011-0003,DEX注射液(批号:09081232,江苏恒瑞医药股份有限公司),Cr试剂盒、BUN试剂盒(中生北控生物科技股份),IL-10试剂盒、TNF-α试剂盒(上海丰翔生物科技有限公司),TGL-20M离心机(成都泰盟仪器公司),显微镜(OLYMPUS公司),MP-2002分析天平梅(特勒-托利多),WD-2102A型自动酶标仪(北京六一仪器厂),移液器(北京华力航科技发展有限公司),手动组织匀浆器、超低温冰箱由新疆医科大学厚博学院提供,恒温箱、切片机由新疆医科大学附属肿瘤医院提供。
1.2 实验方法 实验前大鼠禁食12 h,自由饮水,温度:18~26℃,相对湿度:40% ~70%,通风换气:8~12次/h。将40只大鼠采用随机数字表法分为5组(n=8):假手术组,肾缺血60 min,肾缺血120 min组,DEX+肾缺血60 min组、DEX+肾缺血120 min组。
采用腹腔注射10%水合氯醛0.5 mL/100 g麻醉后鼠台固定,沿腹白线开腹约5 cm,钝性分离皮下组织与筋膜,暴露腹腔。假手术组游离双侧肾蒂,只穿线,不结扎。肾缺血60 min组暴露右肾及肾蒂,双线结扎后切除右肾,再暴露左肾及肾蒂,分离肾包膜及左肾动脉,用一根丝线将开口一面朝上的塑料管和动脉固定好,可见左肾颜色由鲜红变为暗红,则肾缺血模型成功,缺血60 min后沿塑料管先前的切口剪开丝线,恢复动脉血供,若肾脏颜色逐渐由暗红变成鲜红色表明再灌注成功。肾缺血120 min组是缺血120 min后恢复组织血供,余操作与肾缺血60 min组相同。DEX+肾缺血60 min、120 min组于缺血前30 min腹腔注射DEX 50 μg/kg,余操作同肾缺血 60 min、120 min 组。假手术组和肾缺血60 min组及肾缺血120 min组均以等容量等渗盐水替代DEX。
操作完成后动脉夹关闭腹腔,并于腹部覆盖纱布,手术灯光照以保温并计时。再灌注3 h时打开腹腔,腹主动脉采血2 mL,缓慢注入EP管,使用TGL-20 M离心机离心半径:10 cm,4℃下3000 r/min,离心10 min后取上清,采用试剂盒测血中血清肌酐(creatinine,Cr)、尿素氮(blood urea nitrogen,BUN)含量。采集完血样,断头处死大鼠,取左肾后将切口向大鼠头端延长打开胸腔,取出心脏,将肾及心脏从中间剖开,冷磷酸盐溶液冲洗干净后,吸干表面水分,冰面上取左肾下极组织和左心室心尖部组织各3块,大小为5 mm×5 mm,一块置于10%甲醛中固定,常规石蜡包埋、切片、HE染色,光镜下观察肾组织及心肌组织病理变化;另两块分析天平称重后,以1∶9的比例加冷等渗盐水,手动组织匀浆器制备组织匀浆后离心(条件同血液离心),取上清液,采用ELISA法使用IL-10、TNF-α试剂盒,WD-2102A型自动酶标仪测定肾组织及心肌组织中炎症因子水平。
1.3 统计学分析 采用SPSS 17.0统计学软件进行数据分析,计量资料以均数±标准差(±s)表示,若方差齐则多组之间的均数比较采用单因素方差分析,组间两两比较采用LSD法,方差不齐用秩和检验进行分析,以P≤0.05为差异有统计学意义。
2 结 果
2.1 大鼠血清指标和肾、心肌组织细胞因子的比较与假手术组 Cr、BUN、肾组织 TNF-α、IL-10、心肌组织TNF-α、IL-10浓度比较,其他4组均升高(P<0.05);与肾缺血60 min组上述指标比较,DEX+肾缺血60 min组、肾缺血120 min组差异均有统计学意义(P<0.05);DEX+肾缺血120 min组与肾缺血120 min组差异有统计学意义(P<0.05)。见表1、表2。
表1 大鼠肾组织和心肌组织中TNF-α和IL-10浓度的比较(±s,ng/L)Table 1 Comparison of TNF-α and IL-10 concentrations renal and myocardial tissues among different groups of rats(x ±s,ng/L)
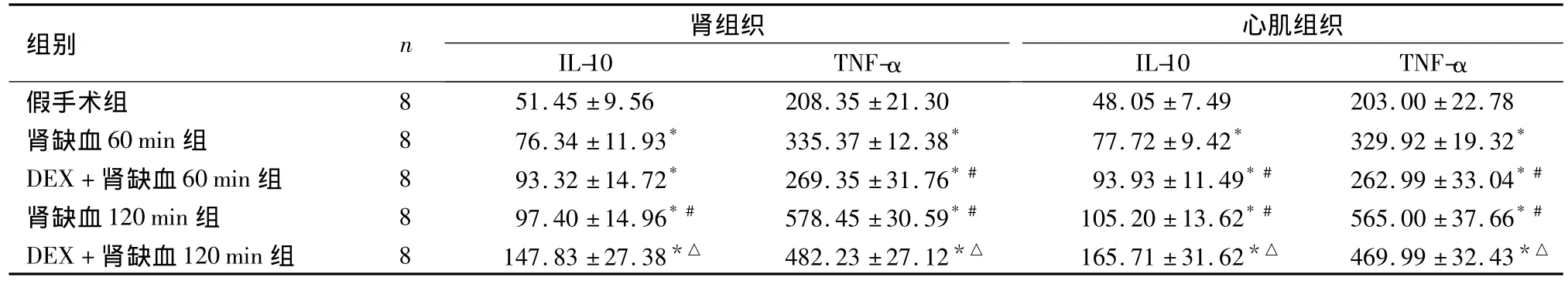
表1 大鼠肾组织和心肌组织中TNF-α和IL-10浓度的比较(±s,ng/L)Table 1 Comparison of TNF-α and IL-10 concentrations renal and myocardial tissues among different groups of rats(x ±s,ng/L)
与假手术组比较,*P<0.05;与肾缺血60 min组比较,#P<0.05;与肾缺血120 min组比较,△P<0.05
组别 n 肾组织IL-10 TNF-α心肌组织IL-10 TNF-α假手术组 8 51.45 ±9.56 208.35 ±21.30 48.05 ±7.49 203.00±22.78肾缺血60 min 组 8 76.34 ±11.93* 335.37 ±12.38* 77.72 ±9.42* 329.92 ±19.32*DEX+肾缺血60 min 组 8 93.32 ±14.72* 269.35 ±31.76*# 93.93 ±11.49*# 262.99 ±33.04*#肾缺血120 min 组 8 97.40 ±14.96*# 578.45 ±30.59*# 105.20 ±13.62*# 565.00 ±37.66*#DEX+肾缺血120 min组 8 147.83±27.38*△ 482.23±27.12*△ 165.71±31.62*△ 469.99 ±32.43*△
表2 大鼠血清中Cr和BUN浓度的比较(±s)Table 2 Comparison of Cr and BUN concentrations among different groups of rats(±s)

表2 大鼠血清中Cr和BUN浓度的比较(±s)Table 2 Comparison of Cr and BUN concentrations among different groups of rats(±s)
与假手术组比较,*P<0.05;与肾缺血60 min组比较,#P<0.05;与肾缺血120 min组比较,△P <0.05
组别 n Cr(μmol/L) BUN(mmol/L)假手术组8 53.20 ±9.21 3.75 ±0.78肾缺血60 min组 8 84.67 ±9.62* 8.55 ±1.08*DEX+肾缺血60 min组 8 69.67 ±9.52*# 7.56 ±0.70*#肾缺血120 min 组 8 167.11 ±18.81*# 13.42 ±1.25*#DEX+肾缺血120 min组 8 114.29±12.50*△ 10.27±0.78*△
2.2 显微镜下病理学改变
2.2.1 肾组织 假手术组:肾单位结构正常,细胞形态未见明显改变,染色均匀;肾缺血60 min组:肾小球毛细血管内皮轻度增生,肾小球球囊腔轻度增宽,肾小管上皮轻度水肿、空泡变性;肾缺血120 min组:肾小管上皮显著水肿,空泡变性,个别肾小管上皮细胞核消失,间质血管增生、扩张充血;DEX+肾缺血60 min组:未见明显异常;DEX+肾缺血120 min组:肾小球毛细血管内皮细胞轻度增生,肾小管上皮轻度水肿。见图1。
2.2.2 心肌组织 假手术组:心肌细胞排列整齐,细胞核呈圆形或椭圆形,染色质分布均匀,细胞质染色均匀。肾缺血60 min组:心肌部分横纹消失,肌浆溶解,胞浆嗜酸性变;肾缺血120 min组:心肌横纹消失,肌浆溶解,细胞浆嗜酸性变,心肌细胞核消失,局灶凝固性坏死,核间距增宽,间质水肿、结缔组织增生,肌间血管扩张充血,纤维母细胞增生,慢性炎细胞浸润;DEX+肾缺血60 min组:心肌局灶横纹消失,灶区出血,细胞浆嗜酸性变,间质少许炎性细胞浸润;DEX+肾缺血120min组:心肌横纹局灶消失,肌浆溶解,细胞浆灶区嗜酸性变,个别核消失,小灶区凝固性坏死。核间距轻度增宽,间质轻度水肿,肌间血管扩张充血及出血,少许慢性炎细胞浸润。见图2。
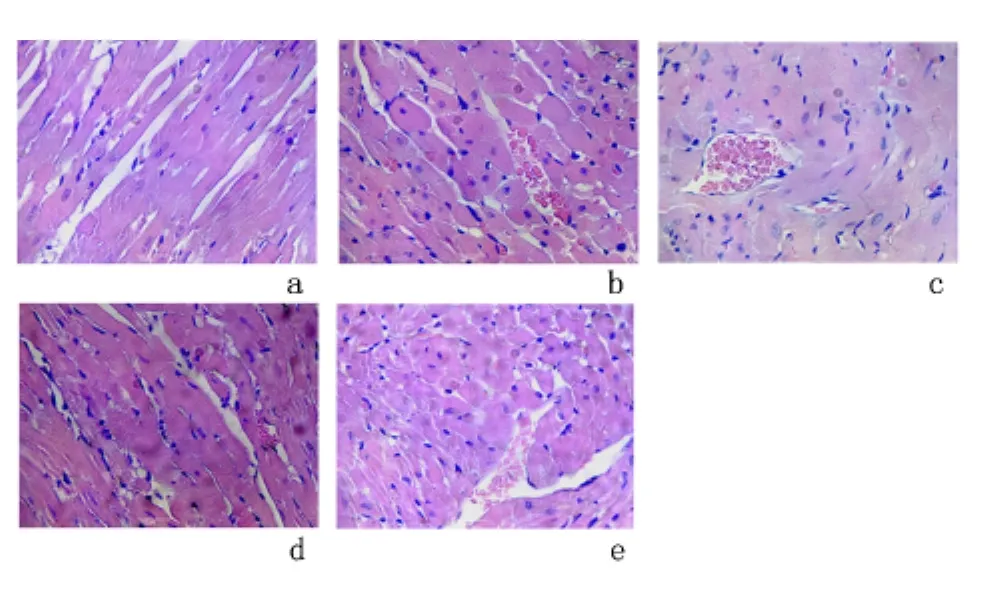
图2 镜下观察心肌组织结构变化(HE×40)Figure 2 Morphological changes of the rat myocardial tissue under the microscope(HE×40)
3 讨 论
RIRI是一个十分复杂的病理生理过程,涉及中性粒细胞浸润、氧自由基产生、细胞凋亡、钙超载,并有众多炎症介质和免疫因子的参与,其中细胞凋亡和组织炎症是主要病理变化,尤其炎症反应参与了组织损伤的全过程[1,14]。RIRI造成远隔脏器心脏损伤机制尚不明确,推测可能机制为来源于肾脏的各种化学物质包括氧自由基、细胞因子、黏附分子等大量进入体循环,致心脏微循环变化,影响心脏代谢和心功能[15]。
本研究采用右肾切除和左肾结扎后再灌注的方法制备肾缺血再灌注损伤模型[16]。通过检测血清Cr、BUN含量及肾组织病理形态学改变验证模型的制备。与假手术组大鼠比较,各组血清Cr、BUN含量升高,肾组织病理形态出现损伤,显示肾功能严重受损,与报道一致[5,17],说明 RIRI模型制备成功。
缺血时间长短是影响缺血再灌注损伤程度的主要原因之一。目前研究肾缺血再灌注损伤的模型采用的缺血时间从30~120 min长短不等。有研究显示肾缺血30 min后再灌注,血浆Cr、BUN含量差异有统计学意义,但病理损伤较轻微,而肾缺血超过120 min则组织发生不可逆性损伤[18]。周美君等[19]研究显示,缺血再灌注损伤时,炎症因子在再灌注3 h时表达升高。因此,本研究采用缺血60 min及120 min再灌注3 h制备大鼠肾缺血再灌注损伤模型,观察不同缺血时间下炎症因子的变化。
IL-10为具有代表性的内源性抗炎因子之一[20],可抑制TNF-α、IL-l、IL-8等前炎性细胞因子的产生,从而减轻组织炎症。TNF-α是创伤或感染后机体发生炎症反应的始发因子,通过激活巨噬细胞激活IL-1、IL-6、IL-8 、TNF-α 、PGE2,并与其他细胞因子间相互诱生,协同扩大其生物学效应,在炎症级联反应中发挥重要作用[21]。故本研究选择上述两指标反映肾脏缺血再灌注损伤对远隔器官的炎症反应的影响。本研究结果显示,大鼠肾缺血再灌注后,血清Cr、BUN含量升高,肾组织、心肌组织IL-10、TNF-α浓度升高,肾组织、心肌组织形态学出现损伤,提示大鼠肾缺血再灌注诱发心肌损伤,且其机制与炎症反应有关。因此,针对细胞因子进行的靶向治疗可能对减轻肾缺血再灌注诱发远隔器官损伤具有一定的作用。而结果还表明,随着缺血时间延长,肾组织、心肌组织IL-10、TNF-α浓度越高,肾组织、心肌组织出现病理损伤加剧。
本研究根据张莉等[4]的实验,于缺血前30 min腹腔注射 DEX50 μg/kg,分别检测血清 Cr、BUN 含量,肾组织、心肌组织 IL-10、TNF-α浓度的变化,观察肾组织、心肌组织病理形态学改变,研究DEX对大鼠肾缺血再灌注心肌组织的影响及机制,以及这种影响是否会因缺血的时间不同而有差异。本研究结果显示,给予缺血再灌注大鼠DEX后,与肾缺血60 min组、肾缺血120 min组对应进行比较,大鼠血清中Cr、BUN浓度和肾组织、心肌组织中TNF-α浓度均降低,心肌组织中IL-10浓度升高,DEX+肾缺血120 min组肾组织IL-10浓度升高,肾脏及心肌组织病理学损伤明显减轻,提示DEX可减轻大鼠肾缺血再灌注诱发的心肌损伤,其机制可能与抑制炎性反应有关,且随着缺血时间延长,DEX的保护作用并未下降,因此,结果对临床用药具有一定的指导作用。但由于本实验仅对缺血时间划分了2个时间段,因此,DEX与缺血时间的相关性还需进一步实验。
DEX对大鼠肾缺血再灌注后肾组织及心肌组织的保护作用的机制还不是十分清楚,Wang等[22]发现DEX可能是通过“胆碱能抗炎通路”,作用于α2-肾上腺素受体,抑制交感神经活性,致迷走神经张力相对升高起到抗炎作用。斯妍娜等[24]研究指出DEX通过JAK2/STAT3信号通路,从而调控炎症因子的水平,减轻组织炎症反应。Lai等[25]发现DEX可以抑制Toll样受体4(TLR-4)介导的炎症通路。Gu等[26]研究指出,DEX可以抑制TLR-4受体,继而下调NF-κB和丝裂原活化蛋白激酶(MAPKs)的活性,即TLR-4/NF-B/MAPKs作为完整通路发挥抗炎作用。Hofer等[27]则推断 DEX 是通过下调 NF-κB的活性,达到抑制炎症反应的作用。
综上所述,炎症因子参与了肾缺血再灌注大鼠对远隔器官心肌组织的影响;随肾缺血时间延长,再灌注后肾组织及远隔器官心肌组织病理损伤加重,炎症因子水平升高;DEX可减轻大鼠肾缺血再灌注不同时间引起的远隔器官心肌组织的损伤,其机制可能与抑制炎症因子有关。
[1] Borthwick E,Ferguson A.Perioperative acute kidney injury:risk factors,recognition,management,and outcomes[J].BMJ,2010,341(5):c3365.
[2] Tracey KJ.Physiology and immunology of the cholinergic antiinflammatory pathway[J].J Clin Invest,2007,117(2):289-296.
[3] 静广建,王耀岐,王倩倩,等.七氟醚预处理对大鼠肾脏缺血再灌注诱发肺损伤的影响[J].中华麻醉学杂志,2013,12(33):1481-1486.
[4] 张 莉,张 勇,唐 晓,等.右美托咪定对肾缺血再灌注诱发大鼠心肌损伤的影响[J].中华麻醉学杂志,2014,34(8):1017-1021.
[5] 黄海燕,陈克研,孙莹杰,等.右美托咪定对大鼠肾缺血再灌注诱发肺损伤的影响[J].中华麻醉学杂志,2014,34(2):230-233.
[6] Gu J,Chen J,Xia P,et al.Dexmedetomidine attenuates remote lung injury induced by renal ischemia-reperfusion in mice[J].Acta Anaesthesiol Scand,2011,55:1272-1278.
[7] 朱铭力,王丽锋,严玉澄,等.炎症因子在小鼠肾缺血再灌注损伤相关的肺损伤中的表达[J].中国血液净化,2012(12):674-680.
[8] Bell MT,Agoston VA,Freeman KA,et al.Interruption of spinal cord microglial signaling by alpha-2 agonist dexmedetomidine in a murine model of delayed paraplegia[J].Vasc Surg,2014,59(4):1090-1097.
[9] Sukegawa S,Higuchi H,Inoue M,et al.Locally injected dexmedetomidine inhibits carrageenin-induced inflammatory responses in the injected region[J].Anesth Analg,2014,118(2):473-480.
[10] Sugita S,Okabe T,Sakamoto A,et al.Continuous infusion of dexmedetomidine improves renal ischemia-reperfusion injury in rat kidney[J].J Nippon Med Sch,2013,80(2):131-139.
[11] 陆 斌,张序忠,胡世特,等.右美托咪定对肢体缺血再灌注致患者肺损伤的影响[J].中华麻醉学杂志,2014,34(9):1045-1049.
[12] Kelly KJ.Distant effects of experimental renal ischemia/reperfusion injury[J].J Am Soe Nephrol,2003,14(6):1549-1558.
[13] Scheel PJ,Liu M,Rabb H.Uremi lung:new insights into a forgotten condition[J].Kidney Int,2008,74(7):849-851.
[14] Selling C,Christensen AT,Krag S,et al.Erythropoietin administration is associated with short-term improvement in glomerular filtration rate after ischemia-repefusion injury[J].Aeta Anaesthesiol Stand,2011,55(2):185-195.
[15] 张佳雷,刘保江,陈 敏,等.大鼠急性肾缺血再灌注时心肌细胞氧化损伤及瑞芬太尼的干预作用[J].中国药物与临床,2009,9(9):816-818.
[16] 余晓冬,廖 波,邓显忠,等.一种新型实用的大鼠肾缺血再灌注损伤模型的建立[J].重庆医学,2011,40(5):1283-1284.
[17] 田 明,马宏仲,姜秀良,等.缺血后处理对大鼠肾缺血再灌注时c-fos蛋白表达的影[J].中华麻醉学杂志,2014,34(6):758-762.
[18] 张 荣,张建龙,马 琪,等.中性粒细胞在大鼠肾缺血再灌注造成肺损伤中的作用研究[J].四川解剖学杂志,2008,16(3):4-9.
[19] 周美君.大鼠脑缺血再灌注后炎症介质FKN,MCP-1,TNFOL表达变化的研究[D].长沙:中南大学硕士学位论文,2012.
[20] Saxena P,Aggarwal S,Misso NL,et al.Remote ischaemic preconditioning down-regulates kinin receptor expression in neutrophils of patients undergoing heart surgery[J].Interact Cardiovasc Thorac Surg,2013,17(4):653-658.
[21] Szczygiel AM,Brzezinka G,Targosz-Korecka M,et al.Elasticity changes anti-correlate with NO production for human endothelial cells stimulated with TNF-alpha[J].Pflugers Arch,2012,463(3):487-496.
[22] Wang H,Yu M,Ochani M,et al.Tracey KJ.Nicotinic acetylcholine receptor alpha7 subunit is an essential regulator of inflammation[J].Nature,2003,421(23):384-388.
[23] Tracey KJ.Physiology and immunology of the cholinergic antiinflammatory pathway[J].J Clin Invest,2007,117(2):289-296.
[24] 斯妍娜,韩 流,王晓亮,等.右美托咪定对术后吗啡自控镇痛效果的影响[J].临床麻醉学杂志,2011,27(10):953-955.
[25] Lai YC,Tsai PS,Huang CJ.Effects of dexmedetomidine on regulating endotoxin-induced up-regulation of inflammatory molecules in murine macrophages[J].J Surg Res,2009,154(2):212-219.
[26] Gu J,Sun P,Zhao H,et al.Dexmedetomidine provides renoprotection against ischemia-reperfusion injury in mice[J].Crit Care,2011,15:R153.
[27] Hofer S,Steppan J,Wagner T,et al.Central sympatholytics prolong survival in experimental sepsis[J].Crit Care,2009,13(1):R11.
