基于多肽与金属离子作用的一种高选择性Cd2+荧光比率传感器
2015-12-01王召璐冯慧云薛泽春李连之
王召璐 冯慧云 李 艳 许 涛 薛泽春 李连之
(聊城大学化学化工学院,聊城252059)
基于多肽与金属离子作用的一种高选择性Cd2+荧光比率传感器
王召璐 冯慧云 李 艳 许 涛 薛泽春 李连之*
(聊城大学化学化工学院,聊城252059)
利用固相多肽合成法合成了一种新的多肽,将该多肽与荧光基团Dansyl偶联制备了一种新的荧光化学比率传感器:Dansyl-Cys-Pro-Pro-Cys-Trp-NH2。利用荧光光谱研究了它与金属离子的相互作用。结果表明,与其它13种金属离子相比该多肽对金属Cd2+有很好的选择性。它能特异性识别Cd2+,具有水溶性好,响应时间快等优点。该肽对Cd2+具有很强的键合作用,其结合常数为3.0×1011L2·mol-2,检出限为11.5 nmol·L-1。
多肽;Cd2+;荧光化学传感器;荧光比率;荧光共振能量转移
镉(Cd)是一种危害性很大的重金属,它能够通过食物链在人和其他动物的体内积累,引起肝病、肺病和慢性脑炎等疾病[1]。长期暴露在Cd2+源中甚至可引某些癌症[2]。上世纪发生在日本的“骨痛病”就是由于人们长期食用“镉米”和饮用含镉的水造成的镉慢性中毒[3]。按世界卫生组织标准,瓶装水中镉不超过40 nmol·L-1[4],因此镉离子的检测尤为重要。研究高灵敏性、高选择性和快速检测镉离子方法具有重要意义。虽然已有一些仪器方法如原子吸收等可以灵敏地检测镉离子[5],但存在着仪器昂贵、不能及时现场检测、制备样品复杂等缺点,难以被广泛普及。近年来,用于检测金属离子的化学传感器引起人们的广泛关注,主要是由于它们具有简单快速,对待测金属离子有高的选择性和灵敏性[6-10]。其中荧光化学传感器已成为引人注目的检测重金属离子的理想化学传感器[11-12]。典型的荧光化学传感器的结构包含有2个组成元件,一个是产生信号的荧光基团,另一个是具有客体识别能力的接受体。接受体用来选择性的辨别和键合金属离子,作为受体的荧光基团主要用来传递荧光信号。一个理想的荧光传感器应具有易合成、水溶性好、灵敏性高、选择性好、检出限低等特点[13]。目前报道的大部分荧光传感器含有有机分子组成的螯合单元,这些螯合单元的合成条件非常苛刻而且它们的键合往往不是可逆的[14-16]。鉴于有机分子的这些弱点,用于检测金属离子的多肽传感器引起人们的注意。多肽基传感器有以下优点[17-20]:由天然氨基酸组成,很容易通过固相多肽合成法(SPPS)合成;选择性和灵敏性能通过进一步地改变氨基酸序列来进行优化;能应用于水溶液。最早报道的多肽基荧光传感器是基于锌指蛋白的一个含有25个氨基酸残基的肽[21]。用于检测Zn2+、Cu2+、Hg2+的多肽传感器已有报道[22]。然而,目前用于检测Cd2+的肽基荧光传感器还很少[23-24]。近年来,对于重金属离子检测的比率荧光传感器变得引人注目,主要是由于它们使得以最小空白信号更准确地测量分析物成为可能[25-26]。Lee等报道过一种肽基比率荧光传感器,用于在水溶液中检测Hg2+、Cd2+、Pb2+、Zn2+和Ag+等[27],但选择性不理想。
我们实验室报道了一种检测Cd2+的多肽荧光传感器[28]。本文通过对其多肽序列进行优化合成了一个新的多肽荧光传感器Dansyl-Cys-Pro-Pro-Cys-Trp-NH2(简写为D-P5),利用荧光光谱研究了它与重金属离子的相互作用。结果表明,Cd2+离子对其具有独特的荧光增强效应,与我们以前报道的相比提高了它的检出限。此方法简便快速、成本低廉,有望得到实际应用。
1 实验部分
1.1 试剂与仪器
Fmoc-L-Trp(Boc)-OH(色氨酸)、Fmoc-L-Cys(Trt)-OH(半胱氨酸)、Fmoc-L-Pro-OH(脯氨酸)和Fmoc-LCys(Trt)-OH(半胱氨酸),Rink Amide树脂,o-苯并三氮唑-四甲基脲六氟磷酸酯(HBTU)和1.2 mmol N,N-二异丙基乙胺(DIEA)和茴香硫醚均为上海吉尔生化公司产品;乙二硫醇(EDT)、三氟乙酸(TFA)和N,N-二甲基甲酰胺(DMF)、4-羟乙基哌嗪乙磺酸(HEPES)及各种金属盐等均为市售分析纯试剂。丹黄酰氯购自北京普益华科技有限公司。实验中所用的各种金属离子溶液均用含100 mmol·L-1NaClO4的50 mmol·L-1HEPES(pH 7.0)缓冲溶液新鲜配制。
CS136多肽合成仪(美国C S Bio Co.);CR22G高速冷冻离心机(日本日立公司);LS55荧光分光光度计(美国Perkin Elmer公司);Q-Star XL电喷雾质谱仪(美国ABI公司)。
1.2 多肽的合成
多肽的合成在CS136固相多肽合成仪上进行,采用的是标准的Fomc固相合成法[29]。按取代度0.66 mmol·g-1计算称取0.2 mmol的Rink Amide树脂置于反应瓶中,加入适量DMF溶胀1~2 h。在对应的氨基酸储瓶中加入0.6 mmol HBTU和1.2 mmol DIEA的DMF溶液和0.6 mmol相应的氨基酸,按肽链顺序从C端向N端依次加入氨基酸Fmoc-L-Trp(Boc)-OH,Fmoc-L-Cys(Trt)-OH,Fmoc-L-Pro-OH和Fmoc-L-Cys(Trt)-OH,根据设定的程序自动进行反应。每次偶合反应之后均用茚三酮显色法检测,若树脂无色或淡黄色证明反应完全,若树脂呈蓝紫色需延长时间或者加大氨基酸的量等方法再次偶合。丹黄酰氯的偶合步骤是:将1.2 mmol HBTU和0.6 mmol的丹黄酰氯用10 mL的DMF溶解后,按设定好的程序自动反应。所有氨基酸偶合完成后,用无水甲醇洗涤树脂,真空干燥。然后进行多肽D-P5的切割,称量干燥的树脂,按质量的10倍加入切割液(82.5%三氟乙酸+5%水+5%苯酚+5%茴香硫醚+2.5%乙二硫醇),常温下避光切割3~4 h,过滤,树脂用少量TFA洗涤,保留滤液[30]。用高纯氮气吹去TFA,加入5~10倍量冰冷的无水乙醚,置-20℃静置过夜,析出白色絮状沉淀,离心收集沉淀,用少量无水乙醚洗涤,真空干燥。由制备型液相色谱纯化得到的多肽的冻干粉在纯水中溶解后,用分析型高效液相色谱仪进行分析。分析柱为Spherigel C18色谱柱(250 mm×4.6 mm,5 μm)流动相A:0.1% TFA水溶液,B:甲醇。线性梯度:20%B-100%B,洗脱时间为30min,进样量20μL,流速为1mL·min-1,检测波长为275 nm。
1.3 荧光光谱的测定
1.3.1 Cd2+的荧光响应研究
将五肽溶于含100 mmol·L-1NaClO4的50 mmol·L-1HEPES(pH 7.0)缓冲溶液中,在比色皿中准确加入3.0 mL 10 μmol·L-1D-P5溶液,然后用微量进样器逐次加入Cd2+(1 mmol·L-1)溶液,使Cd2+的浓度分别为0、1、2、3、4、5、6、7、8、9、10 μmol·L-1。固定激发波长分别为290 nm和330 nm,分别测量310~570 nm和400~640 nm范围的荧光发射光谱。激发和发射狭缝分别为5和10 nm。扫描速度为:300 nm·min-1。加入的金属离子溶液总体积为30 μL,远小于3.0 mL,所以实验中体积变化可忽略。
1.3.2其它金属离子的荧光响应研究
在比色皿中准确加入3.0 mL 10 μmol·L-1D-P5溶液,测定其荧光发射光谱。然后分别加入等物质的量的用相同缓冲液配制的Cd2+、Co2+、Ni2+、Cu2+、Hg2+、Pb2+、Ag+、Cr3+、Mn2+、Al3+、Ca2+、Mg2+、Na+和K+溶液,使金属离子的浓度均为10 μmol·L-1。固定激发波长为290 nm,测量310~570 nm范围内的荧光发射光谱。激发和发射狭缝分别为5和10 nm,扫描速度为:300 nm·min-1。
1.3.3 pH值对D-P5及D-P5/Cd2+荧光光谱的影响
用50 mmol·L-1HEPES,100 mmol·L-1NaClO4(pH 7.0)缓冲溶液配制10 μmol·L-1的D-P5溶液,然后用0.1 mol·L-1的HCl和0.1 mol·L-1的NaOH调节pH值。测量D-P5及D-P5/Cd2+的荧光光谱,测量条件同1.3.2。
1.4 检出限的确定[27]
D-P5对Cd2+检出限的确定是基于D-P5与Cd2+滴定曲线。为了确定S/N,重复测量10次D-P5的荧光光谱,然后确定空白的标准偏差。对不同Cd2+浓度对应的荧光强度对Cd2+浓度的图像进行线性拟合,得出斜率.通过下面的方程计算检出限:
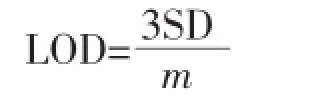
其中SD为空白的相对标准偏差,m代表直线的斜率。
2 结果与讨论
2.1 多肽的合成
采用标准的Fomc固相合成法合成了一个新的多肽Dansyl-Cys-Pro-Pro-Cys-Trp-NH2。将D-P5经过高效液相色谱图分析,在高效液相色谱上20~22 min内有一个尖峰,而其他的峰很小可以忽略。说明D-P5的纯度还是比较高的。电喷雾质谱中的质子峰m/z=837.29和m/z=859.57分别对应于[D-P5+H]+和[D-P5+Na]+。它们与该肽的分子量836.4相吻合,这表明合成的肽的正确性。
2.2 荧光光谱
2.2.1 Cd2+的荧光响应研究
D-P5的荧光光谱测量是在50 mmol·L-1HEPES缓冲溶液中进行的。图1(A)为以290 nm激发时,不同浓度Cd2+存在下D-P5的荧光光谱图。从图中可以看到,360 nm处有一弱的发射峰,510 nm处有一强的发射峰,它们分别是Trp基团和dansyl基团的荧光发射响应。随着Cd2+浓度从0增加到10 μmol·L-1,510 nm处的荧光强度逐渐增强而在360 nm处的荧光强度却逐渐减弱。从内嵌图可以看出,荧光发射比率F510/F360从2.88增加到19.45。当cCd2+∶cD-P5=1∶2时,F510/F360比值出现拐点,说明D-P5与Cd2+的结合比为2∶1。这个结果表明,在Cd2+存在下,D-P5发生了荧光共振能量转移(FRET),即Cd2+与多肽中半胱氨酸残基上的-SH发生配位作用,使D-P5发生折叠,从而拉近了Trp和dansyl之间的距离[29],此时Trp基团作为能量供体将能量无辐射地转移给作为能量受体的dansyl基团。这种能量转移导致了荧光光谱中360 nm处荧光强度的降低和510 nm处荧光强度的增加。
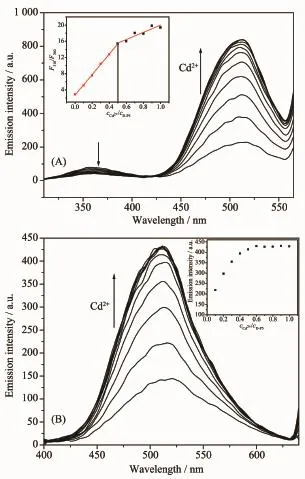
图1 不同浓度的Cd2+存在下D-P5的荧光发射光谱Fig.1Fluorescence emission spectra of D-P5 in the presence of different concentration of Cd2+
当以330 nm为激发波长时只可以观测到Dansyl基团在510 nm处的荧光响应。如图1(B),将Cd2+逐渐加入D-P5溶液中时,可以看出510 nm波长处的荧光发射强度逐渐增加。这说明由于多肽与Cd2+的结合,Cd2+配位阻断了从螯合团到荧光团的光致电子转移过程,导致荧光增强[22]。可能其他因素也会参与导致荧光增强效应。从内嵌图中可以看出,当cCd2+∶cD-P5=1∶2时发射强度达到饱和状态,说明DP5与Cd2+的结合比为2∶1。
值得注意的是,图1中2个滴定曲线图显示饱和配位后具有不同趋势:比例计量滴定曲线显示达到1∶2配位后探针发射双带比例以另一较小的斜率增大,似有另一结合过程;然而增强滴定曲线显示达到1∶2配位后不再发生新的变化。为解释这一现象,我们将图1(A)中的比例计量滴定曲线数据分开,分别做出F510对cCd2+∶cD-P5和1/F360对cCd2+∶cD-P52个图(未给出,与图1(B)和图1(A)中插图类似)。从所得图中可知,当达到1∶2配位后探针在510 nm处的荧光强度几乎不变化,与增强滴定曲线的结论一致,并没有发生新的变化。但达到1∶2配位后1/F360曲线以另一较小的斜率增大,与比例计量滴定曲线的结论一致。这说明在达到1∶2配位后,360 nm处的荧光强度还存在一个较小程度的猝灭现象,而510 nm处的荧光强度几乎没有变化。360 nm处的荧光是色氨酸残基(Trp)发射峰,这说明当Cd2+达到饱和后,继续加入Cd2+会使Trp发生荧光猝灭作用,使360 nm处的荧光强度降低。
图2是D-P5与Cd2+相互作用可能的机理图。当Cd2+存在时,使D-P5发生折叠,Trp和Dansyl之间的距离接近,为D-P5发生了荧光共振能量转移(FRET),Trp基团作为能量给体将能量无辐射地转移给作为能量受体的Dansyl基团提供了条件。从紫外灯下的图片可以看出,加入Cd2+前后,D-P5有明显的颜色变化,从无色变为浅绿色,可以定性的检测Cd2+。
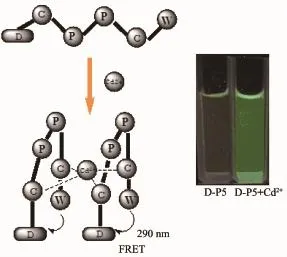
图2 D-P5与Cd2+作用的可能键合模式和紫外光下加入Cd2+前后D-P5溶液的荧光照片Fig.2Proposed possible binding mode of D-P5 with Cd2+and the fluorescence image of D-P5 solution before and after addition of Cd2+under ultraviolet light
2.2.2 多种金属离子的荧光响应研究
为了探讨D-P5对金属离子结合的选择性,研究了D-P5溶液对其它金属离子的荧光响应。测定了包括一些过渡金属离子和主族金属离子与D-P5相互作用的荧光光谱。
通过荧光比率F510/F360来体现和比较它对不同金属离子的选择性。图3为不同金属离子存在时DP5溶液荧光比率(F510/F360)增量的柱状图。结果表明,向D-P5溶液中分别加入1倍的Co2+、Ni2+、Cr3+、Ca2+、Mn2+、Al3+和1 000倍的Na+、Ca2+、K+、Mg2+等离子后,荧光比率没有明显的变化。加入1倍的Hg2+、Cu2+、Pb2+、Ag+、Zn2+后荧光比率稍有增强。值得注意的是D-P5/Cd2+的荧光比率分别为D-P5/Cu2+、D-P5/Zn2+和D-P5/Hg2+的2.03倍,2.13倍和2.42倍,这说明这些离子对Cd2+检测的干扰较小。实验表明,D-P5对Cd2+有很高的选择性。因此,可以成为检测Cd2+的传感器从而应用于实践中。
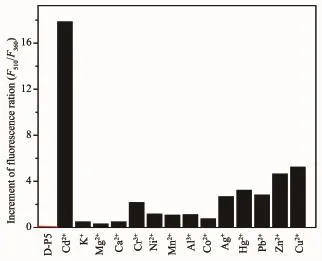
图3 金属离子存在时D-P5溶液荧光比率(F510/F360)增量Fig.3Increment of fluorescence ratio(F510/F360)of the peptide in the presence of different metal ions
由于碱金属离子大量存在于环境及生物体中,所以研究了在D-P5/Cd2+体系中存在大量第Ⅰ、Ⅱ主族金属离子时的荧光响应。如图4,当碱金属离子的浓度达到Cd2+浓度的1 000倍,D-P5/Cd2+体系的荧光发射强度却没有受到明显的影响。这个结果说明碱金属和碱土金属的存在对重金属Cd2+的检测几乎没有干扰。
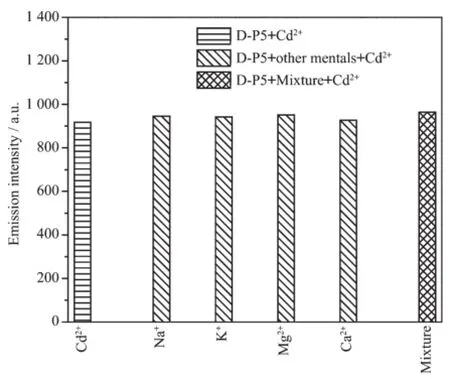
图4 Na+、K+、Mg2+、Ca2+离子存在时D-P5/Cd2+体系的荧光强度柱状图Fig.4Fluorescence intensity of D-P5/Cd2+in the presence of various metal ions
为考察不同阴离子对该体系荧光性质的影响,在相同实验条件下测定了不同阴离子存在下D-P5荧光光谱。如图5所示,在D-P5溶液中分别加入不同的钠盐,当钠盐的浓度达到D-P5的1 000倍时,D-P5在510 nm处的荧光发射强度几乎没有发生变化。这说明这些阴离子对Cd2+的检测几乎没有干扰。
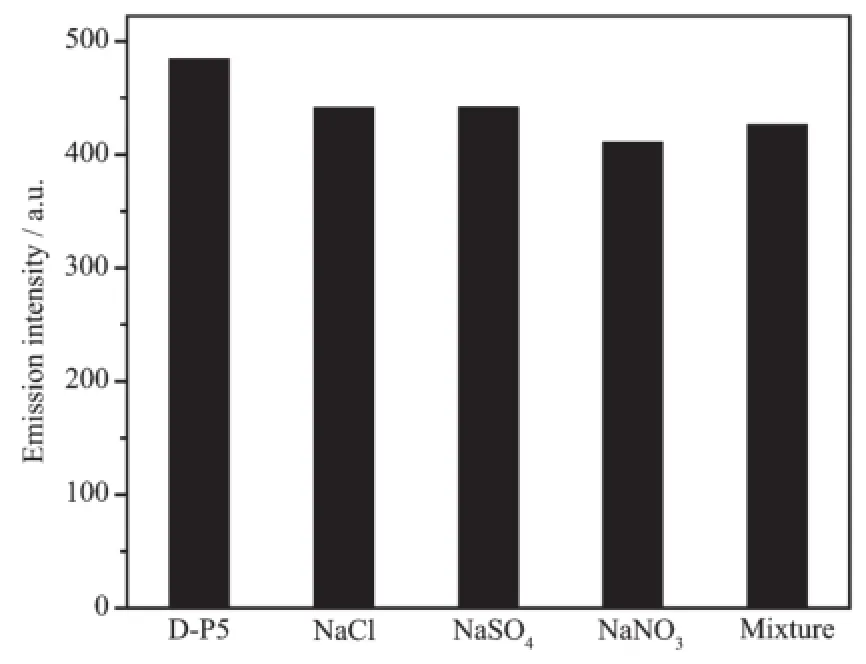
图5 不同阴离子对D-P5 510 nm处荧光强度的影响Fig.5Fluorescence intensity of D-P5 at 510 nm in the presence of various anion ions
多肽对于金属离子的选择性键合作用机制主要由两者的本性决定,主要与多肽的氨基酸种类、序列和结构构象有关。这个探针中有特殊的Cys-XX-Cys结构,根据软硬酸碱理论,-SH作为典型的软碱性配位基团很容易与作为软酸的Cd2+选择性结合,当然还与多肽的空间结构相关。
2.3 pH值对D-P5及D-P5/Cd2+荧光光谱的影响
体系的pH值是一个重要的参数,因此我们研究了pH对D-P5及D-P5/Cd2+荧光光谱的影响。从图6可以得知,当pH值低于5时D-P5及D-P5/ Cd2+荧光强度都很弱,这说明此时Cd2+与D-P5的相互作用很弱。当pH≥5时,D-P5/Cd2+的荧光比率F510/F360随着pH值的增加而增加,但是D-P5的荧光比率F510/F360没有明显的变化。这表明D-P5与Cd2+在pH>5时发生相互作用,这样就明显增强了FRET效应。这是由于Cys残基侧链-SH基团发生去质子化增加了负电荷所致[22]。而pH>7时,Cd2+易发生水解降低了其与D-P5的结合。当pH=7时,荧光比率F510/F360达到最大值,这说明在中性状态下D-P5对Cd2+的检测是最佳的。综上,本实验选用了pH=7的条件来对Cd2+进行定量分析。
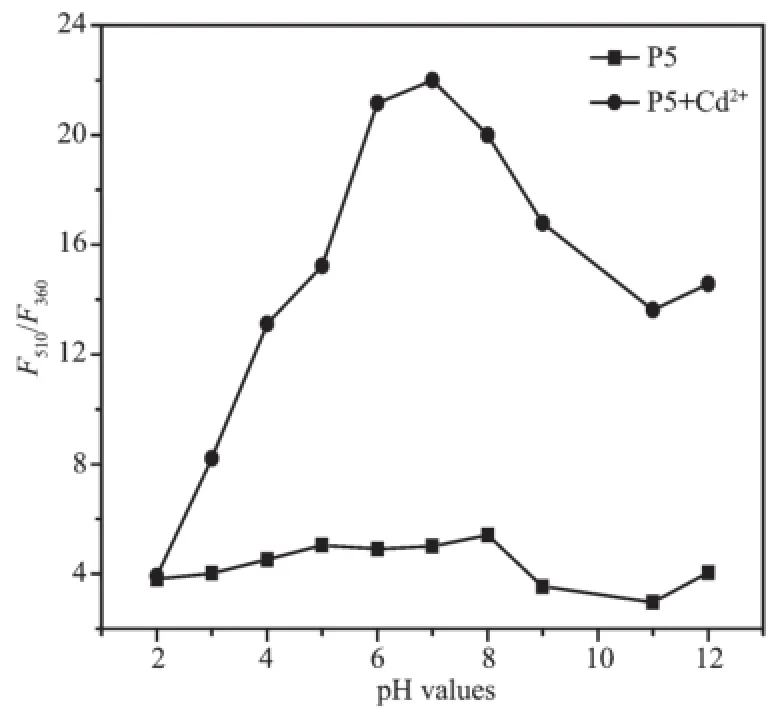
图6 pH值对D-P5和D-P5/Cd2+荧光比率(F510/F360)的影响Fig.6Effects of pH values on the fluorescence ratio (F510/F360)of D-P5 and D-P5/Cd2+system
2.4 Cd2+与D-P5的结合常数
通过计算Cd2+与D-P5的结合常数来评估D-P5与Cd2+的键合程度。结合常数的计算是基于Cd2+与D-P5作用的滴定曲线,通过以下方程拟合得到[31-32]。
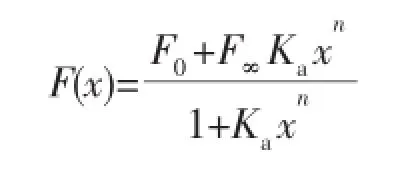
其中,x为Cd2+的浓度,F0为无Cd2+时体系的荧光强度,F(x)为特定浓度下体系的荧光强度,F∞为所有的D-P5与Cd2+配位时的荧光强度,Ka为结合常数。
如图7,以D-P5与Cd2+为2∶1的键合模式通过对510 nm处的荧光发射强度进行非线性最小二次方拟合分析,求得结合常数Ka为3.0×1011L2·mol-2。这说明D-P5和Cd2+有高的键合亲和性,是由于DP5中2个Cys残基的巯基与Cd2+形成稳定的配位键所致。
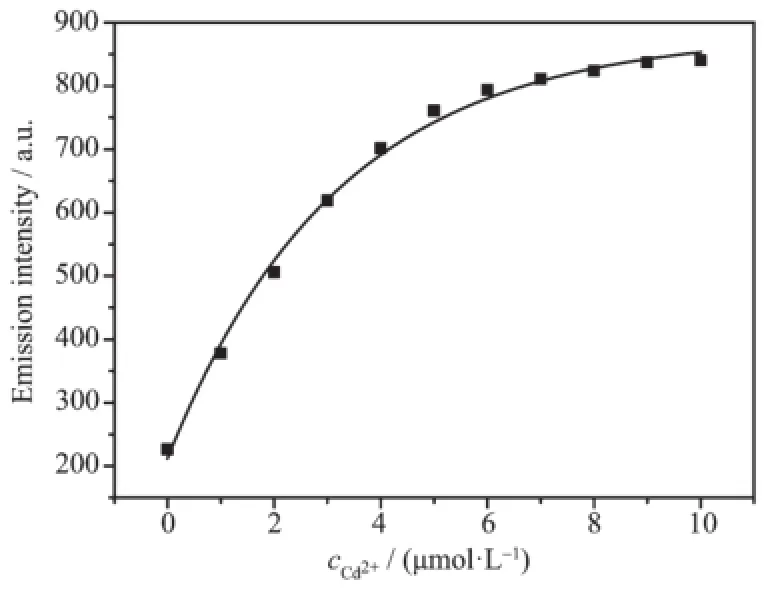
图7 荧光发射强度对Cd2+浓度的非线性最小二乘拟合曲线Fig.7Nonlinear least-squares fitting curve for emission intensity vs cCd2+
2.5 检出限的确定
通过荧光比率和Cd2+浓度之间的线性关系计算D-P5的检出限。图8为D-P5传感器对重金属Cd2+检测的灵敏度,以510和360 nm处的荧光比率(F510/F360)对Cd2+浓度作图。当Cd2+浓度低于5 μmol· L-1时,随着Cd2+浓度的增加荧光发射强度呈比例增加。通过计算得到其检出限为11.5 nmol·L-1。比我们实验室曾报道的检测Cd2+的传感器检出限低[28]。
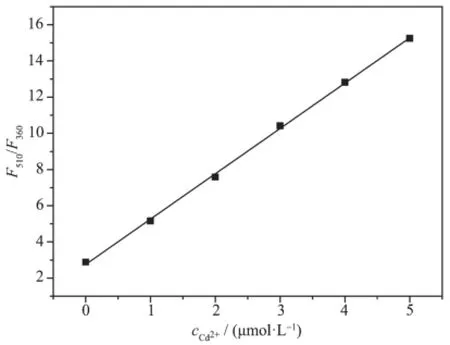
图8 D-P5的荧光比率F510/F360对cCd2+作图Fig.8Plot of fluorescent ratio F510/F360of D-P5 vs cCd2+
3 结论
通过Fomc固相合成法合成了一个新的多肽基荧光比率化学传感器。利用荧光光谱研究了其与金属离子的相互作用。结果表明,D-P5对Cd2+有很好的选择性和灵敏性,它主要是基于Trp残基和荧光基团Dansyl之间的荧光共振能量转移机理来进行传感的。D-P5与Cd2+相互作用形成2∶1的配合物,求得其结合常数为3.0×1011L2·mol-2。它能用于中性溶液中Cd2+的高灵敏度检测,检出限为11.5 nmol· L-1。
[1]Huff J,Lunn R M,Waalkes M P,et al.Int.J.Occup.Environ. Health,2007,13(2):202-12
[2]Bridges C C,Zalups R K.Toxicol.Appl.Pharmacol.,2005, 204(3):274-308
[3]ZHU Zhi-Jun(朱志军),LIU Dian-Jun(刘殿骏),WANG Zhen-Xin(王振新).Chinese J.Appl.Chem.(应用化学),2013,30 (6):716-722
[4]World Health Organization,Avenue Appia 20,1211 Geneva 27,Switzerland.https://www.who.int/water_sanitation_health/ dwq/chemicals/cadmium/en
[5]Li Y,Chen C,Li B,et al.J.Anal.At.Spectrom.,2006,21 (1):94-96
[6]Callan J F,de Silva A P,Magria D C.Tetrahedron,2005,61 (36):8551-8588
[7]Kim J S,Quang D T.Chem.Rev.,2007,107(9):3780-3799
[8]Liu Y,Zhang S W,Miao Q,et al.Macromolecules,2007,40 (14):4839-4847
[9]Clark M A,Duffy K,Tibrewala J,et al.J.Org.Lett.,2003,5 (12):20512054
[10]Nolan E M,Lippard S J.Acc.Chem.Res.,2009,42(1):193-203
[11]Fu Q,Tang Y,Shi C,et al.Biosens.Bioelectron.,2013,49 (11):399-402
[12]Haugland R P.Handbook of Fluorescent Probes and Research Chemicals,6th Ed.Eugene,OR,USA:Molecular Probes, Inc.,1996.
[13]Kramer R.Angew.Chem.Int.Ed.Engl.,1998,37(6):772-773
[14]Beltramello M,Gatos M,Mancin F,et al.Tetrahedron.Lett., 2001,42(52):9143-9146
[15]Klein G,Kaufmann D,Schurch S,et al.Chem.Commun., 2001(6):561-562
[16]Prodi L,Montalti M,Zaccheroni N,et al.Helv.Chim.Acta,2001,84(3):690-706
[17]Kim J S,Quang D T.Chem.Rev.,2007,107(9):3780-3799
[18]Merrifield R B.J.Am.Chem.Soc.,1963,85(14):2149-2154
[19]Bridges C C,Zalups R K.Toxicol.Appl.Pharmacol.,2005, 204(3):274-308
[20]Von Zglinicki T,Edwall C,Ostlund E,et al.J.Cell Sci., 1992,103(4):1073-1081
[21]Walkup G K,Imperiali B.J.Am.Chem.Soc.,1996,118(12): 3053-3054
[22]Joshi B P,Cho W M,Kim J S,et al.Bioorg.Med.Chem. Lett.,2007,17(23):6425-6429
[23]Huston M E,Engleman C,Czarnik A W.J.Am.Chem.Soc., 1990,112(19):7054-7056
[24]Charles S,Yunus S,Dubois F,et al.Anal.Chim.Acta, 2001,440(1):37-43
[25]Xavier M,Shimon W,Marcus J.Chem.Rev.,2006,106(5): 1785-1813
[26]Lakowicz J R.Principles of Fluorescence Spectroscopy.New York:Kluwer Academic/Plenum,1999.
[27]Joshi B P,Park J,Lee W I,et al.Talanta,2009,78(3):903-909
[28]Li Y,Li L Z,Pu X W,et al.Bioorg.Med.Chem.Lett., 2012,22(12):4014-4017
[29]Fields G B,Nobel R L.Int.J.Pept.Protein Res.,1990,35 (3):161-214
[30]Muhlradt P F,Kie B M,Meyer H.J.Exp.Med.,1995,185 (11):1951-1958
[31]Wagner B D,Mcmanus G J.Anal.Biochem.,2003,317(2): 233-239
[32]Suliman F E O,Al-Lawati Z H,Al-Kindy S M Z.J.Fluoresc., 2008,18(6):1131-1138
A High Selective Fluorescent Ratio Sensor for Cd2+Based on the Interaction of Peptide with Metal Ion
WANG Zhao-LuFENG Hui-YunLI YanXU TaoXUE Ze-ChunLI Lian-Zhi*
(School of Chemistry and Chemical Engineering,Liaocheng University,Liaocheng,Shandong 252059,China)
A new fluorescent ratio chemosensor(Dansyl-Cys-Pro-Pro-Cys-Trp-NH2)for metal ions has been synthesized via Fmoc solid-phase peptide synthesis.The interactions of the peptide with metal ions were investigated by fluorescence spectroscopy.Results showed that it showed high selectivity toward Cd2+over other commonly coexistent metal ions.The peptide has the advantages of specific recognition to Cd2+,a good watersoluble and a fast response.The peptide tightly binds to Cd2+with the binding constant of 3.0×1011L2·mol-2and the detection limit of 11.5 nmol·L-1.
peptide;Cd2+;fluorescent chemosensor;fluorescent ratio;fluorescence resonance energy transfer
O614.24+2
A
1001-4861(2015)10-1946-07
10.11862/CJIC.2015.261
2015-01-11。收修改稿日期:2015-07-23。
山东省自然科学基金(No.ZR2011BL002)资助项目。
*通讯联系人。E-mail:lilianzhi1963@163.com;会员登记号:S06N1205M1202。
