富氢生理盐水对兔脊髓损伤神经细胞凋亡及凋亡相关蛋白表达的影响
2015-11-29李葛威吴成如方健王海峰孙国安
李葛威,吴成如,方健,王海峰,孙国安
(安徽医科大学解放军临床学院,安徽 合肥 230031)
脊髓损伤(Spinal Cord Injury,SCI)是常见的创伤性疾病,据有关流行病学调查显示,其平均年发病率为38.0/100万[1],而每年美国对SCI患者的医疗支出超过60亿美元[2]。因此,关于SCI的预防和治疗已成当今医学界广泛关注的焦点。目前,SCI的病理机制研究表明氧自由基介导的细胞凋亡是其损伤的主要原因[3],而富氢生理盐水通过参与氧自由基介导的有关反应,而对大鼠神经功能缺损具有保护作用[4]。刘漪等发现氢气饱和生理盐水能够影响大鼠的脑缺血再灌注损伤,通过免疫组化法检测脑皮质区凋亡相关蛋白表达,发现凋亡指数明显降低,此外TUNEL技术显示氢气饱和生理盐水可抑制脑皮质区神经细胞凋亡[5]。因此,本实验基于前人的理论研究,进一步探明富氢生理盐水对家兔SCI神经细胞凋亡及凋亡相关蛋白表达的影响,为临床治疗SCI提供新的方法和理论依据。
1 材料与方法
1.1 材料取30只雄性家兔,体重2.5~3 kg(购自青龙山,南京)。将家兔随机分为3组,即健康组、对照组和治疗组,每组各10只。对照组采用对生理盐水对SCI家兔进行治疗,每天2次,5 ml/kg,疗程为15天。治疗组采用腹腔注射2%富气生理盐水治疗SCI家兔,每天2次,5 ml/kg,疗程为15天。
1.2方法
1.2.1 造模方法 随机选取20只家兔,以3%戊巴比妥钠(1mL/kg)耳缘静脉麻醉。麻醉起效后将家兔固定于专用固定板上,以T10为中心,行后正中长约5 cm纵行切口,咬除棘突、椎板,去除两侧小关节突,暴露T10段脊髓。采用Allen法[6]造模,即将消毒的圆柱状金属棒(直径3 mm,重量(20 g)以固定的高度(5 cm)自由落下,制成脊髓打击模型。术中见兔尾痉挛性摆动,双下肢及躯体回缩扑动,视为打击成功。
1.2.2 术后处理 0号可吸收线缝合皮肤,术后予庆大霉素(40000I U/Kg)肌注,预防感染。室温维持在23~25℃,保持干燥通风。每只家兔分笼饲养,不限制进食和饮水,术后定时协助SCI家兔排尿、排便。
1.2.3 家兔SCI后肢行为功能评定 采用Basso[7]所提出的分级评分法,根据SCI动物后肢的运动能力分为21个等级即最高分为21分。主要观察:后肢和尾部的活动能力,能否负重脚掌站立行走,前后肢能否协调运动,后脚爪的伸展和尾巴的平衡。
1.2.4 凋亡细胞检测 应用脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TdT-mediated dUTPNick End Labeling,TUNEL)检测神经细胞的凋亡情况(购自sigma,南京),检测程序严格按照试剂盒操作说明进行,细胞核呈蓝色的为正常细胞。
1.2.5 Bcl-2、Bax、caspase-3蛋白表达测定 采用蛋白免疫印迹(Western blot)测定。将样品在细胞溶解液中溶解均匀后,14000 rpm离心15 min,取上清,测定样品蛋白浓度(Bradford法)。调整蛋白浓度后,取25μg caspase-3样品在Laemmli缓冲液中变性,取50Bμg Bcl-2、Bax于100℃,变性5min,上样于12%SDS-PAGE胶,电泳(浓缩胶80V,分离胶100V)1.5 h后分离蛋白,转至硝化纤维素膜上(250 mA,2.5 h)。 转印蛋白质后的硝化纤维素膜用含5%脱脂奶粉的TBS室温下封闭,再用TBST洗涤2次,放入一抗中孵育过夜(Bcl-2为1:100,Bax为1:200,caspase-3为1:500),TBST洗涤3次后,与二抗(1:1000 goat anti-mouse IgG1-HRP,sc-2060)在室温下摇床孵2 h,再用TBST洗膜3次,加入化学荧光试剂进行增强,采用Fuji Super RX进行曝光显影。计算Bcl-2、Bax、caspase-3条带光密度值与βactin条带光密度值的比值,作为该样品蛋白水平的相对表达量。
1.3 统计学方法采用SPSS 13.0软件进行数据的统计学分析,计数资料采用均数±标准差(±s)表示,组间比较采用t检验,P<0.05为差异具有统计学意义,病理形态采用描述性统计分析。
2 结 果
2.1 家兔后肢行为功能评定分析对健康家兔和造模后家兔进行后肢行为功能评定发现,与健康组相比,模型组家兔后肢均呈不同程度弛缓性瘫痪,评分在2.5~4.5之间,评分具有显著差异(P<0.05),并且造模1 h、6 h、24 h后,评分无显著差异(P>0.05),说明造模成功。具体数据分析见表1。
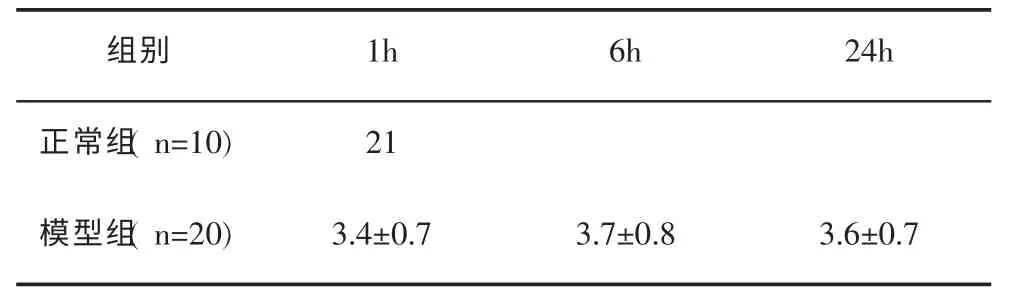
表1家兔后肢行为功能评定分析
2.2凋亡细胞对比分析通过TUNEL法检测凋亡细胞数,A图为健康家兔神经细胞凋亡情况图,从图中看出凋亡细胞数较少;B图为造模后家兔神经细胞凋亡图,可见大量神经细胞凋亡;进过15 d治疗后,C图为对照组家兔神经凋亡细胞图,与B图相比,细胞凋亡数有所减少;D图治疗组家兔神经凋亡细胞图,与B、C图相比,神经细胞凋亡数明显减少。
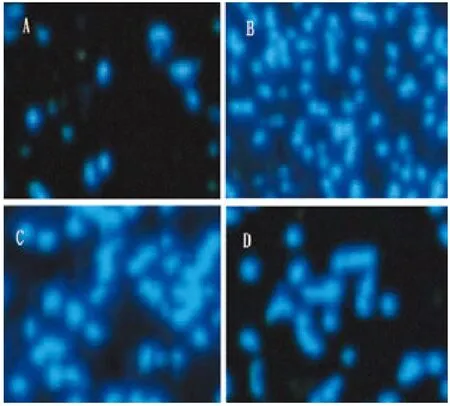
图1家兔脊髓神经细胞凋亡分析图
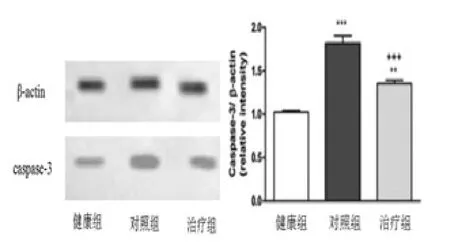
图2 脊髓组织caspase-3蛋白表达情况(**P<0.01,***P<0.001,+++P<0.001)
2.3 不同时期Bax、Bcl-2、Bax/Bcl-2蛋白表达比较分析结果显示,给药10d后,治疗组Bax蛋白表达量显著低于对照组(t=2.263,P=0.035),但显著高于健康组(t=1.975,P=0.042),具体数据分析见表2。10 d后,治疗组Bcl-2蛋白表达量高于对照组(t=0.463,P>0.05),差异不具有统计学意义;但是高于健康组(t=2.486,P=0.028),差异具有统计学意义。具体数据分析见表3。10d后,治疗组Bax/Bcl-2蛋白表达显著低于对照组,差异具有统计学意义(t=2.354,P=0.031)。具体数据分析见表4。

表2不同时期Bax蛋白表达比较情况
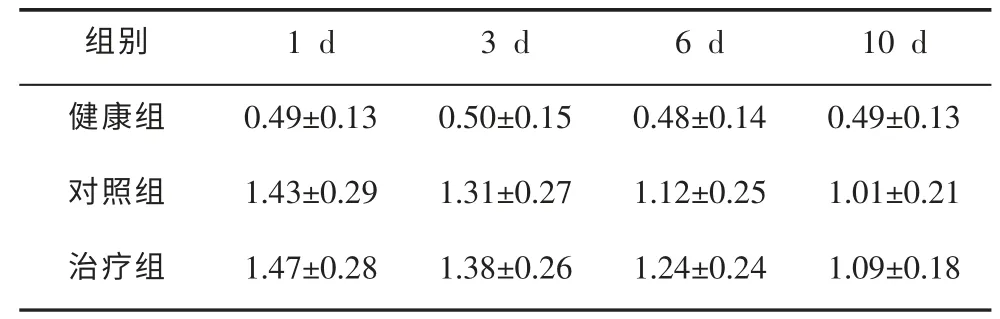
表3不同时期Bcl-2蛋白表达比较情况
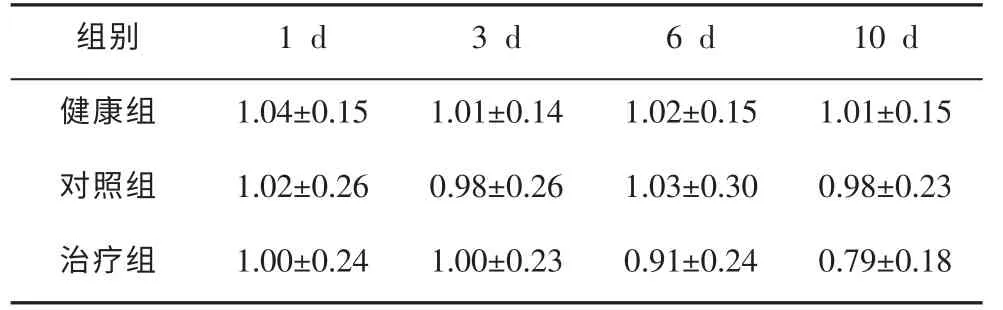
表4不同时期Bax/Bcl-2蛋白表达比较情况
3 讨论
2.3 caspase-3蛋白表达分析通过对比分析给药后,家兔caspase-3蛋白表达情况发现,对照组caspase-3蛋白表达显著高于健康组(P<0.001)和治疗组(P<0.001),与健康组相比,治疗组caspase-3蛋白表达水平较高(P<0.01)。
Allen首次设计了脊髓背侧打击模型,利用不同重量的重锤从不同的高度垂直落下,打击脊髓背侧造成不同程度的损伤。随后其他研究者,如Sufianova、Iwanami等提出了其他SCI造模方法[8,9]。由于Allen法具有与人类SCI的性质、脊髓水肿缺血和损伤反应,与人类SCI的性质非常相近[10],因此我们采用Allen法建造SCI模型,并成功造模。
近年大量研究表明,氢气是一种重要的生理性调节因子,分子量小,易于扩散,弥散能力强,能轻易通过气体扩散穿过细胞膜和细胞质基质,甚至可以到达线粒体和细胞核。在细胞和器官水平上,具有明确的选择性抗氧化、抗炎症和抗细胞凋亡等脏器保护作用,对许多疾病具有治疗效果[11]。2007年Ohsawa等[12]通过研究氢气对于脑部组织细胞的影响,发现其可以有效减少脑部组织细胞的凋亡。因此我们将SCI家兔给予生理盐水和富氢生理盐水治疗,探讨富氢生理盐水对于SCI神经细胞及凋亡相关蛋白的表达是否产生影响,结果显示富氢生理盐水能够有效减少神经细胞凋亡和抑制相关蛋白的表达。
细胞凋亡是一个细胞自我破坏的程序性生化过程,其发生受到细胞内凋亡调节蛋白的调控,促凋亡蛋白和抗凋亡蛋白之间平衡丧失是细胞凋亡的根本原因。Bcl-2家族的蛋白构成一个异常复杂的相互作用网络,能够调节线粒体膜的通透性,从而调节细胞凋亡[13]。Bax促进凋亡,Bcl-2抑制凋亡,Bcl-2/Bax比率是启动细胞凋亡的分子开关,其决定了细胞对各种凋亡刺激的敏感性,神经元细胞是否走向死亡[14]。此外,Caspase-3是调节细胞凋亡的关键蛋白酶[15]。正常情况下,胞质中的Caspase-3以无活性的酶原形存在,细胞凋亡信号的出现可导致Caspase-3在多种蛋白水解酶的作用下,发生裂解而活化,激活线粒体依赖途径和死亡受体介导的信号转导途径[16]。我们通过给药富氢生理盐水后,检测家兔脊髓组织的Bcl-2、Bax、caspase-3蛋白含量发现,与给药生理盐水相比,前者可有效降低这3种蛋白质的含量,并且Bax/Bcl-2比值逐步减小,表明富氢生理盐水可能通过抑制细胞凋亡来减轻家兔脊髓损伤。
综上所述,本研究通过成功建立SCI家兔模型,观察富氢生理盐水对SCI后神经细胞凋亡及凋亡相关蛋白表达的影响,并依据已有研究进展结果,进行进一步探讨。经实验证明,富氢生理盐水可减少凋亡相关蛋白的表达从而有效缓解细胞凋亡,为临床治疗SCI提供新的方法和理论依据。
[1] 宁广智.天津市SCI流行病学调查研究[D].天津:天津医科大学.2012.93.
[2]Burke DA,Linden RD,Zhang YP,et al.Incidence rates and populations at risk for spinal cord injury:A regional study[J].Spin Cord,2001,39(5):274-278.
[3] Allen CL,Bayraktutan U.Oxidative stress and its role in the pathogenesis of ischaemic stroke[J].Int J Stroke,2009,4:461.
[4] Qing J,Kangli H,Lidong Z,et al.The effect of hydrogen-rich saline on the brain of rats with transient ischemia[J].JSurg R es,2011,168:95.
[5] 刘漪,李雪梅,谭永星.氢气饱和生理盐水对局灶性脑缺血再灌注损伤大鼠神经功能缺损、神经细胞凋亡及凋亡相关蛋白表达的影响[J].临床神经病学杂志,2013,26(5):351-354.
[6]Allen AR.Surgery of experimental lesion of spinal cord equivalent to crush injury of fracture dislocation of spinal column.A preliminary report[J].JAMA,1911,57:878-880.
[7] Basso DM,Beattie MS,Bresnahan JC.Graded histological and locomotor outcomes after spinal cord contusion using the NYU weight-drop device versus transection[J].Exp Neurol,1996,139:244-256.
[8] Sufianova GZ,Usov LA,Sufianov AA,et a1.New minimally invasive model of spinal cord ischemia in rats[J].Bull Exp Biol Med,2002,133(1):98-101.
[9] Iwanami A,Yamane J,Katoh H,et a1 Establishment of graded spinal cord injury Model in a nonhuman primate:the common marmoset[J].Neurosci Res,2005,80(2):172-181.
[10]牟广韬.SCI模型建立的研究进展[J].中国中西医结合外科杂志,2014,20(2):223-225.
[11]Dixon BJ,Tang J,Zhang JH.The evolution of molecular hydrogen:a noteworthy potential therapy with clinical significance[J].Med Gas Res,2013,3(1):10.
[12]Ohsawa I,Ishikawa M,Takahashi K,et al.Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals[J].Nat Med,2007,13(6):688-694.
[13]Justin K,Xiaoke C,Brian Lr,et al.Examining the Molecular Mechanism of Bcl-2 FamilyProteins at Membranes by Fluorescence Spectroscopy[J].Methods in Enzymology,2014(544):1-23.
[14]Imène J,Atf Nagbou,Francine Behar-Cohen,et al.Interaction of Leukocyte Elastase Inhibitor/L-DNase IIwith BCL-2 and BAX[J].Biochimica et Biophysica Acta,2014,(1842):2807-2815.
[15]Tae HL,Jihoon C,Byeong MK.Saikosaponin C inhibits lipopolysaccharide-induced apoptosis by suppressing caspase-3 activation and subsequent degradation of focal adhesion kinase in human umbilical vein endothelial cells[J].BBRC,2014,(445):615-621.
[16]赵瑞杰,李引乾,王会,等.Caspase家族与细胞凋亡的关系[J].中国畜牧杂志,2010,46(17):73-78.
