人乳头瘤病毒18型L1蛋白在昆虫杆状病毒系统中的表达
2015-11-29麻粉莲张骞郑丽舒
麻粉莲,张骞,郑丽舒
中国疾病预防控制中心 病毒病预防控制所,北京 100052
人乳头瘤病毒(human papillomavirus,HPV)是一种闭环双链DNA 病毒,16 和18 型HPV 与宫颈癌的发生密切相关。全球每年约27万人死于宫颈癌,其中80%死亡病例发生在发展中国家[1]。阻断HPV感染是预防宫颈癌的重要途径之一。目前,上市的HPV16/18型二价HPV疫苗和HPV6/11/16/18型四价HPV疫苗均在9~26岁女性中用于预防宫颈癌,但价格较贵,且只能预防2 种高危型HPV 型别[2]。因此,研发抗原谱广、价格便宜、使用方便的新型HPV 疫苗具有重要意义。由于HPV具有多样性、体外培养困难和潜在的致癌性等特征,HPV 疫苗研发难以采用减毒活疫苗或死疫苗技术,只能进行基因工程疫苗研发。L1 蛋白是HPV 疫苗研究的主要靶抗原。昆虫杆状病毒表达系统具有磷酸化、糖基化和蛋白切割加工修饰等功能,表达产物的生物学特性与天然产物相似,安全性较高,制备过程简单,适用于蛋白质工程研发[3]。我们利用杆状病毒表达系统表达L1蛋白,为进一步研究新型HPV疫苗奠定基础。
1 材料与方法
1.1 材料
昆虫细胞Sf9和载体pFastBac1购自美国Invitrogen 公司;大肠杆菌DH5α和DH10Bac 由本科室保存;L1基因根据NCBI 提供的HPV18 野生型L1基因序列(NC_001357.1)人工合成,全长1629 bp。
PCR仪、限制性内切酶和转染试剂CellFectin购自美国Invitrogen公司;DNA凝胶回收试剂盒和PCR产物回收试剂盒购自TaKaRa 公司;蛋白质和DNA marker 购自北京博迈德科技发展有限公司;鼠抗L1单克隆抗体购自Fitzgerald 公司;昆虫细胞培养基Sf900ⅡSFM和Grace不完全培养基购自Gibco公司;HRP标记羊抗小鼠IgG抗体购自北京中杉金桥生物技术有限公司。
1.2 HPV18 L1序列的优化及TA克隆
为提高杆状病毒系统目的蛋白表达量,本实验根据Sf9 细胞密码子使用偏性,参考GenBank 中HPV18L1基因组序列,在不改变氨基酸序列的前提下,将L1基因编码区序列进行优化,并在基因起始密码子区域添加Kozak 序列,在5'和3'端分别添加EcoRⅠ和XbaⅠ限制性酶切位点,送Invitrogen 公司合成。将L1序列连接至pMD18-T 载体,转化宿主菌,挑克隆进行PCR和测序,鉴定正确的重组克隆质粒命名为pMD18T-L1。
1.3 重组杆状病毒转移载体pFB1-L1的构建
将重组克隆质粒pMD18T-L1和pFastBac1分别用EcoRⅠ和XbaⅠ双酶切,回收L1基因片段和pFastBac1 载体片段,经T4DNA 连接酶于16℃连接2 h,连接产物转化感受态大肠杆菌DH5α,提取质粒,经EcoRⅠ和XbaⅠ双酶切鉴定,送Invitrogen 公司测序。鉴定正确的重组杆状病毒转移载体命名为pFB1-L1。
1.4 重组杆状病毒穿梭质粒rBacmid-L1的构建
将转移载体pFB1-L1 转化含Bacimd 和Helper质粒的大肠杆菌DH10Bac感受态细胞,经50 μg/mL卡那霉素、7 μg/mL庆大霉素、10 μg/mL四环素和蓝白斑筛选,挑取白色菌落并对其反复稀释筛选,挑取克隆,采用通用引物M13F(5'-CCCAGTCACGACGT TGTAAAACG-3')、M13R(5'-AGCGGATAACAATT TCACACAGG-3')进行PCR 鉴定(反应条件:93℃预变性3 min;95℃变性45 s,55℃退火45 s,72℃延伸5 min,共30个循环;72℃再延伸7 min),将PCR产物送Invitrogen公司测序,鉴定正确的重组杆状病毒穿梭质粒命名为rBacmid-L1。
1.5 重组杆状病毒rBacmid-L1的包装
按照Bac-to-Bac 说明书,使用CellfectinⅡ转染试剂将重组质粒rBacmid-L1 转染对数生长期的Sf9细胞,以仅含脂质体的等量转染试剂转染Sf9细胞作为阴性对照,显微镜下观察致细胞病变。转染7 d后收集上清,即为第一代重组杆状病毒,命名为rBac-L1-P1。将rBac-L1-P1 按MOI=0.1,细胞数为1×106传代,感染对数生长期的Sf9 细胞,4 d 后出现细胞病变时收集上清,即为rBac-L1-P2,按此方法获得rBac-L1-P3。
1.6 重组杆状病毒的鉴定
1.6.1 PCR 鉴定 用DNA 提取试剂盒提取感染rBacmid-L1 的Sf9 细胞的病毒基因组,以其为模板、M13F 和M13R 为引物,PCR 扩增L1基因,反应条件同1.4,1%琼脂糖凝胶电泳鉴定。
1.6.2 间接免疫荧光法鉴定 将重组杆状病毒rBacmid-L1 感染96 孔板中培养的Sf9 细胞,以仅含脂质体的等量转染试剂转染Sf9细胞作为阴性对照,3 d 后移去培养上清,加入80%丙酮室温固定细胞10 min;弃丙酮,加入HPV18 L1 抗体,置37℃孵育1 h;加入FITC 标记的羊抗小鼠IgG 抗体,置37℃孵育1 h;加入60%甘油溶液封板,荧光显微镜下观察。
1.6.3 Western 印迹鉴定 重组杆状病毒rBacmid-L1感染Sf9昆虫细胞3 d后,离心收集上清和细胞沉淀。将上清用超滤管进行浓缩,细胞沉淀用PBS 重悬,分别取20 μL样品,经12% SDS-PAGE分离,电转移至NC膜上,5%脱脂奶封闭过夜;加入小鼠抗L1单克隆抗体,37℃孵育1 h;加入HRP标记的山羊抗小鼠IgG 抗体,37℃孵育0.5 h,加入TMB 显色5 min。
2 结果
2.1 HPV18 L1序列的优化及TA克隆
按照Sf9 细胞密码子嗜性优化L1基因序列,氨基酸序列未发生改变。将重组克隆质粒pMD18TL1进行PCR,经琼脂糖凝胶电泳分析,可见1629 bp的L1基因片段(图1)。测序结果显示重组质粒pMD18-T-L1的序列正确。
2.2 转移载体pFB1-L1的鉴定
转移载体pFB1-L1的双酶切产物经琼脂糖凝胶电泳分析,可见5238 bp 的载体片段和1629 bp 的L1基因片段,大小与预期相符(图2)。测序结果表明,所获得的基因序列与L1基因的序列同源性为100%。
2.3 重组杆状病毒穿梭质粒rBacmid-L1的鉴定
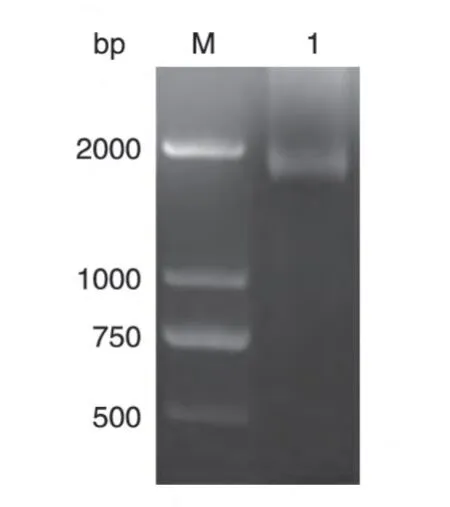
图1 重组克隆质粒pMD18T-L1的PCR鉴定
重组杆状病毒穿梭质粒rBacmid-L1 的PCR 产物经琼脂糖凝胶电泳分析,可见约3829 bp(1629+2300 bp)的基因片段,与预期相符(图3)。测序结果表明,所获得的基因序列与L1基因序列的同源性为100%,表明L1基因已整合到Bacmid质粒上。
2.4 重组杆状病毒的包装
穿梭质粒转染Sf9 细胞3 d 后,在显微镜下观察。与阴性对照细胞相比,细胞变圆、变亮,间距变大,细胞出现破碎、脱落;转染7 d后细胞大片脱落,有明显细胞病变(图略)。
2.5 重组杆状病毒的鉴定
2.5.1 PCR 鉴定 提取感染rBacmid-L1 的Sf9 细胞的病毒基因组,以其为模板行PCR 扩增,产物经1%琼脂糖凝胶分析,可见约3829 bp(1629+2300 bp)的片段,与预期相符(图4)。测序结果显示重组质粒rBacmid-L1的序列正确,表明重组杆状病毒基因组中整合了L1基因。
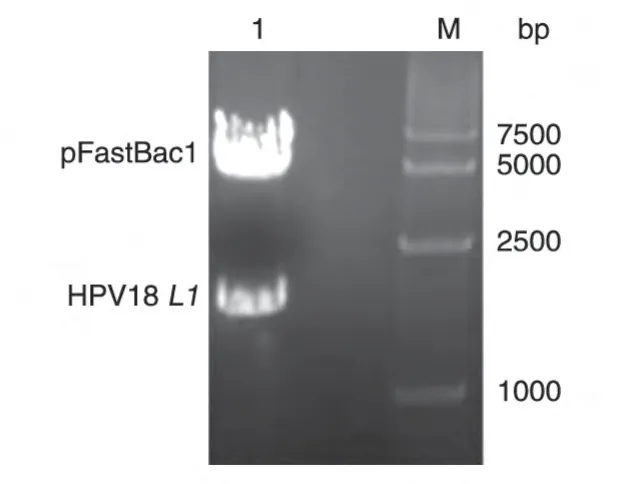
图2 EcoRⅠ和XbaⅠ双酶切pFB1-L1
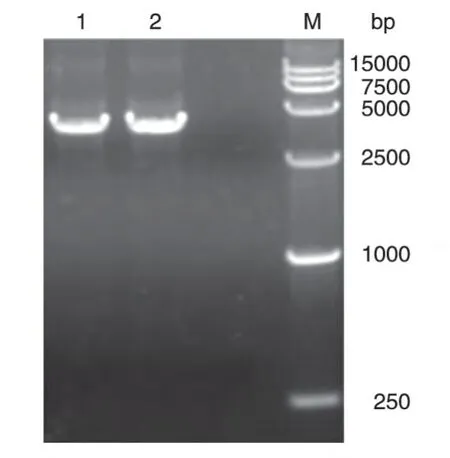
图3 重组穿梭质粒rBacmid-L1的PCR鉴定

图4 重组杆状病毒基因组中L1基因的PCR鉴定
2.5.2 间接免疫荧光法鉴定 间接免疫荧光结果显示,感染rBacmid-L1的Sf9细胞可见绿色荧光,而仅含脂质体的转染试剂转染的Sf9 细胞(阴性对照)无荧光(图5),表明重组杆状病毒的L1基因在Sf9昆虫细胞中获得表达。
2.5.3 Western 印迹鉴定 Western 印迹结果显示,rBacmid-L1感染的Sf9细胞的上清中无特异性条带,而细胞沉淀可与鼠抗L1 单克隆抗体发生特异性反应,在相对分子质量约60 000 处可见特异性条带,大小与L1蛋白相符,仅含脂质体的转染试剂转染的Sf9 细胞无特异性条带产生(图6)。表明L1基因已在rBacmid-L1感染的Sf9细胞中得到表达。
3 讨论
昆虫杆状病毒表达系统(baculovirus expression vector system,BEVS)是继大肠杆菌、酵母和哺乳动物细胞表达系统后建立的另一个高效表达系统。BEVS主要由转移载体、杆状病毒载体和昆虫细胞系三个部分组成。构建重组杆状病毒时,先将外源基因克隆至转移载体,构建成重组转移载体;然后重组转移载体和杆状病毒骨架共转染宿主细胞,将外源片段插入病毒基因组中;再通过特定的筛选标记和方法获得重组病毒,在昆虫细胞内复制,外源基因得以表达[4]。本研究中,我们将L1基因克隆至pFastBac1质粒中,重组质粒转化携带杆状病毒基因组的大肠杆菌感受态细胞DH10Bac,筛选转座后的阳性重组杆状病毒rBacmid-L1,转染Sf9细胞后获得携带L1基因的重组杆状病毒颗粒,经扩增后感染昆虫细胞,收获L1蛋白。结果表明,HPV18 L1蛋白在昆虫杆状病毒表达系统中获得成功表达。

图6 Western印迹检测L1蛋白的表达
HPV L1蛋白占病毒外壳主要组成的90%左右,是病毒诱导机体产生特异性中和抗体的主要刺激物,体外表达的L1 蛋白具有组装成病毒样颗粒(VLP)的能力[5]。目前上市的HPV疫苗均以L1蛋白为靶抗原。HPV16/18 型二价HPV 疫苗的L1 VLP通过啤酒酵母细胞产生,酵母表达系统表达外源蛋白水平高,但其糖基化修饰具有局限性。HPV L1蛋白亦可在大肠杆菌中表达,但其缺乏蛋白翻译后的糖基化等修饰加工过程,多数形成包涵体。HPV6/11/16/18 型四价HPV 疫苗的L1 VLP 利用昆虫细胞产生,昆虫细胞不仅培养条件与大肠杆菌及酵母细胞接近,而且细胞易破碎,表达外源蛋白的水平较高,可以进行蛋白翻译后的加工修饰。酵母细胞表达的L1 VLP 大小不一,而昆虫细胞表达的Ll VLP 颗粒相对均一,活性较好[6-7]。不同于HPV 二价疫苗使用的粉纹夜蛾Hi-5 昆虫细胞,本研究采用Sf9昆虫细胞,密码子优化后的HPV18L1基因在Sf9昆虫细胞实现了高水平表达。本研究中,我们以感染rBacmid-L1的Sf9细胞的病毒基因组为模板进行PCR鉴定,证明获得了重组杆状病毒rBacmid-L1;将感染rBacmid-L1 的Sf9 细胞行免疫荧光检测,可见特异性绿色荧光;Western 印迹鉴定在60 000 处可见特异性条带,并且仅在细胞沉淀中检测到L1 蛋白。因此,利用杆状病毒表达系统,我们成功表达了HPV18 L1 蛋白,对新型HPV 疫苗的研发具有现实意义。
[1]Rautava J,Syrjänen S.Human papillomavirus infections in the oral mucosa[J].Am Dent Asmc,2011,142(8):905-914.
[2]Hildesheim A,Hcrrero R,Wacholder S,et al.Effect of human papillomavirus 16/18 L1 virus like particle vaccine among young women with preexisting infection:a randomized trial[J].JAMA,2007,298(7):743-753.
[3]李卫国,王厚伟,牟志美,等.昆虫重组杆状病毒获得技术研究展望[J].山东农业大学学报,2003,34(1):134-138.
[4]于永利.昆虫杆状病毒表达载体系统与疫苗研制的30 年回顾[J].微生物学免疫学进展,2015,43(4):1-15.
[5]Janine T B.Developing an HPV vaccine to prevent cervical cancer and genital warts[J].Vaccine,2007,25(16):3001-3006.
[6]Parkin D M,Bray F.Chapter 2:the burden of HPV-related cancers[J].Vaccine,2006,24(S3):S11-S25.
[7]WHO/ICO Information Centre on HPV and Cervical Cancer.HPV and cervical cancer in the 2007 report[J].Vaccine,2007,25(S3):Cl-C230.
