miR-155 对人肝癌细胞系SK-HEP-1 及MHCC-97H 增殖与浸润能力的影响
2015-11-29傅春江毛廷森曾泉陈琳周军年贾雅丽岳文
傅春江 ,毛廷森,曾泉,陈琳,周军年,贾雅丽,岳文
1.房山区中医院,北京 102400;2.军事医学科学院 野战输血研究所,全军干细胞与再生医学重点研究室,北京 100850
小干扰RNA(miRNA)在肿瘤的发生发展中扮演的角色近年来成为肿瘤研究领域的热点,并取得一系列突破性进展。miRNA 被证明在机体的正常发育过程中,以及包括肿瘤在内的疾病发生发展中发挥重要作用[1-2]。研究表明,miRNA 参与干细胞的干性维持以及向成熟细胞的定向分化过程,对上皮间质转化过程具有调控作用,并通过不同的信号通路调控肿瘤细胞的增殖、凋亡、侵袭及转移,与肿瘤的发生、发展及预后密切相关[3-5]。值得关注的是,多种miRNA 被发现在肝癌中异常表达,并对肝癌细胞的生物学行为产生影响,从而在肝癌的发生发展中发挥重要作用。对这些miRNA 的深入研究,将有望为发现新的肝肿瘤标志物及新的诊疗靶标提供理论基础[6-7]。
原发性肝细胞癌(hepatocellular carcinoma,HCC)是我国最常见的恶性肿瘤之一,居我国癌症死亡原因第2 位,在全世界范围内为发病率最高的第五大恶性肿瘤,其死亡率在恶性肿瘤死亡顺位中居第3 位。肝细胞癌的发生发展是一个多步骤、多因素的复杂过程,涉及众多生长因子、癌基因和抑癌基因的异常表达或激活,乙肝病毒和丙肝病毒所导致的癌变,酒精所致的肝损伤等[8-10]。除此之外,近年越来越多的研究表明,肿瘤微环境在肝癌的演进过程中有不容忽视的重要作用[11-12]。肝癌微环境由多种基质细胞组成,包括间充质干细胞、肝星状细胞、内皮细胞、成纤维细胞、肌成纤维细胞、脂肪细胞、巨噬细胞、炎症细胞等,它们能够分泌大量的生长因子、细胞因子、基质金属降解酶等,参与肿瘤细胞的增殖、侵袭、转移及耐药[13-14]。我们的前期工作发现,肿瘤微环境中间质细胞呈激活状态并高表达EPM、S-100A4 等因子,继而引起肿瘤细胞系列基因表达的改变及生物学行为的改变[15]。我们系统地对间质细胞引起的MHCC-97H 等肝癌细胞中miRNA 表达的改变进行筛选与分析,发现肿瘤细胞的miR-155在间质细胞的刺激下明显表达上调。本实验中,我们通过在肝癌细胞系SK-HEP-1 及MHCC-97H 中过表达miR-155,研究其对肝肿瘤细胞增殖与浸润等生物学行为的影响。
1 材料与方法
1.1 材料
人肝癌细胞系SK-HEP-1 及MHCC-97H 由本室保存;pcDNA3.0-miR-155真核表达载体由军事医学科学院放射与辐射医学研究所郑晓飞教授馈赠;限制性内切酶、核酸分子量标记等购自宝生物公司;引物合成由上海英骏公司完成;反转录试剂盒及实时定量用SYBR Green 染料购自QIAGEN 公司;CCK8购自日本同仁株式会社;高糖培养基购自Gibco 公司;胎牛血清购自Hyclone 公司;TRIzol 及LipofectAMINE 2000试剂购自Invitrogen公司。
1.2 细胞培养与转染
将SK-HEP-1 及MHCC-97H 细胞接种于6 孔板中,用含10%胎牛血清的高糖培养基,于37℃、5%CO2条件下培养。采用LipofectAMINE 2000 转染细胞,每孔加入溶解于opti-MEM 的10 μL LipofectAMINE 2000 和4 μg pcDNA3.0-miR-155 质粒DNA,对照组加入与实验组等量的LipofectAMINE 2000和pcDNA3.0质粒DNA。转染第2 d换液,72 h后收获转染细胞用于miRNA的实时定量PCR检测。
1.3 实时定量PCR 检测miR-155 在细胞中的表达水平
用QIAGEN 公司的miScriptⅡRT 试剂盒进行RNA 反转录得到cDNA 后,采用SYBR Green 法实时定量PCR 检测,上游引物为5'-TTAATGCCTAATC GTGATAGGGGTC-3',下游引物为5'-GATTGAATC GAGCACCAGTTAC-3'。PCR 条件:95℃ 15 min;95℃15 s,55℃30 s,72℃30 s,40 个循环。以U6基因为内参,上游引物为5'-CGCTTCGGCAGCACA TATACTA-3',下游引物为5'-GATTGAATCGAGCA CCAGTTAC-3',PCR 条件同上。各组PCR 均进行3复孔重复。
1.4 CCK8法及克隆形成实验检测细胞增殖
将转染24 h 的细胞以每孔2×103/100 μL 的密度接种于96 孔板,培养24、72 和120 h 后分别进行CCK8 检测。加入10 μL CCK8,继续在37℃、5%CO2条件下培养4 h,检测D450nm值,每组均进行6 复孔重复。增殖倍数计算公式:每一次测定的吸光度值/第一次测定的吸光度值。
转染后将细胞以2×103/孔的密度接种于6孔板,37℃、5% CO2条件下培养,每3 d 换液,2 周后弃去培养液,PBS 洗3 次,加入0.1%结晶紫溶液(含10%福尔马林)固定20 min,弃去结晶紫溶液后用自来水柔和冲洗,自然干燥后照相保存。
1.5 Transwell实验检测细胞的浸润能力
-20℃保存的Matrigel于4℃过夜融化,用无血清培养基以1∶6 稀释Matrigel,充分混匀;取400 μL 稀释的Matrigel 加入Tanswell 板上室,37℃30 min 后Matrigel聚合成胶;细胞用PBS漂洗3次,用无血清培养基制备单细胞悬液,每个小室加入5×105细胞,置于6孔板中,48 h后观察照相并计数。
1.6 统计学分析
2 结果
2.1 pcDNA3.0-miR-155真核表达载体的鉴定
用限制性内切酶HindⅢ/XhoⅠ对pcDNA3.0-miR-155 质粒进行双酶切,酶切产物经琼脂糖凝胶电泳,在350 bp 及5.4 kb 左右出现条带,符合预期结果(图1);测序后与GenBank(NR_030784)序列比对一致。
2.2 miR-155 在SK-HEP-1 及MHCC-97H 肝癌细胞系中的表达
将SK-HEP-1 及MHCC-97H 肝癌细胞培养至密度为70%~80%(图2),细胞状态良好,呈长梭形(SK-HEP-1)或多边形(MHCC-97H)上皮样细胞状态。转染pcDNA3.0-miR-155 质粒72 h 后,对SKHEP-1 及MHCC-97H 细胞进行实时定量PCR,以检测miR-155的表达情况,以转染pcDNA3.0质粒为对照,结果显示阳性组比对照组表达水平高约424.8±48.5倍(SK-HEP-1,P<0.01)与63.69±7.8倍(MHCC-97H,P<0.01)(图3),这说明pcDNA3.0-miR-155 质粒能有效地高表达成熟的miR-155。
2.3 miR-155高表达对细胞增殖的影响
CCK8 法检测结果表明,pcDNA3.0-miR-155 质粒转染SK-HEP-1 及MHCC-97H 细胞24、72、120 h后,与转染pcDNA3.0 对照载体组相比,在72 h 后细胞增殖受到明显的促进,miR-155 质粒转染组SKHEP-1 与对照组在72 h 的增殖倍数分别为4.59±0.14 与3.04±0.15(P<0.01),miR-155 质粒转染组MHCC-97H 与对照组在72 h 的增值倍数分别为3.78±0.12 与3.35±0.38(P<0.01)(图4)。克隆形成实验是将单细胞悬液以较低的细胞密度接种于培养孔板中,经过相对较长时间的培养来考察单个细胞的增殖能力,miR-155 质粒转染组SK-HEP-1 与对照组在72 h 的克隆形成数目分别为410.00±11.36 与189.33 ± 12.66(P<0.01),miR-155 质粒转染组MHCC-97H 与对照组在72 h 的克隆形成数目分别为226.00±6.08与144.33±14.98(P<0.01)(图5),说明miR-155促进了肝癌细胞的增殖。
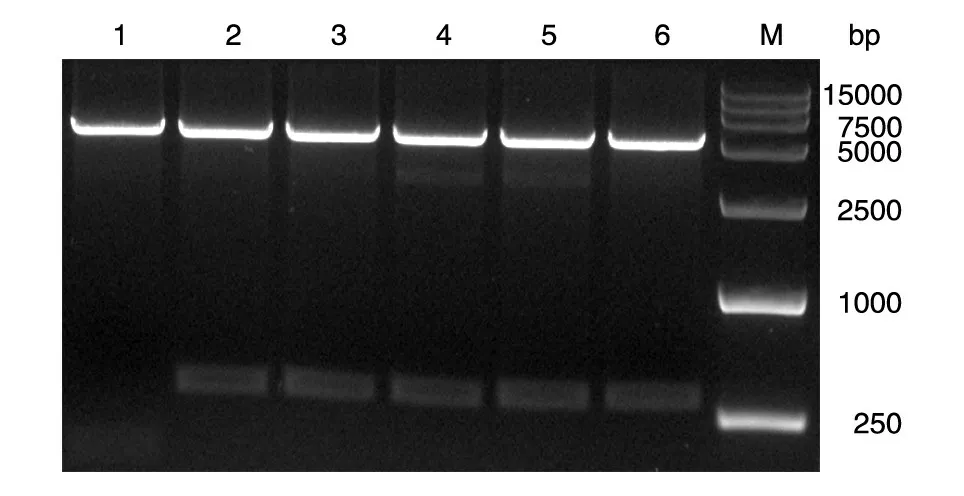
图1 pcDNA3.0-miR-155质粒的HindⅢ/XhoⅠ双酶切鉴定
2.4 miR-155高表达促进细胞的浸润能力
Transwell检测结果表明,pcDNA3.0-miR-155质粒转染组SK-HEP-1 与对照组浸润数目分别为143.00±9.36与76.00.33±10.67(P<0.01),二者差异具有显著意义(P<0.01)(图6)。
3 讨论
图2 SK-hep1(A)及MHCC-97H(B)肝癌细胞(×200)
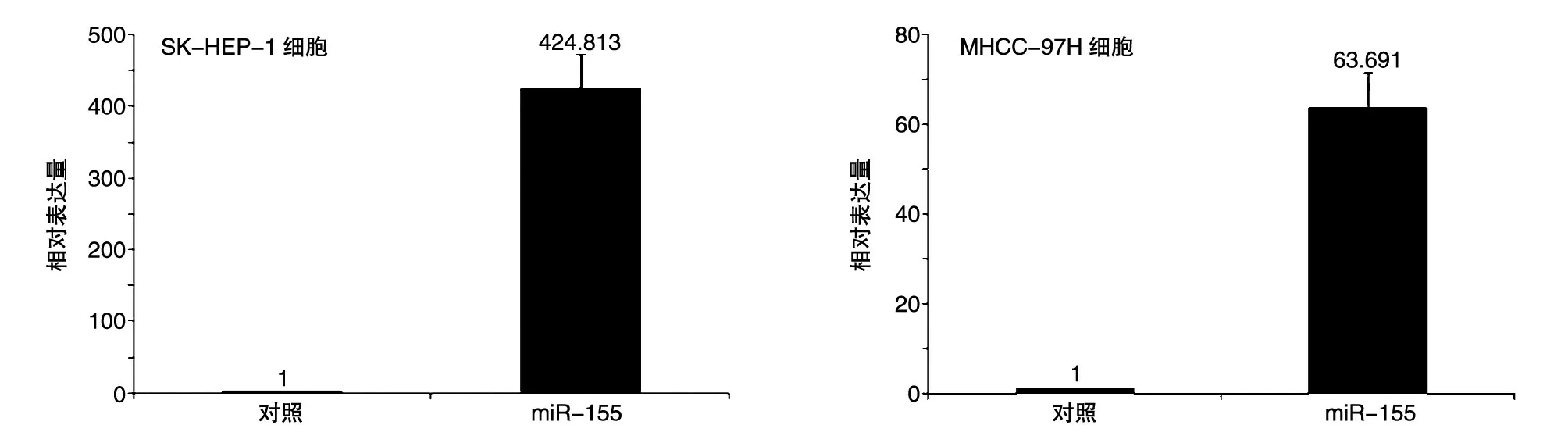
图3 实时定量PCR检测转染pcDNA3.0-miR-155后SK-hep1及MHCC-97H肝癌细胞中miR-155的表达
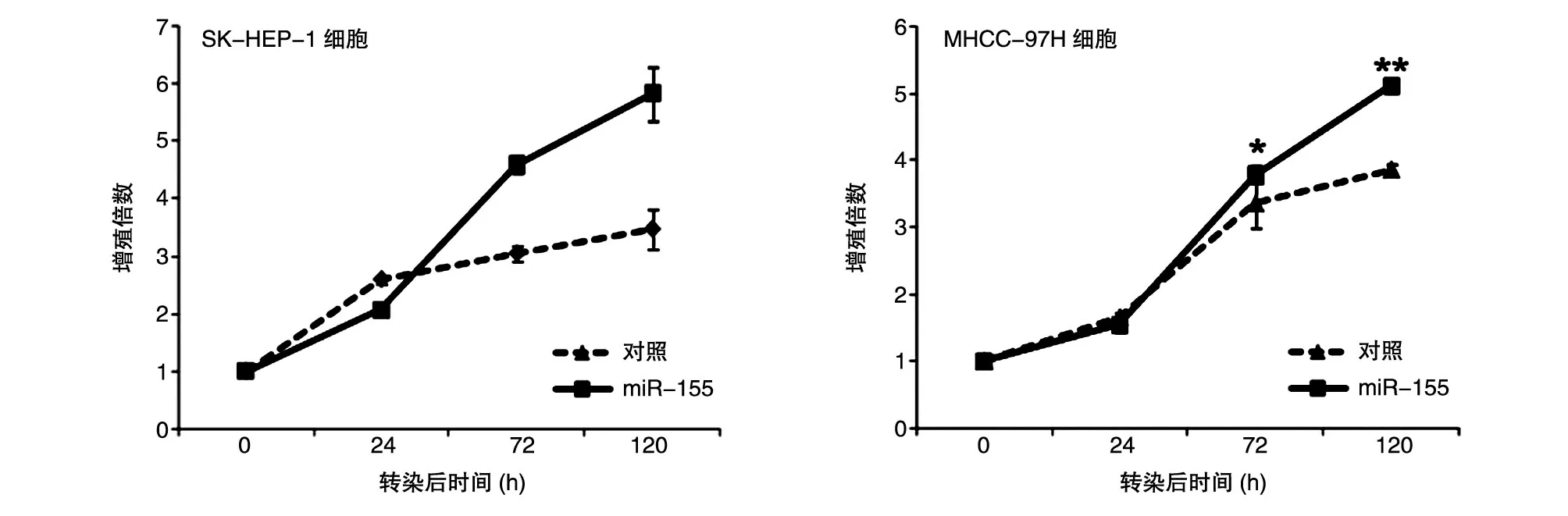
图4 miR-155促进SK-hep1及MHCC-97H肝癌细胞增殖
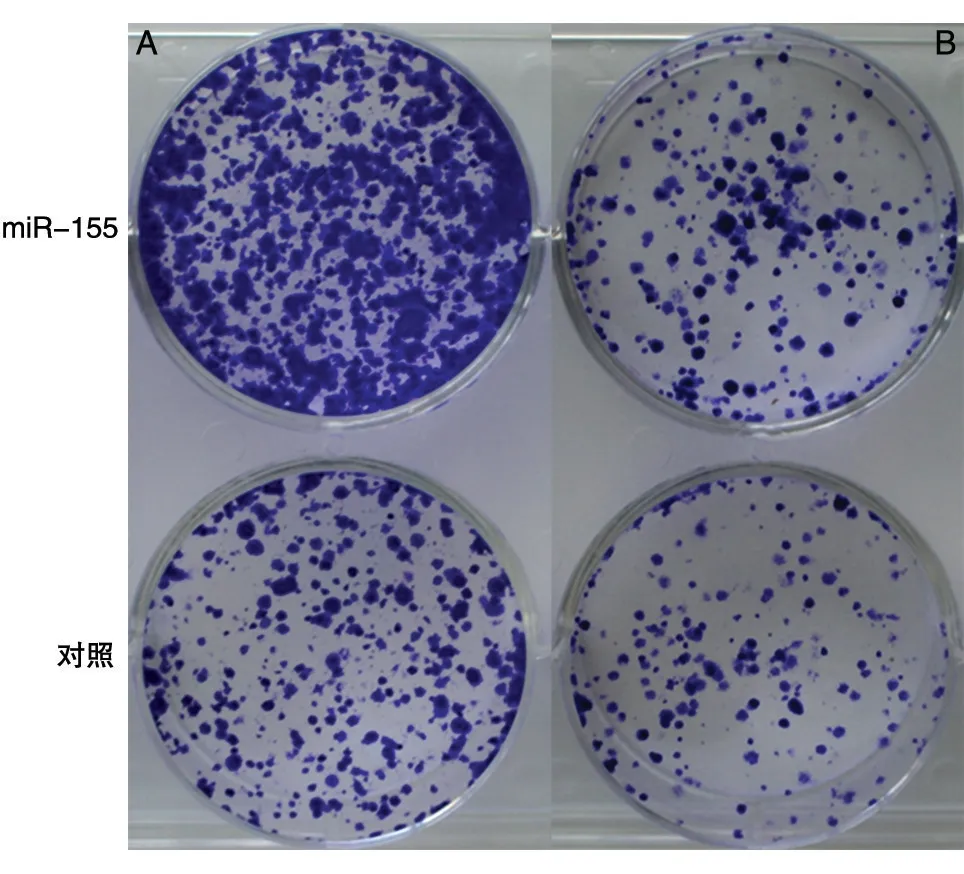
图5 克隆形成实验证明miR-155促进SK-HEP-1(A)及MHCC-97H(B)肝癌细胞增殖
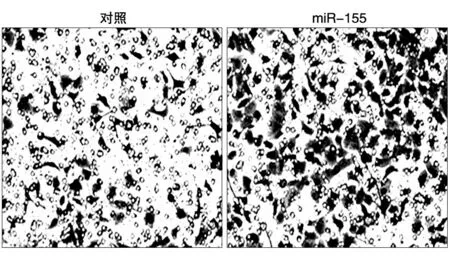
图6 侵袭实验证明miR-155促进SK-HEP-1细胞的浸润
越来越多的研究表明,除了肿瘤细胞本身发生的遗传学或表观遗传学的改变之外,肿瘤细胞所处的微环境也在肿瘤的发生发展中扮演至关重要的角色[10-11]。肿瘤微环境包括内皮细胞、间充质干细胞、成纤维细胞、炎症细胞及脂肪细胞等。我们课题组曾经系统研究肝肿瘤微环境对肝癌发生与发展的影响并取得一定的进展,发现了肝癌微环境中的肝星状细胞及间充质干细胞等在肿瘤细胞的影响下呈现明显激活状态,高表达EPM 及S100-A4 等因子,进而对肿瘤细胞的生物学行为产生明显影响:促进肿瘤的增殖,明显增加了肿瘤细胞的浸润能力,在肿瘤微环境激活细胞的刺激下,肿瘤细胞肝内转移甚至肺转移的能力增加[15]。进一步弄清肿瘤微环境中的这些因子的分子调控机制,将有望为明确肿瘤发生发展的病理机制,以及发现新的肿瘤诊疗靶标提供线索。
在前期工作中,我们发现在肝肿瘤微环境的刺激下,肝肿瘤细胞的生物学行为发生了改变,包括细胞的增殖、浸润与转移能力的提高等。此外,我们的研究也发现肿瘤细胞内的miRNA 表达谱发生了变化,包括miR-155、miR-301、miR-222、miR-107 等在内的miRNA 的表达明显上调,其中miR-155 表达的改变最为显著。miR-155 是一个典型的多功能基因,目前已被报道参与多种生理与病理过程,如炎症反应、肿瘤的发生发展等。在急性髓细胞样白血病中,miR-155 的表达明显升高;此外,在多种实体瘤中,包括甲状腺癌、乳腺癌、结肠癌及宫颈癌等,miR-155 的表达显著上升,并可能与患者的病理分级及预后有一定的相关性,但其对肿瘤细胞的生物学作用及分子调控机制仍须进一步明确[16-17]。
为了进一步揭示肝肿瘤微环境是否通过miR-155 发挥其对肿瘤细胞生物学行为的影响,我们通过pcDNA3.0-miR-155载体在SK-HEP-1及MHCC-97H 肝癌细胞中高表达miR-155,并研究miR-155对肿瘤细胞增殖及浸润能力的影响。研究结果证实,miR-155 发挥了与肿瘤微环境中的间质细胞类似的生物学作用,可以促进肿瘤细胞的增殖与浸润能力,提示miR-155参与了肿瘤微环境,有促进肿瘤的发生与发展的过程。这有助于我们进一步明确肝肿瘤微环境作用的病理机制,而miR-155 在肝癌细胞中的高表达并对肿瘤细胞生物学行为造成影响,为临床上肝癌的分子诊断及治疗提供了新思路与新靶点。
[1]Boissart C,Nissan X,Giraud-Triboult K,et al.miR-125 potentiates early neural specification of human embryonic stem cells[J].Development,2012,139(7):1247-1257.
[2]Gregory P A,Bracken C P,Bert A G,et al.microRNAs as regulators of epithelial-mesenchymal transition[J].Cell Cycle,2008,7(20):3112-3118.
[3]Calin G A,Croce C M.microRNA signatures in human cancers[J].Nat Rev Cancer,2006,6(11):857-866.
[4]Eulalio A,Huntzinger E,Nishihara T,et al.Deadenylation is a widespread effect of miRNA regulation[J].RNA,2009,15(1):21-32.
[5]Cortez M A,Bueso-Ramos C,Ferdin J,et al.microRNAs in body fluids--the mix of hormones and biomarkers[J].Nat Rev Clin Oncol,2011,8(8):467-477.
[6]Braconi C,Henry J C,Kogure T,et al.The role of miRNAs in human liver cancers[J].Semin Oncol,2011,38:752-763.
[7]Cairo S,Wang Y,de Reyniès A,et al.Stem cell-like micro-RNA signature driven by Myc in aggressive liver cancer[J].Proc Natl Acad Sci USA,2010,107(47):20471-20476.
[8]El-Serag H B.Hepatocellular carcinoma[J].N Engl J Med,2011,365:1118-1127.
[9]El-Serag H B.Epidemiology of viral hepatitis and hepatocellular carcinoma[J].Gastroenterology,2012,142(6):1264-1273.
[10]Fiorentino M,Altimari A,Ravaioli M,et al.Predictive value of biological markers for hepatocellular carcinoma patients treated with orthotopic liver transplantation[J].Clin Cancer Res,2004,10:1789-1795.
[11]Adjei I M,Blanka S.Modulation of the tumor microenvironment for cancer treatment:a biomaterials approach[J].J Funct Biomater,2015,6(1):81-103.
[12]Van der Jeught K,Bialkowski L,Daszkiewicz L,et al.Targeting the tumor microenvironment to enhance antitumor immune responses[J].Oncotarget,2015,6(3):1359-1381.
[13]Yang P,Markowitz G J,Wang X F.The hepatitis B virus-associated tumor microenvironment in hepatocellular carcinoma[J].Natl Sci Rev,2014,1(3):396-412.
[14]Giannelli G,Rani B,Dituri F,et al.Moving towards personalised therapy in patients with hepatocellular carcinoma:the role of the microenvironment[J].Gut,2014,63(10):1668-1676.
[15]Jia Y L,Shi L,Zhou J N,et al.Epimorphin promotes hu-man hepatocellular carcinoma invasion and metastasis through activation of focal adhesion kinase/extracellular signal-regulated kinase/matrix metalloproteinase-9 axis[J].Hepatology,2011,54(5):1808-1818.
[16]Chen W,Han C,Zhang J,et al.Deletion of mir155 prevents Fas-induced liver injury through up-regulation of Mcl-1[J].Am J Pathol,2015,185(4):1033-1044.
[17]Liu F,Kong X,Lv L,et al.miR-155 targets TP53INP1 to regulate liver cancer stem cell acquisition and self-renewal[J].FEBS Lett,2015,589(4):500-506.
