丁香酚对大西洋鲑麻醉效果的实验研究*
2015-11-28刘宝良王顺奎于凯松
李 靖,刘宝良,2,王顺奎,于凯松,刘 鹰*
(1.中国科学院 海洋研究所,山东 青岛266071;2.中国水产科学研究院 黄海水产研究所,山东 青岛266071;3.山东东方海洋科技股份有限公司,山东 烟台264051)
大西洋鲑(Salmosalar)属鲑科,鲑属,中文俗称“三文鱼”,英文俗称“Atlantic salmon”[1]。大西洋鲑是一种营养价值及经济价值均很高的鱼类,它的存活和生长对水质要求很高,且生性活泼,对多种理化刺激应激反应强烈,导致其在分选和运输过程容易受到损害。尤其是活鱼运输过程中密度大、时间较长、水质易变坏、鱼体容易受伤等原因,会严重影响运输过程中的成活率,降低经济效益。将麻醉剂应用在活鱼运输中是一种目前较为常用的方法,该方法不仅可以降低运输过程中鱼类的耗氧率和氨氮排泄率,防止水质变坏,而且可以抑制鱼类的过度活动,从而有效防止鱼类在运输容器内因碰撞而造成的伤亡,大大提高运输的成活率,提高经济效益[2]等。
鱼用麻醉剂是一类能不同程度抑制鱼脑感觉中枢,使其失去反射动作的物质,其作用原理为:首先抑制脑的皮质(触觉丧失期),再作用于基底神经节与小脑(兴奋期),最后作用于脊髓(麻醉期)[3]。丁香酚(Eugenol)是一种成本低廉、效果明显、在近年受较多关注的鱼类麻醉剂[4]。丁香酚即4-烯丙基-2-甲氧基苯酚,又称子丁香酚,广泛存在于丁香酚、肉桂叶油、樟脑油等芳香油中[5]。近年来,丁香酚被广泛应用于金鱼(Carassiusauratus)[6]、鲤鱼(Cyprinuscarpio)[7]、虹鳟(Salmogairdneri)[8]和大黄鱼(Pseudosciaenacrocea)[9]等鱼类的亲鱼采卵、活鱼运输过程中。目前已有报道使用丁香酚麻醉塞内加尔鳎[10]、虹鳟(Oncorhynchusmykis)[8,11]、河鲀(Siganuslineatus)[12]、黄尾雀鲷(Pomacentrusamboinensis)[13]等的研究。迄今为止,有关丁香酚对大西洋鲑的麻醉效果研究报道相对较少。
1 材料与方法
1.1 实验材料
丁香酚(上海润捷化学试剂有限公司生产),密度(25℃)为1.036~1.050g/mL,表观为浅黄色挥发性稀薄液体。均在实验当天将试验中所用丁香酚与无水乙醇(V丁香酚∶V无水乙醇=1∶9)混合乳化备用。实验用大西洋鲑来自山东东方海洋三文鱼养殖基地,该基地养殖的大西洋鲑鱼卵进口自挪威,不同规格鱼的饲喂时间为6~24个月不等。挑选体健无伤、规格适当的个体作为实验对象,选择的个体体长为15~50cm,体重为80~1 500g。
1.2 实验条件
根据实验用鱼的规格和不同实验要求,在120cm×60cm×60cm的玻璃缸或最大容积为80L的泡沫箱内进行麻醉和复苏试验。实验时使用气泵鼓气维持水体中溶氧在8mg/L以上。实验用水为深井海水,pH为7.9~8.1,盐度约为35。
1.3 实验设计
本研究以Summerfelt等[14]描述的麻醉和恢复阶段作为标准(表1)。未提及温度的实验均采用养殖水温(14 ℃)。

表1 麻醉表现及程度分期[14]Table 1 Behaviors and stages of anaesthesia induction[14]
1.3.1 浸浴10min麻醉浓度和半致死浓度(LC50)的研究
试验中根据大西洋鲑的体长、体重,划分出不同的规格,并据此选取大小不等的泡沫箱或玻璃缸进行实验。
1)麻醉浓度:根据预实验得到的结果,实验前5min配制6,7,8,9,10,11和12mg/L丁香酚溶液;取不同规格大西洋鲑各10尾,分别置于不同质量浓度梯度丁香酚溶液中;浸浴10min,记录最后状态并转移至充分曝气的纯净海水中进行恢复,所有实验均设置一组重复;计算麻醉率。
2)半数致死浓度(LC50):使用孙氏改进寇氏法[15]进行计算。根据该方法对待测药物浓度梯度的要求,实验前5min配制41,50,55,60,66,73mg/L丁香酚溶液;取不同规格大西洋鲑各10尾分别置于不同质量浓度梯度丁香酚溶液中,每一规格每一质量浓度设置一组平行;浸浴10min,转移至充分曝气的纯净海水中进行恢复;计算死亡率。
1.3.2 最佳麻醉条件的研究
本文采用正交试验设计,I(丁香酚质量浓度)、II(浸浴时间)、III(温度)、IV(体质量)分别代表4个因素(表2),按照不同的水平组合,分为24个实验组(表2,表4),每组设置6尾体重相近的大西洋鲑。实验中记录不同麻醉条件下大西洋鲑的最终状态,以及转入正常海水中后所需要的恢复时间。

表2 丁香酚麻醉大西洋鲑试验因素Table 2 Factors in eugenol anesthesia experiments on Salmo salar
2 结果与分析
2.1 浸浴10min麻醉浓度和半致死浓度(LC50)
2.1.1 麻醉浓度
实验表明(图1),不同规格的大西洋鲑对丁香酚的耐受能力有所不同,均重99g的大西洋鲑80%以上达到完全失去平衡状态的丁香酚质量浓度为11mg/L,均重159g的大西洋鲑80%以上达到完全失去平衡状态的丁香酚质量浓度为10mg/L,均重375g的大西洋鲑80%以上达到完全失去平衡状态的丁香酚质量浓度及以上为9mg/L。由图1可知,低于400g的大西洋鲑对相同质量浓度的丁香酚耐受能力随体重呈现出递减的趋势,而体重高于400g的大西洋鲑对丁香酚的耐受能力趋于稳定。
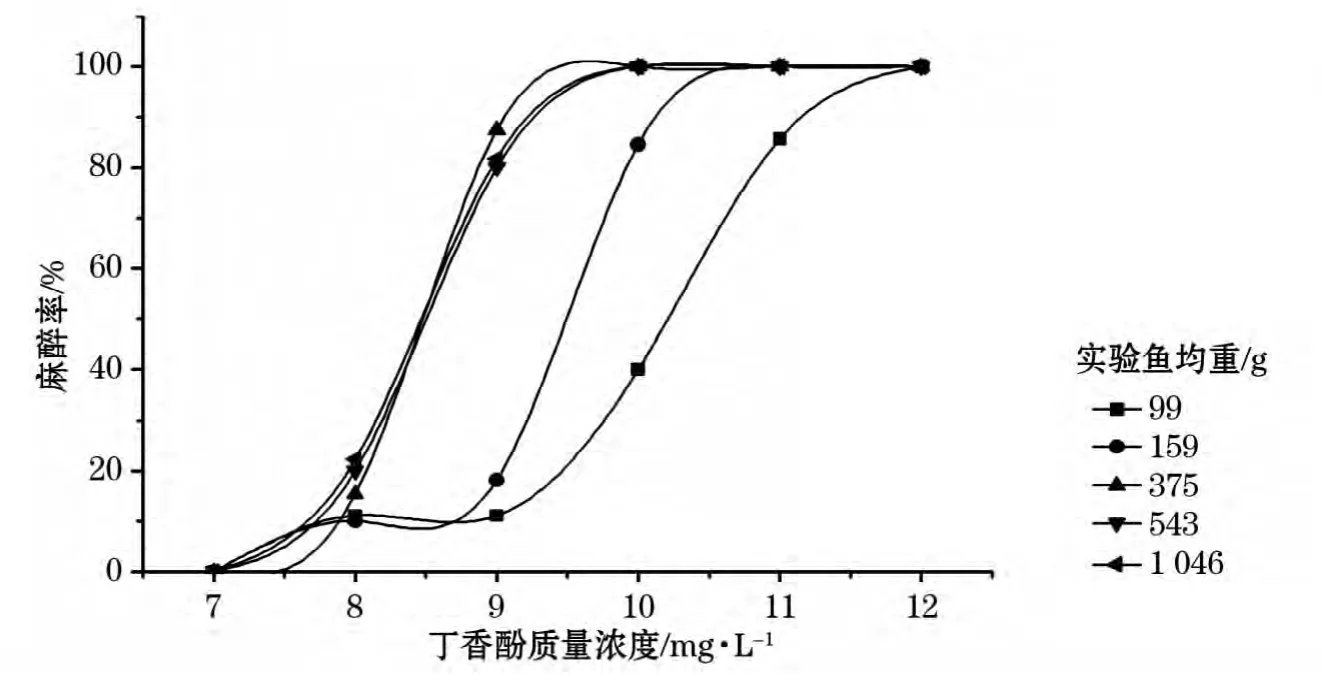
图1 浸浴10min下大西洋鲑的麻醉率Fig.1 Anaesthesia rate of atlanitc salmon under 10min bath
2.1.2 半致死浓度(LC50)
实际生产过程中,无论是分级转运还是长途运输,一般采用的方法为常温麻醉,且要求把浸浴时间控制在可以接受的时间范围内,10min左右或者更少为宜。因此本研究首先测定了大西洋鲑在14~15℃下10 min浸浴的半致死浓度,大西洋鲑的死亡率和最短恢复时间随丁香酚质量浓度的提高有明显的上升(表3)。由表3可知,对于均重为549g的大西洋鲑,在丁香酚质量浓度50mg/L条件下浸浴10min,其死亡率为0,最短恢复时间为11min 40s;在55mg/L条件下浸浴10min,其死亡率为20%,最短恢复时间为13min 10 s;在60mg/L条件下浸浴10min,其死亡率为60%,最短恢复时间为15min 30s;在66mg/L条件下浸浴10min,其死亡率为90%,最短恢复时间为17min 57s。根据孙氏改进寇氏法,计算得到LC50的95%置信区间为(56.5,61.6)mg/L。

表3 10min浸浴下死亡率及最短恢复时间Table 3 Mortality rate and shortest recovery time under 10min bath
2.2 最佳麻醉条件
大西洋鲑生性活泼好动,在进行分选和运输的过程中往往需要通过麻醉来避免其剧烈运动引起的伤害,以提高生产活动的经济效益。而不同的麻醉条件下,大西洋鲑所达到的麻醉状态和恢复到正常状态所需要的时间各不相同,过度麻醉甚至会出现鱼类死亡的现象。生产实践中需要大西洋鲑保持在适当的麻醉状态(表1中4或5)10~20min以完成分选、转运、手术等操作过程。本研究通过一组多因素多水平的正交试验确定了达到这一目标的麻醉条件。
表4中记录了终状态、最短恢复时间、平均恢复时间、最长恢复时间四个实验指标,因90%处理中实验鱼都达到了理想的大于4的终状态并且未发生死亡,所以只选取最具代表性的平均恢复时间进行分析。极差分析结果见表4。比较本实验的I,II,III,IV四个因素中Rj值大小,I因素(即丁香酚质量浓度)为最重要的因素,然后依次为II因素(即浸浴时间),III因素(即温度),而IV因素(即鱼体重量)对实验指标值的影响并不显著。方差分析的结果见表5,由方差分析可知I,II因素对大西洋鲑麻醉后恢复正常游动的时间有极显著的影响。
I因素多重比较分析结果见表6。由表6可见,在α=0.05水平下,I5与I6,I3与I4均数间差异不显著,其余均数间差异显著。以I5为最好,I6虽与I5间均数差异不显著,但是I6的因素水平已经超过了大西洋鲑的致死浓度,所以,从恢复时间和安全两方面来讲,I的最优水平为I5,即丁香酚质量浓度为50mg/L。II因素多重比较分析结果见表7。由表7多重比较的结果来看,在α=0.05水平下,II4与II3,II3与II2均数间差异不显著,其余均数间差异显著。理论上讲可取II2水平之上任意水平,实践中可以从成本经济性、实验条件的可行性、操作安全性等方面综合考虑来确定。生产实际中或可取较短浸浴时间,以较高的丁香酚质量浓度来弥补时间这一因素造成的持续麻醉状态时间的损失。
最后综合平衡结果,最优组合为I5II4III2,即最佳麻醉条件为丁香酚质量浓度50mg/L,浸浴时间12 min,温度14℃。

表4 实验条件、结果及实验结果的极差分析Table 4 Experimental conditions,results and range analysis

续表

表5 实验因素方差分析Table 5 Variance analysis of experimental factors
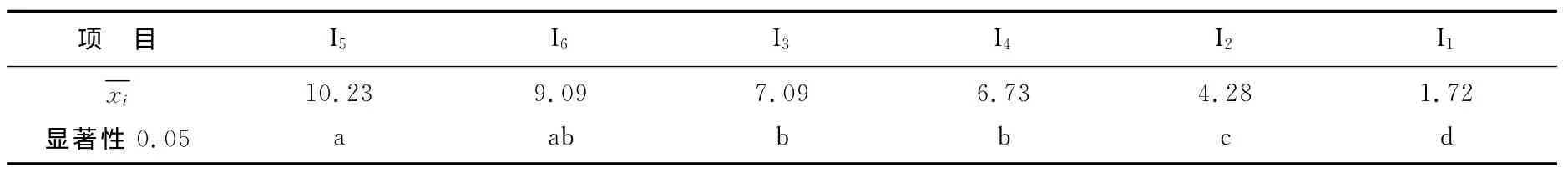
表6 I因素(丁香酚质量浓度)各水平平均值多重比较Table 6 Multiple comparison for factor I(mass concentration of eugenol)
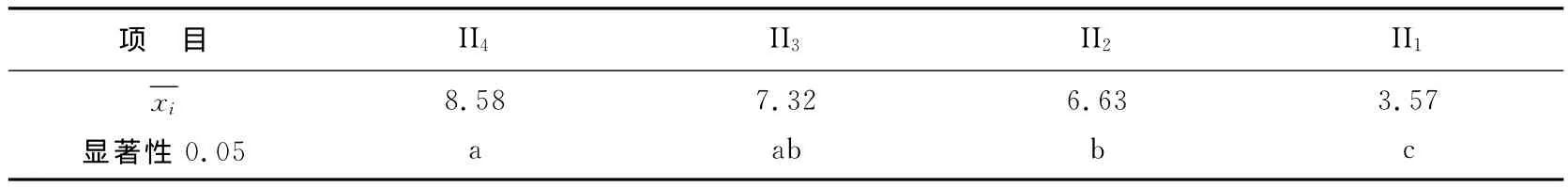
表7 II因素(浸浴时间)各水平平均值多重比较Table 7 Multiple comparison for factor II(bath time)
3 讨论
3.1 鱼体规格对麻醉效果的影响
巴西学者使用体长为6,10,14,18cm不等的尼罗罗非鱼(Oreochromisniloticus)进行苯唑卡因麻醉试验,发现体长方面的差异对进入麻醉所需的浸浴时间和恢复时间的影响并不显著[16]。使用丁香酚作为麻醉剂时,较大规格的白鱼(Coregonuslavaretus)相对于较小规格的个体,诱导至麻醉状态所需要的浸浴时间更短,虹鳟却恰恰相反;而不同规格的褐鳟鱼(Salmotrutta)和大西洋鲑(Salmosalar)浸浴时间和麻醉后恢复时间上并没有差异[17]。更早的报道也认为鱼体规格对于诱导至麻醉所需要的浸浴时间及恢复时间并没有明确的单向性影响[18-21]。在确定最优化麻醉条件的实验中,极差分析的结果显示,IV因素(即鱼体重量)对实验指标值的影响并不显著,这与上述的引证相一致。在探究不同规格的大西洋鲑10min浸浴下进入麻醉所需要的最低质量浓度时,发现对于体重在400g以下的大西洋鲑,规格更小的个体对丁香酚的耐受力较强。Houston等[22]假设使鱼类达到麻醉状态需要一个麻醉剂“绝对”摄入量,“绝对”摄入量仅在不同的鱼种之间存在差异。而麻醉剂的摄入主要通过鳃部的水交换完成,规格较大的鱼体具有更快的水交换速度,因此更易积累至“绝对”摄入量,对麻醉剂的耐受性较差。而对于体重高于400g的大西洋鲑,鱼体规格对麻醉效果造成的影响并不显著。
3.2 浸浴时间、麻醉剂浓度和温度对麻醉效果的影响
提高麻醉剂浓度和延长浸浴时间,能够延长受试鱼的恢复时间已是许多学者[16,23-25]的共识。表4和图2表明,随着丁香酚质量浓度的提高和浸浴时间的延长,大西洋鲑恢复至正常游动状态的时间明显延长。在40mg/L下,14号I4II2III2IV1,即丁香酚质量浓度40mg/L、浸浴时间6min、温度14℃、均重500g,以及15号I4II3III1IV1,即丁香酚质量浓度40mg/L、浸浴时间9min、温度8℃、均重500g两个处理的平均恢复时间分别为7min 54s和7min 18s,与延长浸浴时间能够导致恢复时间延长的趋势相悖,是由于丁香酚质量浓度和浸浴时间与温度的互作效应导致了麻醉时间的显著下降。在实验中观测到较低温度下,大西洋鲑鳃动频率下降的现象;另外,Cooke等[26]的研究表明大嘴鲈(Largemouth bass)、白鲈(Whitebass)和黑斑太阳鱼(Black crappie)三种鱼类在3℃下的心脏指数(心输出量、心率、每搏输出量)均低于其在常温下的水平。推测在较长的浸浴时间(9~12min)下,低温的刺激降低了大西洋鲑的反应能力、鳃动频率及心输出量,进而降低了实验鱼血液与外界环境的物质交换速率,即相比常温处理下的实验用鱼,低温环境降低了血液中的有效丁香酚质量浓度,从而使15号处理实验鱼呈现出较短的恢复时间。
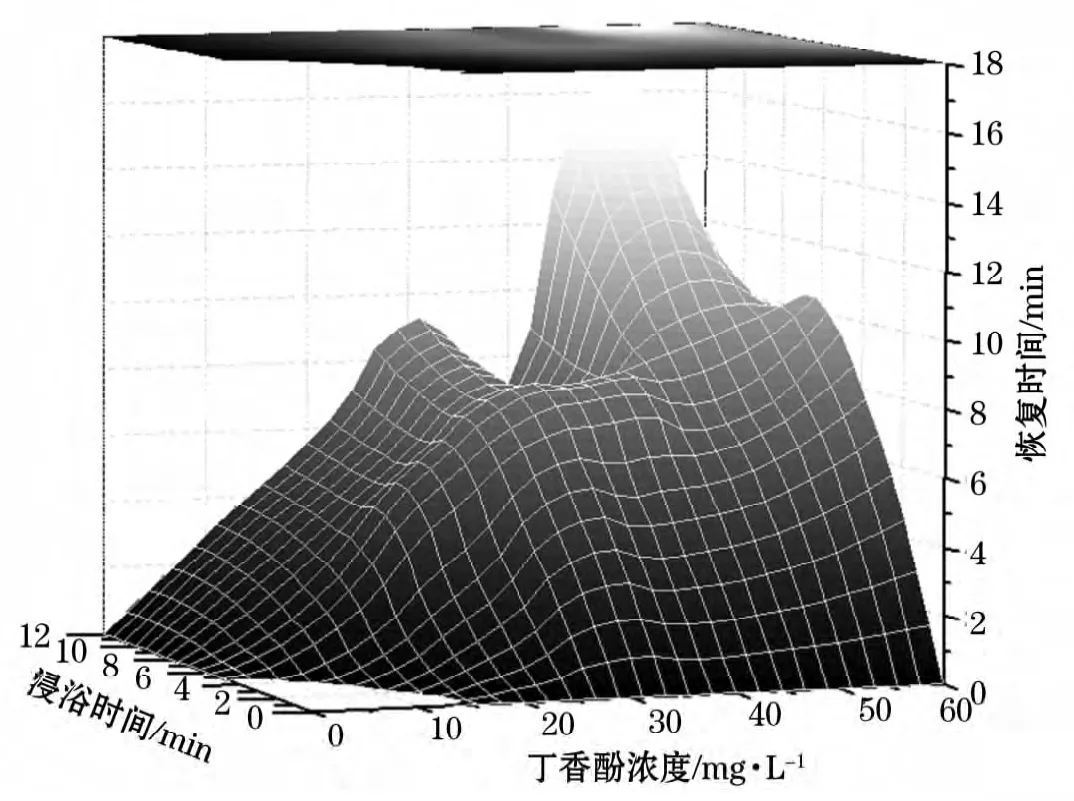
图2 恢复时间随丁香酚质量浓度和浸浴时间的变化Fig.2 Recovery time under different eugenol concentration and bath time
在50mg/L下,17号I5II1III1IV1,即丁香酚质量浓度50mg/L、浸浴时间3min、温度8℃、均重500g,以及18号I5II2III1IV2,即丁香酚质量浓度50mg/L、浸浴时间6min、温度8℃、均重1 000g两个低温处理的平均恢复时间分别为4min 52s和8min 02s,符合浸浴时间与恢复时间之间的正相关关系。说明在较短的浸浴时间(3~6min)内,鱼体并未适应低温环境,因此鳃动频率和心率也没有显著降低,实验鱼血液与外界环境的物质交换速率也未受到影响,相比常温处理下的实验鱼,低温环境并未影响实验血液中的有效丁香酚质量浓度,从而18号处理实验鱼恢复正常游动的时间也未受到明显影响。
由于时间和资源的限制,本实验选取的温度梯度过少,为了更好地阐明水体温度对不同麻醉剂麻醉效果的影响以及各因素之间的互作效应,还需要在将来补充更加完善的实验。
致谢:宋秀贤研究员对文章撰写和修改等方面给出宝贵建议,山东东方海洋有限公司提供实验条件和材料。
(References):
[1]XIA Z Z,CHEN J P,MU Z B.Ecological information of the Atlantic salmon[J].Chinese Jounal of Fisheries,1998,11(2):61-65.夏重志,陈金平,牟振波.大西洋鲑的生态学资料[J].水产学杂志,1998,11(2):61-65.
[2]AN L N,ZAI J.Fish aesthesia and the method[J].Scientific Fish Farming,2008,(6):52-54.安丽娜,在杰.鱼类麻醉及其方法[J].科学养鱼,2008,(6):52-54.
[3]LI S F.Fish anesthetic[J].Freshwater Fisheries,1988,1:22-23.李思发.鱼类麻醉剂[J].淡水渔业,1988,1:22-23.
[4]LIU S F,CAI X.Research progress of fish anesthetic[J].Heilongjiang Fisheries,2008,6:40-43.刘双凤,蔡勋.鱼用麻醉剂的研究进展[J].黑龙江水产,2008,6:40-43.
[5]LIU C L,HE L,CHEN S Q,et al.A review of fish anesthetic[J].Fishery Modernization,2007,34(5):21-25.刘长琳,何力,陈四清,等.鱼类麻醉研究综述[J].渔业现代化,2007,34(5):21-25.
[6]ENDO T,OHSHIMA S,OGISHIMA K,et al.Studies on anesthetic effect of eugenol in some fresh water fishes[J].Bulletin of the Japanese Society of Scientific Fisheries,1972,38(7):761-767.
[7]HIKASA Y,TAKASE K,OGASAWARA T,et al.Anesthesia and recovery with tricaine methanesulfonate,eugenol and thiopental sodium in the carp,Cyprinus carpio[J].The Japanese Journal of Veterinary Science,1986,48(2):341.
[8]KEENE J,NOAKES D,MOCCIA R,et al.The efficacy of clove oil as an anaesthetic for rainbow trout,Oncorhynchus mykiss(Walbaum)[J].Aquaculture Research,1998,29(2):89-101.
[9]CHANSEAU M,BOSC S,GALIAY E,et al.The use of clove oil as an anesthetic for Atlantic salmon smolts(Salmo salar L.)and comparison of its effects with those of 2-phenoxyethanol[J].Bulletin Francais de la Peche et de la Pisciculture,2002,(365-366):579-589.
[10]WEBER R,PELETEIRO J,MART N L,et al.The efficacy of 2-phenoxyethanol,metomidate,clove oil and MS-222as anaesthetic agents in the Senegalese sole[J].Aquaculture,2009,288(1):147-150.
[11]ANDERSON W G,MCKINLEY R S,COLAVECCHIA M.The use of clove oil as an anesthetic for rainbow trout and its effects on swimming performance[J].North American Journal of Fisheries Management,1997,17(2):301-307.
[12]SOTO C G,BURHANUDDIN.Clove oil as a fish anaesthetic for measuring length and weight of rabbitfish(Siganuslineatus)[J].Aquaculture,1995,136(1-2):149-152.
[13]MUNDAY P,WILSON S.Comparative efficacy of clove oil and other chemicals in anaesthetization ofPomacentrusamboinensis,a coral reef fish[J].Journal of Fish Biology,1997,51(5):931-938.
[14]SUMMERFELT R C,SMITH L S.Anesthesia,surgery,and related techniques[M]∥SCHREK C B,MOYLE P B.Methods for Fish Biology,Bethesda Maryland:American Fisheries Society,1990:213-272.
[15]GU B,ZHANG Z,LI Y P,et al.Summary of median lethal dose an its calculation methods[J].China Occupational Medicine,2009,36(6):507-508.顾兵,张政,李玉萍,等.半数致死量及其计算方法概述[J].中国职业医学,2009,36(6):507-508.
[16]OKAMURA D,DE ARAUJO F G,ROSA P V E,et al.Effect of benzocaine concentration and fish size on anesthesia and recovery inNiletilapia[J].Revista Brasileira De Zootecnia-Brazilian Journal of Animal Science,2010,39(5):971-976.
[17]HOSKONEN P,PIRHONEN J.The effect of clove oil sedation on oxygen consumption of six temperate-zone fish species[J].Aquaculture Research,2004,35(10):1002-1005.
[18]HOUSTON A H,MADDEN J A,WOODS R J,et al.Some physiological effects of handling and tricaine methane-sulphonate anestheti-zation upon the brook trout,Salvelinusfontinalis[J].Journal of the Fisheries Board of Canada,1971,28(5):625-633.
[19]AKHLAGI M,MIRAB BROJERDI M.Anaesthetic effect of clove tree and LC50determination in rainbow trout(Oncorhynchusmykiss)[J].Journal of the Faculty of Veterinary Medicine,1999,54:52-57.
[20]PRINCE A,POWELL C.Clove oil as an anesthetic for invasive field procedures on adult rainbow trout[J].North American Journal of Fisheries Management,2000,20(4):1029-1032.
[21]WALSH C T,PEASE B C.The use of clove oil as an anaesthetic for the longfinned eel,Anguilla reinhardtii(Steindachner)[J].Aquaculture Research,2002,33(8):627-635.
[22]HOUSTON A H,CORLETT J T,WOODS R J.Specimen weight and MS 222[J].Journal of the Fisheries Research Board of Canada,1976,33(6):1403-1407.
[23]ZHANG F L,LV S M.The anesthesia effect of eugenol on carp[J].Jiangxi Fishery Science and Technology,2007,(4),15-18.张富林,吕世明.丁香酚对鲤麻醉作用的研究[J].江西水产科技,2007,(4),15-18.
[24]ZHAO Y L,YANG X L,HUANG Y P,et al.The anesthesia effect of eugenol on Pseudosciaena crocea[J].Fisheries Science & Technology Information,2002,(4):163-165.赵艳丽,杨先乐,黄艳平,等.丁香酚对大黄鱼麻醉效果的研究[J].水产科技情报,2002,(4):163-165.
[25]WEBER R A,PELETEIRO J B,MARTIN L O G,et al.The efficacy of 2-phenoxyethanol,metomidate,clove oil and MS-222as anaesthetic agents in the Senegalese sole(SoleasenegalensisKaup1858)[J].Aquaculture,2009,288(1-2):147-150.
[26]COOKE S J,GRANT E C,SCHREER J F,et al.Low temperature cardiac response to exhaustive exercise in fish with different levels of winter quiescence[J].Comparative Biochemistry and Physiology-Part A:Molecular & Integrative Physiology,2003,134(1):157-165.
