早期发育浒苔对2株常见赤潮藻的化感效应*
2015-11-28周名江张清春林佳宁
刘 青,颜 天,周名江,张清春,林佳宁
(1.中国科学院 海洋研究所海洋生态与环境科学重点实验室,山东 青岛266071;2.中国科学院大学,北京100049)
自2007年我国黄海海域连续8a发生了大规模的浒苔(Ulvaprolifera)绿潮灾害。浒苔绿潮形成后,暴发生物量大,覆盖面积广,持续时间久,生态环境效应不容忽视。浒苔与微藻同处于海洋生态系统的初级生产者地位,生态位有一定的重叠,因此不可避免地产生相互竞争。目前普遍认为大型海藻对海域中微型浮游植物的影响是通过多种途径进行的。浒苔在风浪的影响下脱离固着基,漂浮在海面上,通过遮蔽阳光来影响微藻的生长;它们还能够快速地吸收营养盐,与微藻进行营养竞争[1-2];同时它们还能向环境中分泌抑藻物质,抑制微藻的生长,甚至可以防止赤潮的暴发性增殖[3-4]。已有研究表明,形成绿潮的大型海藻可通过化感机制影响海域的生物种类分布与生态格局,从而改变海洋生态系统的结构和演替顺序[5-7]。
针对我国黄海海域连年暴发的浒苔绿潮灾害的研究工作均表明,浒苔成熟藻体能通过化感作用来抑制微藻的生长,甚至致其死亡[8-11]。浒苔早期发育阶段的微观繁殖体是否具有同样的影响效应呢?微观繁殖体作为大型绿藻的早期形成产物,包括孢子、配子、合子这些无细胞壁保护的裸露单细胞及固着萌发后细胞结构较为简单的萌发幼体。在适宜的附着基和环境条件下,微观繁殖体会迅速萌发成藻丝体,这个萌发期是浒苔生长发育必经的重要阶段[12-14]。Song等[15]和Li等[16]分别在绿潮发生的不同时期,对黄海绿潮形成前后不同时空的浒苔微观繁殖体进行定量分析,发现微观繁殖体不仅是绿潮形成前的最初形式,也是绿潮规模扩增的途径之一。同时作为种子库为来年浒苔绿潮暴发提供了一定的物质基础,因此它们在整个绿潮发生发展过程中起到关键性的作用。然而关于这些微观繁殖体对微藻的影响研究目前还未见报道。
自2000年我国赤潮的发生频率和规模也呈现出急剧扩大的态势,并且有毒、有害的赤潮原因种也在不断增加。塔玛亚历山大藻可分泌藻毒素,属于一类危害较严重的有毒甲藻。近年来调查发现,由其引发的赤潮在我国南北各大海域均有发生。东海原甲藻是我国海域近年来常见的藻华原因种,因其引发的赤潮暴发规模大,持续时间长而引起了广泛关注[17-18]。因此,我们在实验室控制条件下探索了浒苔早期发育阶段(微观繁殖体萌发阶段)对这2株赤潮藻类的化感作用,以期丰富浒苔绿潮对海洋浮游植物潜在影响效应这一学科领域的理论研究,并对赤潮和绿潮有关方面的研究提供一定的理论资料。
1 材料和方法
1.1 微藻与浒苔的培养
实验所用微藻均来自中国科学院海洋研究所海洋生态实验室。塔玛亚历山大藻(Alexandriumtamarense)ATHK藻株于1995年分离自中国南海香港海域,由暨南大学提供;东海原甲藻(Prorocentrumdonghaiens)PDDH藻株于2004年分离自东海长江口海域,由国家海洋局第二海洋研究所提供。将上述微藻分别接种在500mL三角烧瓶中培养至指数生长期待用,培养液采用f/2营养盐配方,培养温度为(20±1)℃,光照4 000lx,光暗比为14∶10。实验海水取自青岛太平角的表层海水,经沙滤、沉淀,0.45μm混合纤维滤膜过滤后,再用高压灭菌锅灭菌(121℃,20min)。
浒苔(石莼属绿藻)于2011-07采自青岛汇泉湾。将采集的新鲜浒苔去除泥沙,再用灭菌海水漂洗3~4次,镜检确认无杂藻后,暂养于f/2培养液中,培养条件和所用海水均与微藻相同。
1.2 浒苔微观繁殖体的获得
选取浒苔配子主要是通过形态学观察(鞭毛数和个体大小)及趋光性检测来判断:配子大小约为6μm×3μm,呈长椭圆形,前端透明,后端为绿色的色素体,细胞内一般含有1个蛋白核,顶生2根鞭毛使其可以快速运动;在趋光性检测中呈现明显的正趋光。
利用切断的方法诱导浒苔释放配子。挑选单株浒苔配子体,将藻体切为1~2cm长的片段置于盛有200mL f/2培养液的三角烧瓶中,诱导2~3d,观察部分浒苔藻段变为黄色后,单独挑取黄色藻段放入培养皿中,直至浒苔释放配子。待培养皿中藻体释放完毕变为白色后,取出藻段,将2根鞭毛的配子收集。整个过程为防止配子固着,在尽量短的时间内完成操作。将收集的配子液摇匀,显微计数后,迅速进行实验。
1.3 实验方法
1.3.1 浒苔配子在萌发阶段对2株赤潮藻生长的影响
实验中对照组为各赤潮藻单培养组,实验组分别为浒苔配子与各赤潮藻共培养组,在盛有40mL培养液的小烧杯中进行。实验开始前1天,将新鲜释放的浒苔配子(2×104个/mL)接种到含f/2培养液的小烧杯中,避光培养以保证浒苔配子的随机固着。实验开始时恢复光照培养便于配子萌发,并加入微藻藻株,微藻的初始密度设置为0.1×104个/mL,每组包含3个重复。每日定时摇动小烧杯,防止微藻贴壁生长。每天取0.2mL培养液,用Lugol's试剂固定后,计数藻细胞密度,同时向小烧杯中加入0.2mL 10倍f/2培养液,以维持培养液体积恒定并避免营养限制。实验维持10d,在实验结束时计算微藻的生长抑制率I=(1-N/N0)×100%(N为共培养组中藻细胞密度;N0为单培养组中藻细胞密度)。
1.3.2 不同处理的浒苔在萌发阶段对2株赤潮藻生长的影响
1)不同密度的浒苔配子添加组对塔玛亚历山大藻生长的影响
实验同样采用浒苔配子和微藻共培养系统。浒苔的起始密度分别设为2×104,1×104,0.1×104和0.01×104个/mL,塔玛亚历山大藻的初始密度设置为0.1×104个/mL。实验开始前1天,分别将不同接种密度的浒苔配子避光培养以保证其随机固着。实验开始时恢复正常光照培养条件,并加入塔玛亚历山大藻藻株,实验组为浒苔配子与塔玛亚历山大藻共培养组,对照组为塔玛亚历山大藻单培养组,每组包含3个重复。每隔1d取0.2mL培养液用于计数,同时加入0.2mL 10倍f/2培养液,以维持培养液体积恒定并避免营养限制。实验维持20d,并分别在第10天和第20天计算微藻生长抑制率。
2)浒苔配子一次性培养滤液对塔玛亚历山大藻和东海原甲藻生长的影响
将初始接种密度为2×104个/mL的浒苔配子在小烧杯中培养10d,将培养液经灭菌的0.45μm混合纤维滤膜过滤,并用10倍f/2营养液加富,得到浒苔配子培养滤液。立即分别接种处于对数生长期的塔玛亚历山大藻和东海原甲藻,对照组为相同条件下培养于f/2加富海水中的塔玛亚历山大藻和东海原甲藻单培养组。微藻的初始密度都设置为0.1×104个/mL。实验维持20d,并分别在第10天和20天计算各微藻生长抑制率。
3)浒苔半连续培养滤液对塔玛亚历山大藻和东海原甲藻生长的影响
实验组分别为浒苔配子培养过滤液与赤潮微藻共培养组,将塔玛亚历山大藻和东海原甲藻接种在浒苔的培养过滤液中,浒苔配子培养过滤液获取同一次性培养滤液。每隔1d将小烧杯中的培养液移出4mL,然后添加4mL营养加富的新鲜浒苔配子培养滤液以保持培养液体积的恒定。对照组添加4mL f/2加富的灭菌海水,培养条件、营养水平、密度设置与共培养组一致。实验设置同一次性培养滤液。
4)高温处理的浒苔配子培养过滤液对塔玛亚历山大藻和东海原甲藻生长的影响
将培养浒苔配子的过滤液在高压灭菌锅中灭菌,冷却后分别接种塔玛亚历山大藻和东海原甲藻。对照组为相同条件下培养于f/2加富消毒海水中的塔玛亚历山大藻和东海原甲藻单培养组。实验设置同浒苔配子一次性培养滤液。
1.4 数据分析
实验所得数据均以平均值±标准误表示(n=3)。采用Excel做图,统计软件SPSS 16.0进行单因素方差分析(one-way ANOVA),并用Duncan进行多重比较检验和差异显著性分析,P<0.05被认为是差异显著。
2 结果与分析
2.1 浒苔配子萌发阶段对2株赤潮微藻生长的影响
在与浒苔配子共培养情况下,2株赤潮微藻的生长均受到了一定的影响(图1)。实验组中微藻的生物量水平全部低于对照组的,即浒苔配子添加对2株微藻的生长均表现出抑制作用,在第10天对塔玛亚历山大藻和东海原甲藻的生长抑制率分别达到了28%和39%,与对照组达到了显著性差异(P<0.05)。
2.2 不同初始密度的浒苔配子对塔玛亚历山大藻生长的影响
共培养条件下不同初始密度下的浒苔配子对塔玛亚历山大藻的生长均表现出一定的影响,并随着浒苔接种密度的增大,其对塔玛亚历山大藻生长的抑制作用越加明显(图2)。与对照组相比,其中2×104个/mL浒苔配子添加组,塔玛亚历山大藻藻细胞指数期增长较为缓慢,然后迅速进入衰亡期,在实验进行至第22天即完全死亡,所能达到的最高细胞密度仅为对照组的47%;1×104个/mL浒苔配子添加组,塔玛亚历山大藻的生命周期也短于对照组,所能达到的最高细胞密度仅为对照组的65%;0.1×104个/mL浒苔配子添加组的抑藻效果稍弱,但赤潮微藻的细胞生长也较为缓慢,所达到的最大细胞密度为对照组的80%。较低密度(0.01×104个/mL)的浒苔配子添加组对塔玛亚历山大藻的生长没有明显的抑制作用,实验组与对照组的生长曲线较为相似。
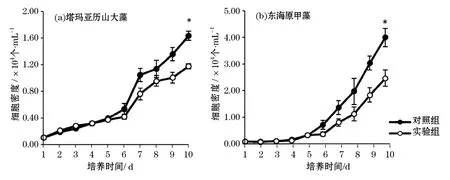
图1 浒苔配子在萌发阶段对2株赤潮微藻生长的影响Fig.1 Effects of U.proliferagametes at germination stage on the growth of two microalgal red tide strains

图2 不同接种密度的浒苔配子对塔玛亚历山大藻生长的影响Fig.2 Effects of different initial densities s of U.proliferagametes on the growth of A.tamarense
2.3 不同处理的浒苔配子在萌发阶段对塔玛亚历山大藻和东海原甲藻生长的影响
与对照组相比,在实验进行的第10天和第20天,只有浒苔配子添加组和浒苔配子培养滤液连续添加组显著抑制了塔玛亚历山大藻的生长(P<0.05),而浒苔配子培养滤液一次性添加组未对微藻的生长产生明显的影响(图3)。这说明抑藻物质不但存在于浒苔组织中,还可以分泌到培养液中起作用,但是需要连续的添加才能起到较好的抑藻效果。高温处理过的浒苔配子培养滤液也对塔玛亚历山大藻的生长无显著的抑制作用,表明该抑藻物质不稳定,易在高温下降解。实验第10天时,浒苔配子添加组和浒苔配子培养滤液连续添加组对塔玛亚历山大藻的生长抑制率为28%和25%,在第20天,对其的生长抑制率分别达到83%和63%。说明随着共培养实验的进行,这2个处理组对塔玛亚历山大藻的抑制作用不断加强,而浒苔生长所分泌克生物质的不断增加应该是导致此现象的直接原因。
与对照组相比,在实验进行的第10天和20天时,浒苔配子添加组和浒苔配子培养滤液连续添加组均对东海原甲藻的生长产生了明显的抑制作用(P<0.05),而浒苔配子培养滤液一次性添加组和高温处理过的浒苔配子培养滤液添加组均未表现出抑藻效果(图4)。这也说明该浒苔分泌的抑藻物质容易随着时间或在高温下降解。比较发现,第10天2个实验组对微藻的生长抑制率分别为39%和24%,浒苔配子添加组比浒苔配子培养滤液添加组对东海原甲藻生长的抑制作用更明显。第20天时,这2个不同的处理组对东海原甲藻生长的抑制率分别达到了40%和27%,稍高于第10天的。
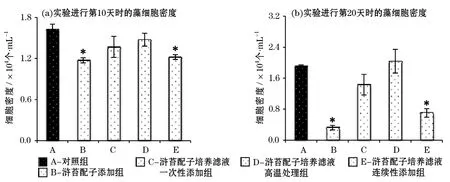
图3 不同处理组的浒苔配子在萌发阶段对塔玛亚历山大藻生长的影响Fig.3 Effects of U.proliferagametes at germination stage on the growth of A.tamarense

图4 不同处理组的浒苔配子在萌发阶段对东海原甲藻生长的影响Fig.4 Effects of U.proliferagametes at germination stage on the growth of P.donghaiense
3 讨论
藻类的化感作用是普遍存在的现象,在浮游植物种间竞争、群落演替甚至赤潮发生发展消亡过程中均发挥着重要作用,已引起了研究人员的广泛关注。石莼属绿藻对海洋微藻的影响是由多种作用机制造成的,化感作用和营养竞争是其中2种最重要的机制。化感作用,是一种生物通过向环境释放化学物质而对其附近的另一些生物产生直接或间接的、有利或有害作用的现象[19]。近年来我国黄海海域大面积的浒苔绿潮与赤潮藻的化感作用研究表明,浒苔成熟藻体会通过分泌化感物质来影响微藻的生长[8-11]。我们在实验室控制条件下进行的研究,首先排除了温度、光照等环境因素的变化可能对实验结果产生的影响,其次在实验过程中通过添加充足的营养盐来避免营养竞争。因此,我们可以判定化感作用应是引起这种影响效应的根本原因。而且浒苔在早期微观繁殖体萌发阶段即可通过化感效应抑制某些赤潮微藻的生长,并不局限于成熟的藻体阶段。
浒苔配子在萌发阶段,就可以影响赤潮微藻塔玛亚历山大藻和东海原甲藻的生长,并且随着初始接种密度的升高,其对塔玛亚历山大藻的抑制作用逐渐加强。配子添加组和滤液连续添加组均对这2株赤潮藻的生长产生了明显的抑制作用。这说明浒苔微观繁殖体组织中确实存在着抑藻物质,并且可以分泌到培养液中起作用,但是抑制效应会随着时间的进行而减弱,需要连续的添加累积才能起到较好的抑藻效果。浒苔成体的抑藻效应也有相同的报道,研究者认为化感物质具有一定的累积效应,当累积到一定的阈值时这种效应才会显现[9]。因此实验中化感物质的连续分泌及添加是抑制微藻生长的关键。高温处理过的浒苔滤液对2种微藻的生长均无显著的抑制作用,表明该抑藻物质不稳定,易在高温下降解。霍元子等[8]也曾报道新鲜的浒苔藻体培养滤液在经高温后对某些微藻抑制作用消除的现象。
随着对石莼属绿藻化感作用研究的日益增多,关于其分泌的化感物质也已经形成了一些初步的看法。Alamsjah等[20]从孔石莼中分离出抑制赤潮异弯藻的活性物质,主要成分为多不饱和脂肪酸;Jin和Dong[21]也认为不饱和脂肪酸可能是孔石莼产生的克生物质的重要组成成分之一。夏钰妹[22]从肠浒苔的有机相提取物中分离纯化出3个活性化合物,可能的抑藻成分被认为是α-亚麻酸。韩秀荣等[10]认为浒苔分泌的化感物质具有相对较高的极性;孙颖颖等[23]对浒苔抑藻组分进行进一步分离,发现其含有内酯和香豆素类化合物。这都表明石莼属不同藻种分泌的化感物质是不同的,这种差异性可能与报道的化感物质含有多种成分有关。Jensen[24]指出大型海藻的微观繁殖体在早期的固着萌发阶段,会通过释放一定的代谢产物来影响周围的微环境。Amsler和Searles的研究[25]更表明大型海藻一些特性的形成,是在其微观繁殖体阶段就建立的。我们的实验结果符合这种效应,说明浒苔能够分泌化感物质的特性在早期发育阶段就已经形成,至于浒苔微观繁殖体是否同成熟藻丝体分泌相同的抑藻物质,还有待进一步实验证实。
对比浒苔微观繁殖体与成熟藻体的抑藻试验结果,我们发现微观繁殖体在萌发阶段的第10天对塔玛亚历山大藻的生长抑制率为28%,而生物量为1.0g/L的浒苔成熟藻丝体在实验进行第10天时对塔玛亚历山大藻的生长抑制率大约为50%[8]。浒苔微观繁殖体在本实验进行的第10天仅刚完成萌发过程,细胞结构还较为简单,生物量显著低于成熟藻体的1.0g/L。因此倘若换算成同等生物量,其对微藻产生的抑制作用并不低于浒苔藻丝体,所以浒苔微观繁殖体的化感作用是不容忽视的。浒苔绿潮在其整个孕育、发生发展及消亡过程中,都有大量微观繁殖体的形成。因此,要全面地评价浒苔绿潮的生态效应,就不仅要从浒苔暴发后形成大量生物量遮蔽阳光,快速吸收营养盐,消亡时腐烂分解的影响方面考虑,还要考虑大量浒苔微观繁殖体孕育阶段可能造成的影响。我们的研究结果丰富并证实了浒苔绿潮潜在的生态效应。另外,浒苔对常见赤潮藻种生长的影响效应,可能会降低赤潮发生的几率,因此在开展赤潮的生物防治以及海域的生态修复等方面都有着积极的意义。
(References):
[1]SFRISO A,PAVONI B.Macroalgae and phytoplankton competition in the central Venice lagoon[J].Environmental Technology,1994,15(1):1-14.
[2]BARCO J W,JAMES W F.Effects of submerged aquatic macrophytes on nutrient dynamics,sedimentation,and resuspension[C]∥JEPPESEN E,SØNDERGAARD M,CHRISTOFFERSEN K.The structuring role of submerged macrophytes in lakes.New York:Springer,1998:197-217.
[3]ANDERSON D M.Turning back the harmful red tide[J].Nature,1997,388:513-514.
[4]JEONG J H,JIN H J,SOHN C H,et al.Algicidal activity of the seaweedCorallinapiluliferaagainst red tide microalgae[J].Journal of Applied Phycology,2000,12(1):37-43.
[5]JASSER I.The influence of macrophytes on a phytoplankton community in experimental conditions[J].Hydrobiologia,1995,306(1):21-32.
[6]FLETCHER R T.The occurrence of'green tide'[C]∥SCHRAMM W,NIENHUIS P H.Marine benthic vegetation-recent changes and the effects of eutrophication.Berlin:Springer,1996:7-43.
[7]KOMER S,NICKIISCH A.Allelopathic growth inhibition of selected phytoplankton species by submerged macrophytes[J].Journal of Phycology,2002,38(5):862-871.
[8]HUO Y Z,TIAN Q T,XU S N,et al.Allelopathic effects ofUlvaproliferaon growth ofKareniamikimotoi[J].Marine Environmental Science,2010,29(4):496-508.霍元子,田千桃,徐珊楠,等.浒苔对米氏凯伦藻生长的克生作用[J].海洋环境科学,2010,29(4):496-499.
[9]JIA R,WU M,CAI C E,et al.Allelopathic effects ofUlvaproliferaonHeterosigmaakashiwo[J].Journal of Fisheries of China,2012,36(4):562-567.贾睿,吴敏,蔡春尔,等.浒苔对赤潮异湾藻的克生作用[J].水产学报,2012,36(4):562-567.
[10]HAN X R,GAO S,HOU J N,et al.Allelopathic effects of extracts fromUlvaproliferapowders on the growth ofProrocentrum donghaienseandSkeletonemacostatum[J].Acta Ecologica Sinica,2013,33(23):7417-7429.韩秀荣,高嵩,侯俊妮,等.浒苔干粉末提取物对东海原甲藻和中肋骨条藻的克生作用[J].生态学报,33(23):7417-7429.
[11]WANG R J,WANG Y,ZHOU J,et al.Algicidal activity ofUlvapertusaandUlvaproliferaonProrocentrumdonghaienseunder laboratory conditions[J].African Journal of Microbiology Research,2013,7(34):4389-4396.
[12]CHAPMAN A R O.Population and community ecology of seaweeds[C]∥BLAXTER J H S,SOUTHWOOD A J.Advances in Marine Biology.London:Academic Press,1986:1-161.
[13]CLAYTON M N.Propagules of marine macroalgae:structure and development[J].British Phycological Journal,1992,27(3):219-232.
[14]SANTELICES B,AEDO D,HOFFMANN A.Banks of microscopic forms and survival to darkness of propagules and microscopic stages of macroalgae[J].Revista Chilena de Historia Natural,2002,75:547-555.
[15]SONG W,LI Y,FANG S,et al.Temporal and spatial distributions of green algae micro-propagules in the coastal waters of the Subei Shoal,China[J].Estuarine,Coastal and Shelf Science,2014,doi:1016/j.cess.2014.08.006.
[16]LI Y,SONG W,XIAO J,et al.Tempo-spatial distribution and species diversity of green algae micro-propagules in the Yellow Sea during the large-scale green tide development[J].Harmful Algae,2014,39:40-47.
[17]QI Y Z,WANG Y.What the Prorocentrum species should be[J]?Chinese Journal of Applied Ecology,2003,14(7):1188-1190.齐雨藻,王艳.我国东海原甲藻赤潮应属哪种[J]?应用生态学报,2003,14(7):1188-1190.
[18]ZHOU M J,YAN T,ZOU J Z.Preliminary analysis of the characteristics of red tide areas in Changjiang River estuary and its adjacent sea[J].Chinese Journal of Applied Ecology,2003,14(7):1031-1038.周名江,颜天,邹景忠.长江口邻近海域赤潮发生区基本特征初探[J].应用生态学报,2003,14(7):1031-1038.
[19]RICE E L.Allelopathy[M].Orlando,Florida:Academic Press,1984.
[20]ALAMSJAH M A,HIRAO S,ISHIBASHII F,et al.Isolation and structure determination of algicidal compounds fromUlvafasciata[J].Bioscience,Biotechnology,and Biochemistry,2005,69(11):2186-2192.
[21]JIN Q,DONG S L.Comparative studies on the allelopathic effects of two different strains ofUlvapertusaonHeterosigmaakashiwoand Alexandrium tamarense[J].Journal of Experimental Marine Biology and Ecology,2003,293(1):41-55.
[22]XIA Y M.Inhibitory effects and the mechanism of the marine algaeEnteromorphaintestinalison the growth of the red tide microalgae[D].Ningbo:Ningbo University,2012.夏钰妹.大型绿藻浒苔对赤潮藻的抑制作用及其机理研究[D].宁波:宁波大学,2012.
[23]SUN Y Y,DONG X K,LI G,et al.Isolation of antialgal substances fromEnteromorphaproliferaand its growth inhibition on the red tide microalgae[J].Journal of Fisheries of China,2014,38(6):813-819.孙颖颖,董晓柯,李光,等.浒苔抑藻物质的分离及其对赤潮微藻的抑制作用[J].水产学报,2014,38(6):813-819.
[24]JENSEN A.Chemical conditioning of seawater by algal growth and development[C]∥FAULKNER D J,FENICAL W H.Marine Natural Products Chemistry,New York:Plenum Press,1977:329-344.
[25]AMSLER C D,SEARLES R B.Vertical distribution of seaweed spores in a water column offshore of North Carolina[J].Journal of Phycology,1980,16(4):617-619.
