海洛因成瘾者大脑功能网络特性的功能MRI研究
2015-11-28陈佳杰CHENJiajie强LIQiang玮LIWei王亚蓉WANGYarong李永斌LIYongbin佳ZHUJia玮WANGWei峰FUFeng
陈佳杰CHEN Jiajie 李 强LI Qiang 李 玮LI Wei 王亚蓉WANG Yarong 李永斌LI Yongbin 朱 佳ZHU Jia 王 玮WANG Wei 付 峰FU Feng
论著
海洛因成瘾者大脑功能网络特性的功能MRI研究
陈佳杰1,2CHEN Jiajie 李 强2LI Qiang 李 玮2LI Wei 王亚蓉2WANG Yarong 李永斌2LI Yongbin 朱 佳2ZHU Jia 王 玮2WANG Wei 付 峰1FU Feng
作者单位 1.第四军医大学生物医学工程系 陕西 西安 710032 2.第四军医大学唐都医院放射科 陕西 西安 710038
目的 海洛因成瘾是一种慢性、复发性功能脑疾病,患者存在特定脑区的功能变化,但网络特征尚不明确。本文探讨海洛因成瘾者(HA)大脑静息态功能网络特征,从脑网络角度探索海洛因成瘾的神经影像学机制。资料与方法 采用GE 3.0T MRI仪对30例HA患者(HA组)与29例健康对照者(对照组)进行静息态扫描。运用图论理论构建脑网络,计算并比较两组小世界特性及节点度,分析差异节点度与吸食海洛因总剂量的相关性。结果 与对照组相比,HA组小世界特性(γ与λ)改变差异有统计学意义(P<0.05,错误发现率校正);眶额回度值升高,枕叶等脑区度值降低(P<0.05,错误发现率校正)。未发现HA组脑网络节点度与海洛因吸食总剂量存在相关性。结论 HA患者脑网络拓扑特性发生改变,更趋向于随机网络;对毒品的动机驱动增强以及视觉空间注意力受损,为进一步揭示成瘾的神经机制提供了思路。
海洛因依赖;磁共振成像;静息态;功能网络
海洛因成瘾是一种慢性、复发性功能脑疾病,导致一系列严重的医学和社会问题[1]。既往影像学研究表明海洛因成瘾者(heroin addicts,HA)存在特定脑区的功能变化,但HA患者脑的网络特征尚不明确。图论分析方法[2]为从全脑网络角度研究脑功能带来了新的启发。既往研究利用图论分析方法探讨了HA患者的脑功能网络[3-4],发现其小世界特性的γ值降低,λ值无差异,表明长期使用阿片类药物影响脑网络特征。然而HA患者接受美沙酮维持治疗后,美沙酮对大脑功能产生特定的影响[5],因此,上述研究未能排除美沙酮对脑网络的作用,不能揭示单纯使用海洛因对大脑网络的影响。本研究针对未经任何治疗的单纯HA患者,采用图论分析方法,从网络的角度探讨海洛因所致脑网络变化特征,为深入揭示海洛因成瘾的发生机制提供理论支持,为海洛因成瘾的治疗提供帮助。
1 资料与方法
1.1 研究对象 招募2009年10月—2010年6月就诊于唐都医院戒毒门诊的34例HA患者(HA组),所有患者均经生理脱毒,未接受包括美沙酮等在内的任何药物治疗。HA患者纳入标准:①符合《美国精神疾病诊断与统计手册》第4版海洛因成瘾诊断标准;②除海洛因外,无其他物质成瘾史;③年龄25~50岁。排除标准:①每日饮酒者;②头颅外伤、患有神经系统疾病或具有神经系统阳性体征者;③患有严重心、肝、肾功能不全等疾病;④幽闭恐惧症、MRI检查禁忌证。于唐都医院社区内招募年龄、受教育程度等与HA组匹配的29名健康志愿者作为对照组。所有受试者均为男性、右利手。本研究经唐都医院伦理委员会批准,所有受试者在检查前均被告知研究内容并自愿签署知情同意书。
1.2 数据采集 采用GE Signa Excite HD 3.0T MRI仪、8通道头部线圈对受试者进行数据采集。对每例受试者采集头颅轴位T2WI像,然后进行10 s的模拟扫描,以增强磁场的稳定性,同时让受试者适应环境。静息态功能MRI(fMRI)采集参数:TR 2000 ms,TE 30 ms,翻转角90°,层厚4 mm,层间距0 mm,层数32,视野256 mm×256 mm,矩阵64×64,激励次数1;3D T1WI像参数:TR 7.8 ms,TE 3.0 ms,翻转角20°,准备时间450 ms,层厚1 mm,层数166,层间距0 mm,视野256 mm×256 mm,矩阵256×256,激励次数1。
由2名经验丰富的影像主治医师对T2WI像进行审阅,以排除脑部存在肉眼可见病变的受试者。在fMRI序列扫描前告知受试者注视屏幕上的“+”,提示受试者放松、不思考特定的事情,并且保持头部不动。T1WI像数据用于数据预处理时对功能图像的配准。
1.3 数据分析
1.3.1 预处理 利用MATLAB 8.1和DPARSFA 2.3 (www.restfmri.net)对影像数据进行预处理,包括时间校正、头动校正、标准化到MNI空间;去除6个头动参数、全脑平均信号、白质和脑脊液信号;以6 mm的高斯核进行平滑,并进行线性漂移;以0.01~0.08 Hz进行滤波。4例HA患者因头动>1.5 mm或转动>1.5°被排除研究。
1.3.2 网络构建与分析 应用脑功能成像广泛使用的解剖学自动标记模板将大脑分割为90个感兴趣区,提取每个感兴趣区内所有体素的时间序列的均值,计算两两间的Pearson相关系数,构建相关矩阵,然后进行Fisher Z变换以增加矩阵的正态性,并对矩阵取绝对值。通过对网络稀疏度(sparsity)的设定,构建加权网络,选择稀疏度时主要遵循两个原则:避免全连接;保证连接稀疏性且孤立点尽量少。确定稀疏度的范围为0.09~0.43,选择步长为0.01。
对每个阈值下的加权网络,测量小世界特性γ(标准化的聚类系数)、λ(标准化的平均最短路径)和节点的度。为了测量网络节点在不同阈值下总的变化强度特性,参照He等[6]的研究方法,计算节点指标在不同稀疏度曲线下面积。
1.4 统计学方法 采用SPSS 19.0软件,组间人口学资料、小世界特性γ、λ及节点的度比较采用成组资料t检验,采用错误发现率(false discovery rate,FDR)进行多重比较校正;并以年龄、受教育程度、每天吸烟量和吸烟时间作为控制量,对两组差异节点脑区的度与吸食海洛因总量行偏相关分析,P<0.05表示差异有统计学意义。
2 结果
2.1 人口学结果 HA组与对照组在年龄、受教育程度、吸烟时间及每天吸烟量方面比较,差异均无统计学意义(P>0.05),见表1。

表1 HA组与对照组人口学资料比较
2.2 影像学表现
2.2.1 小世界特性 采用不同稀疏度为阈值构建大脑复杂网络,结果发现,与对照组比较,HA组表征小世界特性的γ(稀疏度为0.27~0.43)及λ(稀疏度为0.09~0.43)均显著降低,差异有统计学意义(P<0.05,FDR校正),见图1、2。
2.2.2 节点的度 HA组左侧眶额中回的度值显著高于对照组,右侧直回、左侧海马旁回、双侧距状回、左侧楔叶、左侧舌回、右侧梭状回和右侧颞中回节点的度值均显著小于对照组,差异有统计学意义(P<0.05),见表2及图3。
2.2.3 相关性分析 偏相关分析结果发现,HA组节点度与吸食海洛因总量之间无明显相关性,见表3。
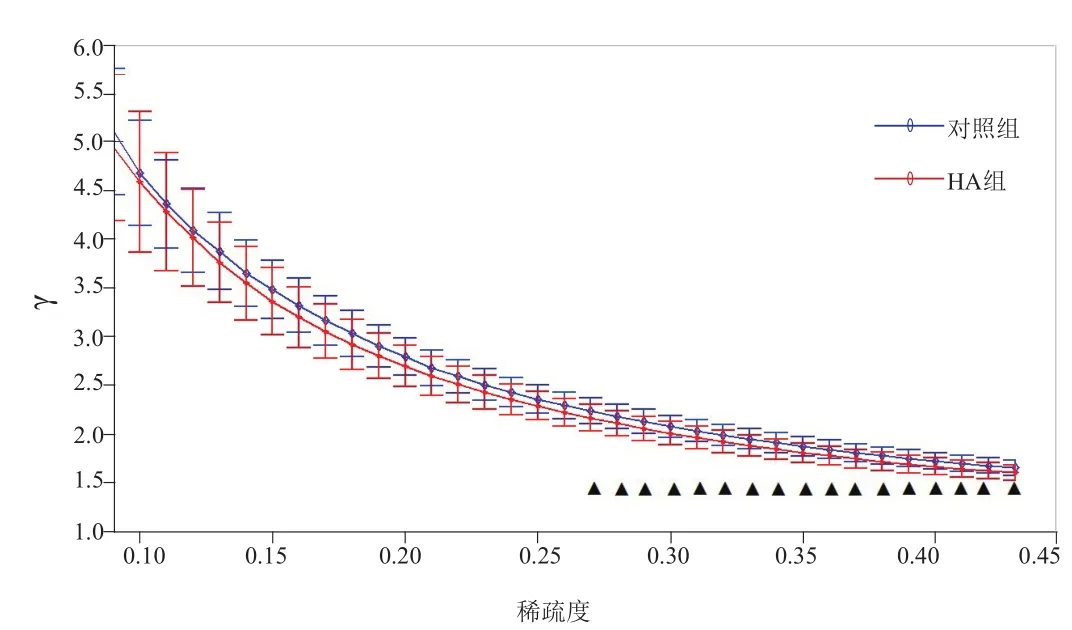
图1 在不同稀疏度下HA组与对照组的γ曲线。▲表示P<0.05 (FDR校正)

图2 在不同稀疏度下HA组与对照组的λ曲线。▲表示P<0.05 (FDR校正)

表2 HA组与对照组间脑网络节点度差异区域

图3 HA组与对照组大脑节点度值的差异脑
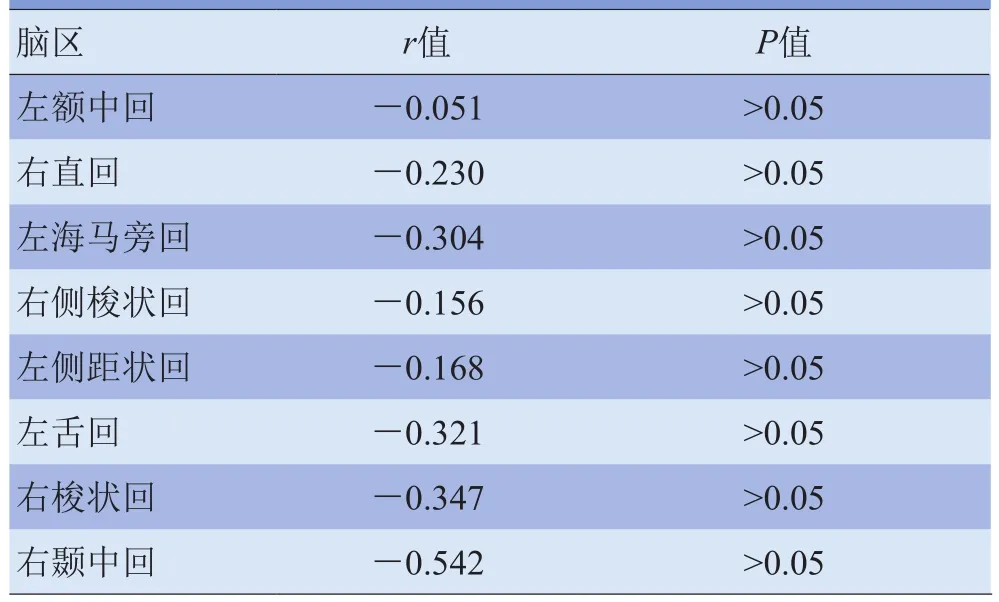
表3 HA组节点度与吸食海洛因总量的相关分析结果
3 讨论
图论理论的方法已广泛应用于正常人、抑郁、针灸等领域的脑网络研究[7-8],是目前研究脑网络的可靠影像学方法。本研究运用图论理论方法发现,未经任何治疗的单纯HA患者静息状态下的脑功能网络拓扑特性与正常人不同。局部脑区节点的度增加或降低是成瘾的神经基础,这一结果与既往报道基本一致。本研究从局部水平到全脑大尺度水平的角度探讨海洛因成瘾的机制,明确了HA患者的脑网络拓扑性质改变。
3.1 HA患者小世界特性 人脑是一个具有密集短连接和稀疏长连接特性的小世界网络,体现了功能的分化与整合的平衡性[8],有利于大脑适应快速变化的认知。基于fMRI、脑电图、脑磁图等技术的大量研究[9-10]已证实人脑的功能网络具有较高的聚类系数和较短的最短平均路径,即小世界特性[11]。在小世界网络理论中,γ值为标准化的聚类系数,衡量网络的集团化程度,刻画脑区内局部信息的传输能力,γ值越高传输能力越强;λ值为标准化的最短路径,赋予脑区间快速反应的能力,λ值越低传输越快。
本研究首次发现HA组的λ值显著降低,其可能原因是,以往研究均以经过美沙酮维持治疗的HA患者作为研究对象[3-4],而美沙酮具有改善脑功能的作用[5],这种脑功能改善的内在机制可能是脑网络特性的改变。本研究推测,由于脑网络处于动态平衡[8],当海洛因损伤成瘾者特定脑区[12],脑网络局部信息传递受阻时,转向全脑网络传递,导致λ值降低,网络效率降低。Achard等[13]基于效率理论,认为正常人大脑功能网络具有经济特性,即高效率低成本,这也进一步佐证了本研究的结论,即HA患者脑功能网络效率降低。本研究还发现,与对照组比较,HA组的γ值显著降低,反映了脑区内节点之间的连通性下降,聚类特性变小,局部信息处理能力降低[14],与既往研究[3-4]结果类似。γ值同时反映网络是否趋向于随机网络或规则网络[15],HA组γ值降低表明其脑功能网络更趋向于随机网络,上述特点说明HA患者在静息状态下脑功能网络的小世界特性发生明显改变,网络功能紊乱,效率降低。
3.2 HA患者节点度的变化特征 在小世界网络中,常用节点度来描述网络节点特性,节点的度指网络中与该节点存在直接连接的节点个数。研究脑网络中关键的节点有助于进一步认识大脑的运行机制。不同节点对整个网络的重要性不同,影响网络的传输效率。眶额回属于动机驱动环路,对在赋予事物突显性价值的过程中发挥重要作用[16]。Li等[17]研究发现,HA患者在毒品线索诱导下眶额回激活,渴求增强。本研究从网络角度,结合图论理论,发现HA组左侧眶额回的度值增加,表明与眶额回连接的节点增多,信息传输能力增高,节点的重要性提高,功能异常活跃,对毒品的突显性增强,动机驱动能力增加,也支持了既往研究结果。本研究同时发现,与对照组比较,HA组的舌回、楔叶、距状裂等枕叶节点的度降低,这些节点区域属于视觉空间注意相关功能区[18],节点间的连接个数减少,信息传递能力减弱,推测长期吸食海洛因可能造成视觉空间注意能力受损。同时,朱佳等[19]基于灰质体积的研究发现HA患者大脑视觉功能脑区体积下降,也说明海洛因成瘾累及视觉相关脑区。HA患者大脑异常节点脑区可能导致大脑相关功能网络重组,从而导致成瘾,是今后研究应该密切关注的区域。
本研究的局限性在于仅纳入男性受试者,女性HA患者是否也存在类似现象,仍需进一步研究。在后续研究中将进一步完善研究方法,更加细化网络划分,建立更加复杂和精确的脑网络模型,以深入探讨成瘾者的大脑网络特性。
总之,未经治疗的单纯HA患者脑网络的小世界拓扑特性趋向于随机网络,且对毒品的动机驱动能力增强,视觉空间注意力受损。上述脑功能网络特性的改变,为深入理解海洛因成瘾的形成机制提供了理论支持。
[1] Fischer B,Oviedo-Joekes E,Blanken P,et al.Heroin-assisted treatment (HAT) a decade later:a brief update on science and politics.J Urban Health,2007,84(4):552-562.
[2] Sporns O,Honey CJ.Small worlds inside big brains.Proc Natl Acad Sci U S A,2006,103(51):19219-19220.
[3] Jiang G,Wen X,Qiu Y,et al.Disrupted topological organization in whole-brain functional networks of heroindependent individuals:a resting-state FMRI study.PLoS One,2013,8(12):e82715.
[4] Yuan K,Qin W,Liu J,et al.Altered small-world brain functional networks and duration of heroin use in male abstinent heroin-dependent individuals.Neurosci Lett,2010,477(1):37-42.
[5] Wang Y,Wang H,Li W,et al.Reduced responses to heroincue-induced craving in the dorsal striatum:effects of long-term methadone maintenance treatment.Neurosci Lett,2014,581:120-124.
[6] He Y,Wang J,Wang L,et al.Uncovering intrinsic modular organization of spontaneous brain activity in humans.PLoS One,2009,4(4):e5226.
[7] Liu Y,Liang M,Zhou Y,et al.Disrupted small-world networksin schizophrenia.Brain,2008,131(Pt 4):945-961.
[8] Tononi G,Edelman GM,Sporns O.Complexity and coherency:integrating information in the brain.Trends Cogn Sci,1998,2(12):474-484.
[9] Ferri R,Rundo F,Bruni O,et al.Small-world network organization of functional connectivity of EEG slow-wave activity during sleep.Clin Neurophysiol,2007,118(2):449-456.
[10] 张方,张剑戈,左传涛,等.基于葡萄糖代谢的大脑功能网络的小世界特性研究.中国医疗器械杂志,2011,35(3):164-168.
[11] Watts DJ,Strogatz SH.Collective dynamics of 'small-world' networks.Nature,1998,393(6684):440-442.
[12] 王爱花,肖壮伟,梅维.fMRI观察海洛因成瘾戒断者情绪加工中的唤醒度异常.中国医学影像技术,2011,27(10):1972-1976.
[13] Achard S,Bullmore E.Efficiency and cost of economical brain functional networks.PLoS Comput Biol,2007,3(2):e17.
[14] 陈敦耀,杨嘉君,曾卫明,等.基于复杂网络的偏头痛患者脑功能连通性研究.中国医学影像学杂志,2015,23(6):418-422.
[15] He Y,Evans A.Graph theoretical modeling of brain connectivity.Curr Opin Neurol,2010,23(4):341-350.
[16] Baler RD,Volkow ND.Drug addiction:the neurobiology of disrupted self-control.Trends Mol Med,2006,12(12):559-566.
[17] Li Q,Li W,Wang H,et al.Predicting subsequent relapse by drug-related cue-induced brain activation in heroin addiction:an event-related functional magnetic resonance imaging study.Addict Biol,2015,20(5):968-978.
[18] 李永丽,王恩锋,张红菊,等.原发性失眠患者默认网络神经功能的静息态MRI研究.中国医学影像学杂志,2014,22(7):481-486.
[19] 朱佳,王亚蓉,李强,等.功能磁共振评价海洛因依赖者脑局部一致性改变.中国医学影像技术,2014,30(12):1801-1804.
(本文编辑 张春辉)
Brain Network Characteristics in Heroin Addicts:A Resting-state Functional MRI Study
Purpose Heroin addiction is a chronic and recurrent functional brain disease,there are some functional changes in specific brain regions,but the network character remains unclear.The aim of this paper is to explore the network character of brain restingstate functional network in heroin addicts,to identify the potential neuromechanism of heroin addiction from the perspective of brain network.Materials and Methods Thirty heroin addicts (HA group) and twenty-nine healthy controls (control group) underwent resting-state functional MRI scanning using GE 3.0T MRI scanner.The brain functional networks were constructed based on graph theory,the small-world properties and node properties were calculated and compared between the two groups,the correlation between the total dosage of heroin and node degree was analyzed.Results Compared with control group,the small world characteristics of HA group was altered with statistically significant difference (P<0.05,corrected by false discovery rate); the node degrees in orbit frontal regions increased,while those in occipital brain regions decreased (P<0.05,corrected by false discovery rate).No correlation was found in HA group between node degree and the total dosage of heroin.Conclusion These results suggest that topology of functional brain networks were altered in heroin addicts which tends to random networks; increased motivational driving to the salience of drug and decreased visuospatial attention in heroin addicts may provide a strategy for identifying the neuromechanism of heroin addiction.
Heroin dependence; Magnetic resonance imaging; Resting state; Function network
10.3969/j.issn.1005-5185.2015.10.003
付 峰
The Faculty of Biomedical Engineering,the Fourth Military Medical University,Xi'an 710032,China
Address Correspondence to:FU Feng E-mail:fengfu@fmmu.edu.cn
国家自然科学基金项目(81201081)。
R445.2
2015-06-24
2015-09-12
中国医学影像学杂志2015年 第23卷10期:730-734
Chinese Journal of Medical Imaging 2015 Volume 23(10):730-734
