槟榔碱的肾毒性实验研究
2015-11-27古桂花李建新尹为华袁劲松
曾 薇,古桂花,李建新,尹为华,袁劲松*
(北京大学深圳医院,深圳518036)
槟榔是棕榈科(Palmae)植物槟榔Areca catechu L.的干燥成熟种子,作为一种全世界广泛使用的嗜好品,其消费量仅次于烟草、酒精和咖啡因。 嚼食槟榔能使人产生轻微的欣快感和兴奋性,长期嚼食还有一定的成瘾性和毒性, 早在1988年KK Wary 就发现,体外实验中槟榔粗提物在100 μg/mL可提高小鼠肾细胞的分裂速率,250 μg/mL 时便可诱导肾细胞DNA 断裂[1]。 另有文献报道,长期咀嚼槟榔的人比不咀嚼槟榔的人患慢性肾脏疾病的可能性更大[2],他们的收缩压、血清尿素氮、肌酐以及尿酸的水平显著高于正常人[3-4]。 槟榔中的生物碱是主要毒性成分,其中含量最高的是槟榔碱。本课题组前期研究发现槟榔粗提物及槟榔碱存在肝毒性[5],并发现其对肾功能也有一定的影响,本研究比较了不同浓度的槟榔碱对小鼠肾功能以及细胞损伤的影响。
1 材料
1.1 试验药物
氢溴酸槟榔碱对照品采购于中国药品生物制品检定所,纯度99.5%,批号:111684-200401,分别加生理盐水配制成0.25、0.5、1.0 mg/mL 的低、中、高剂量组备用。
1.2 动物
SPF 级昆明种小鼠,40 只, 雌雄各半, 体质量23~25 g,由广东省医学实验动物中心提供(动物合格证编号:0094066)。 在温度(22±2)℃,通风良好的屏障级环境中适应性喂养5 d。
1.3 试剂
Cr 测定试剂盒、BUN 测定试剂盒(美国BECKMAN COULTER 公司)。
1.4 仪器
BP211D 电子天平 (德国SARTORIUS 公司);5810R 低温离心机(德国EPPENDORF 公司);AU5421全自动生化分析仪 (美国BECKMAN COULTER 公司);DM4000B 正立显微镜(德国LEICA 公司)。
2 方法
2.1 分组与给药
将40 只小鼠随机分为4 组,雌雄各半,每组10只。 A 为正常对照组,生理盐水灌胃20 mL/(kg·d);B、C、D 分别为槟榔碱低、中、高剂量组,给药剂量分别为5、10、20 mg/(kg·d)。 每天称体质量,并根据体质量调整用药剂量,连续给药28 d。
2.2 肾脏血清功能指标的测定
小鼠股动脉取血约1 mL, 待血液自然凝固后2 000 r/min 离心5 min 分离得血清, 使用全自动生化分析仪检测各组血清中血尿素氮(BUN)、血肌酐(Cr)以及尿素氮/肌酐比值(BUN/Cr)含量的变化。
2.3 肾脏形态及重量系数的比较
乙醚麻醉小鼠,解剖取其肾脏,观察肾脏大小、质量、外型、硬度的变化,记录单侧肾脏质量,计算单侧肾脏质量系数:
肾脏质量系数=单侧肾湿质量/体质量×100%
2.4 肾脏病理组织学观察
解剖小鼠摘取肾脏, 取同侧肾脏相同部位,以10%中性福尔马林固定液固定, 常规石蜡包埋,切片, 片厚约4 μm,HE 染色, 制作肾脏病理组织切片,光镜下作肾脏组织病理学观察。
2.5 统计学分析
利用SPSS 17.0 统计软件进行统计分析,所有计量资料以“±s”表示,单因素方差分析,组间进行两两比较。
3 结果
3.1 每周给药剂量与体质量的变化
记录每天给药之前的体质量,平均选取每周的第1 天进行数据统计,结果见表1。 发现在任一时间段内给药组与正常组比较,体质量差异无统计学意义。
表1 给药过程中各组小鼠的体质量变化比较 (±s,n=10,g)
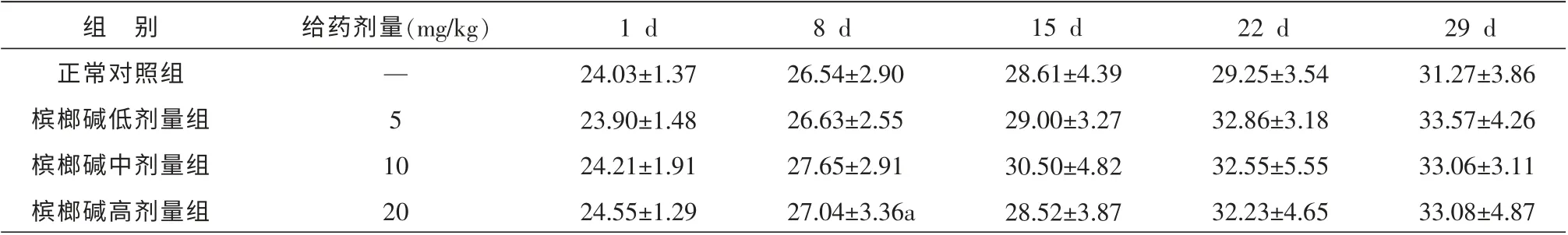
表1 给药过程中各组小鼠的体质量变化比较 (±s,n=10,g)
组 别正常对照组槟榔碱低剂量组槟榔碱中剂量组槟榔碱高剂量组给药剂量(mg/kg)— 5 1 0 20 1 d 24.03±1.37 23.90±1.48 24.21±1.91 24.55±1.29 8 d 26.54±2.90 26.63±2.55 27.65±2.91 27.04±3.36a 15 d 28.61±4.39 29.00±3.27 30.50±4.82 28.52±3.87 22 d 29.25±3.54 32.86±3.18 32.55±5.55 32.23±4.65 29 d 31.27±3.86 33.57±4.26 33.06±3.11 33.08±4.87
3.2 血清肾功能生化指标的变化
与正常对照组比较, 实验组的Cr、BUN 均有显著性升高(P<0.01),升高程度呈现剂量依赖性,说明槟榔碱会对小鼠的肾功能产生影响。BUN/Cr 比值在槟榔碱高剂量组中有显著升高,说明高剂量的槟榔碱有可能对肾脏产生不利影响。 结果见表2。
表2 不同剂量的槟榔碱对小鼠肾功能生化指标的影响(±s,n=10)
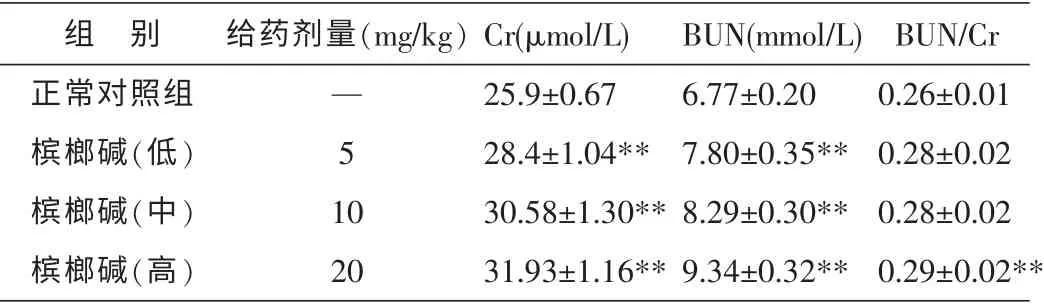
表2 不同剂量的槟榔碱对小鼠肾功能生化指标的影响(±s,n=10)
注:与正常对照组比较**P<0.01。
组 别正常对照组槟榔碱(低)槟榔碱(中)槟榔碱(高)Cr(μmol/L)25.9±0.67 28.4±1.04**30.58±1.30**31.93±1.16**给药剂量(mg/kg)— 5 1 0 20 BUN(mmol/L)6.77±0.20 7.80±0.35**8.29±0.30**9.34±0.32**BUN/Cr 0.26±0.01 0.28±0.02 0.28±0.02 0.29±0.02**
3.3 肾脏形态及质量系数的变化
将肾脏取出后肉眼观察,正常对照组与给药组的肾脏肉眼观察没有明显的差异。 对肾脏系数数据进行组内及组间差异显著性分析, 结果P>0.05,说明在此实验条件下,槟榔碱对小鼠肾脏的相对质量影响差异无统计学意义。 结果见表3。
表3 不同剂量的槟榔碱对小鼠肾脏系数的影响(±s,n=10)
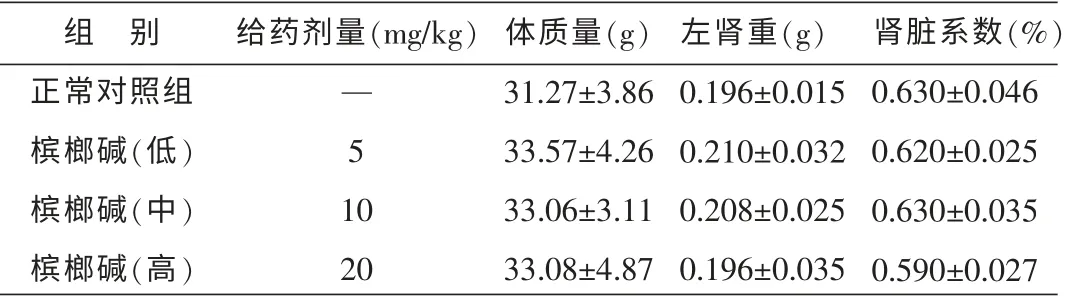
表3 不同剂量的槟榔碱对小鼠肾脏系数的影响(±s,n=10)
给药剂量(mg/kg)— 5 1 0 20体质量(g)31.27±3.86 33.57±4.26 33.06±3.11 33.08±4.87左肾重(g)0.196±0.015 0.210±0.032 0.208±0.025 0.196±0.035肾脏系数(%)0.630±0.046 0.620±0.025 0.630±0.035 0.590±0.027组 别正常对照组槟榔碱(低)槟榔碱(中)槟榔碱(高)
3.4 肾脏病理组织学变化
光镜下正常小鼠肾脏的肾小球、 近曲小管、远曲小管、出球微动脉及入球小动脉结构清晰,髓质内集合小管排列规则。 槟榔碱低剂量组小鼠肾小球旁可见局部血管扩张, 充血伴有出血及血栓形成,部分肾小球呈退变萎缩性改变,肾髓质内集合管间可见较多小血管扩张充血伴有少量小淋巴细胞浸润。 槟榔碱中剂量组小鼠肾脏在局部可见少量肾小球呈退变萎缩性改变, 部分肾小球旁可见扩张、充血的小血管,肾髓质内集合管间可见部分小血管呈充血改变,可见少量散在的小淋巴细胞浸润。 槟榔碱高剂量组小鼠肾脏部分区域可见退变萎缩的肾小球,局部肾小球旁可见有出血,周边肾小管结构破坏;肾皮质内局部出血,肾小管结构破坏,可见脱落散在的肾小管上皮; 肾髓质内集合管间可见出血,出血区可见有少量炎细胞(见封三彩图图1)。
4 讨论
本研究从生化检验学和组织病理形态学两个角度探讨了不同剂量槟榔碱对小鼠肾脏毒性的影响。 结果表明,与正常对照组相比,槟榔碱各剂量组小鼠血清Cr 和BUN 水平均有显著升高。Cr 和BUN是反映肾损伤的指标,当两者升高时,其与肾损伤程度呈正相关。血清Cr 的浓度变化主要由肾小球滤过率决定,滤过能力下降,则Cr 浓度升高,其高出正常值提示肾脏受损,因此血清Cr 能较准确地反映肾实质受损的情况。BUN 是蛋白质代谢产生的氨在肝脏经鸟氨酸循环生成的终产物, 经肾小球滤过,大部分随尿排出,小部分被肾小管重吸收入血,由于肾脏代偿功能强,60%~70%肾单位功能受损时,BUN 才高于正常。 另外BUN/Cr 比值升高也在一定程度上反映了肾小球滤过功能的损害程度。
暴露于槟榔碱的小鼠肾脏的质量系数没有显著性差异,可能是由于给药时间不够长,而槟榔对肾脏的损伤是一个慢性过程的结果。 而肾脏组织病理学结果提示, 槟榔碱对灌胃28 d 的小鼠肾脏存在一定的损害作用,说明咀嚼槟榔引起慢性肾脏疾病是一个漫长的过程,这也与文献报道[1]相符,现阶段的文献对槟榔肾脏毒性的研究多属于对长年咀嚼槟榔人群的流行病学研究。Hsu YH 等[6]回顾性考察了27 482 名志愿者连续7年的槟榔咀嚼史,对咀嚼槟榔与发生慢性肾脏病的关系做了多元线性回归分析,认为二者存在相关性。 事实上,成人如果平均每天咀嚼50 颗槟榔, 那么引起机体代谢性碱中毒, 由肾脏消耗钾引起低钾血症并导致肾机能不全的可能性更大[6]。 另外咀嚼槟榔比不咀嚼槟榔的人群患高蛋白尿的几率更高, 这可能与槟榔碱具有中枢拟交感作用,具有使心率加快、颈总动脉和颈外动脉血流量增加的作用, 从而导致高蛋白尿有关[7]。 因此本实验也是基于大量流行病学资料的基础研究。
此外,课题组前期还做了槟榔粗提物及槟榔碱对小鼠的肝毒性研究,结果显示槟榔碱会导致血清谷丙转氨酶、谷草转氨酶及碱性磷酸酶升高,并对小鼠的肝细胞有促凋亡作用[5]。 据文献记载,氢溴酸槟榔碱对小鼠5 mg/kg 腹腔给药14 d 即可破坏肝细胞的超微结构, 并抑制脾脏单核细胞的有丝分裂,20 mg/kg 便有明显的促细胞凋亡现象[8]。 中医认为肝肾同源,其生理病理密切相关,本实验是基于槟榔对小鼠肝毒性的后续研究,结果表明槟榔能造成小鼠肾脏毒性,但较肝脏毒性轻微,这对于临床上治疗具有咀嚼槟榔饮食习惯的肾性疾病患者具有一定的指导作用, 但其致毒机制有待进一步研究。
[1]Wary KK,Sharan RN. Aqueous extract of betel-nut of northeast India induces DNA-strand breaks and enhances rate of cell proliferation in vitro. Effects of betel-nut extract in vitro [J]. J Cancer Res Clin Oncol,1988,114(6):579-582.
[2]Lin SH, Lin YF, Cheema-Dhadli S,et al. Hypercalcaemia and metabolic alkalosis with betel nut chewing:emphasis on its integrative pathophysiology [J]. Nephrol Dial Transplant,2002,17(5):708-714.
[3]Kang IM,Chou CY,Tseng YH,et al. Association between betelnut chewing and chronic kidney disease in adults [J]. J Occup Environ Med,2007,49(7):776-779.
[4]Chou CY,Cheng SY,Liu JH,et al. Association between betel-nut chewing and chronic kidney disease in men [J]. Public Health Nutr,2009,12(5):723-727.
[5]古桂花,曾 薇,胡 红,等. 槟榔粗提物及槟榔碱对小鼠肝细胞凋亡的影响[J]. 中药药理与临床,2013,29(2):56-59.
[6]Hsu YH,Liu WH,Chen W,et al. Association of betel nut chewing with chronic kidney disease:a retrospective 7-year study in Taiwan [J]. Nephrology (Carlton),2011,16(8):751-757.
[7]Lin SK,Chang YJ,Ryu SJ,et al. Cerebral hemodynamic responses to betel chewing:a Doppler study [J]. Clin Neuropharmacol,2002,25(5):244-250.
[8]Dasgupta R,Saha I,Pal S,et al. Immunosuppression,hepatotoxicity and depression of antioxidant status by arecoline in albino mice [J]. Toxicology,2006,227(1-2):94-104.
