烟草根际固氮菌的筛选、鉴定及优化培养
2015-11-27刘晓璐杨柳青吕乐郭涛刘永智赵鹏董昕闫海
刘晓璐,杨柳青,吕乐,郭涛,刘永智,赵鹏,董昕,闫海
1北京科技大学化学与生物工程学院,北京100083;
2 山东省农业科学院水稻研究所,济南250100
烟草根际固氮菌的筛选、鉴定及优化培养
刘晓璐1,杨柳青1,吕乐1,郭涛2,刘永智1,赵鹏1,董昕1,闫海1
1北京科技大学化学与生物工程学院,北京100083;
2 山东省农业科学院水稻研究所,济南250100
对四川广元烟草主产区三个种植基地的烟草根际固氮菌进行筛选,分离出28株具有固氮活性的菌株。 经扩增rDNA 限制性酶切片段分析法(ARDRA)初步分类,共获得5个操作分类单元(OTU),并由16S rDNA序列进行了分析鉴定。结果表明不同分类单元分别是:苏云金芽孢杆菌、枯草芽孢杆菌、甲基营养型芽孢杆菌、巨大芽孢杆菌和炭疽杆菌。优化了N7菌株(巨大芽孢杆菌) 培养条件,确定其最佳碳源为蔗糖,最适宜初始pH值为7.5,最适温度为30℃。
烟草;固氮菌;筛选;16s rDNA;优化培养
氮是烤烟生长过程中最重要的营养元素之一,其供应量的高低对烤烟生长以及产量质量具有重要的影响[1]。在烤烟吸收的氮营养中,60%以上来自于土壤,肥料氮仅占总氮量的35%左右[2-3],因此,提高土壤供氮量对烤烟获得高产具有重要的实践意义。为提高土壤供氮能力,部分学者提出了采用生物固氮菌来提高烤烟的固氮和供氮能力,并且取得了一定的研究成果。卢江平[4]和阎启富[5]于1996年进行了生物固氮菌在烤烟上的应用效果试验,结果表明,生物固氮菌的应用可以显著提高烤烟产量和产值,特别是不施用氮肥处理,烤烟栽培经济效益提高显著高于施用氮肥处理,证明生物固氮菌对促进烤烟生长具有良好的作用;王豹祥研究了不同菌种对烤烟养分吸收以产量质量的影响规律,结果表明,固氮菌处理烤烟产量提高9.12%,产值提高30%以上,而化肥使用量降低了26%;罗红燕[7]研究证明,VA菌根可以显著促进烤烟生长,氮磷钾养分利用率可以提高10%以上,植株干物质积累量提高20%以上,土壤内微生物数量提高幅度达到163.2%,土壤内有效氮磷钾提高12%以上,对提高烤烟经济效益具有重要的作用。烤烟固氮菌的施用导致烤烟产量升高的主要原因是固氮微生物可以较好的为烤烟提供氮素营养,促进烤烟对氮元素的吸收和利用[8];在目前固氮菌的研究中,鲜有根际固氮菌及其固氮能力的报道[9]。本文研究了烤烟根系固氮菌的应用与筛选,以期为该菌种的生产应用提供理论依据。
1 材料与方法
1.1 土壤和菌种
土壤样品取自四川省广元市的烟草种植区,取样地点为植烟时间10年以上,且烟草质量、产量都较高的种植区。将取得的土壤样本在生理盐水中稀释后涂布到Ashby无氮培养基平板上,25℃恒温培养7 d。取长势良好的单克隆菌落,在Ashby 培养基上划线培养2 d,用接种针取菌划线转接到牛肉膏蛋白胨培养基上培养,获得固氮菌纯化菌株,保存于-20℃。
1.2 培养基
Ashby培 养 基:KH2PO40.2 g,CaCO35 g,MgS04·7H20 0.20 g,甘露醇10 g,NaCl 0.2 g,琼脂18 g,CaSO4·2H2O 0 .1 g,蒸馏水 1 000 mL。
牛肉膏蛋白胨培养基:牛肉膏5 g,蛋白胨1 g,NaCl 5 g,琼脂18 g,蒸馏水1 000 mL。
1.3 16S rDNA 鉴定
生工SK8255提取全基因组试剂盒提取筛选的固氮菌全基因组DNA。NANODROP2000(Thermo)检测DNA的质量和浓度并将DNA工作浓度调至100-200 ng/μL。 采 用 Biometra扩 增 仪(Thermo,USA)PCR扩增。扩增体系:98℃预变性30s;98℃变性10s,58℃复性30s,72℃延伸1min,35个循环;再延伸10min。PCR反应总体系为20μL,其中ddH2O 6.4μL,DMSO 0.6μL,2×Pfu Master Mix 10μL,Primer F(27F) 1μL,Primer R(1492R) 1μL,DNA模板1μL。取20μL PCR产物,在0.8%琼脂糖凝胶电泳上100V 电泳20 min后,凝胶成像系统观察、拍照。目标条带应用天根DP209琼脂糖凝胶回收试剂盒切胶回收,取2μL胶回收产物在0.8%琼脂糖凝胶电泳验证。
1.4 ARDRA分析
分别用限制性内切酶AluI和HaeⅢ对PCR 产物进行ARDRA多态性分析。反应体系:模板:扩增产物 10μL,内切酶:2μL,0 .1% BSA :2μL,加水至20μL,反应混合物置37℃ 水浴酶切12 h,加2μL Loading Buffer终止反应。
取4μL胶回收产物与pEASY zero blunt vector在25℃下连接15 min,并转化到Trans T1感受态细胞中,加200μL无抗LB摇1 h,取200μL菌液涂于加有氨苄青霉素的LB板上。培养12-16 h,挑单克隆菌落进行菌落PCR检测。将克隆成功菌株送生工生物工程(上海)股份有限公司测序。
将测序序列与GenBank数据库(http://www.ncbi.him.nih.gov/blast/Blast.ci) 中同源序列进行同源性分析,应用MEGA3.0软件绘制系统发育树。
1.5 优化培养
将N7菌株(巨大芽孢杆菌),在250 mL三角瓶中震荡培养,选择葡萄糖、甲醇、蔗糖、乙醇和甘油5种含碳有机物作为测试碳源。按照总有机碳为8.0 g/L的量分别加入[9]。
设置5.50、6.00、6.50、7.00、7.50和8.00的不同初始pH值,25℃、30℃、35℃和40℃的不同培养温度单因素培养条件。震荡培养N7菌株48 h后,取样,722S型分光光度计测定680 nm光密度。
1.6 试验用根际土壤信息
四川省广元市长期种植烟草的3份土壤的基本信息如表1。
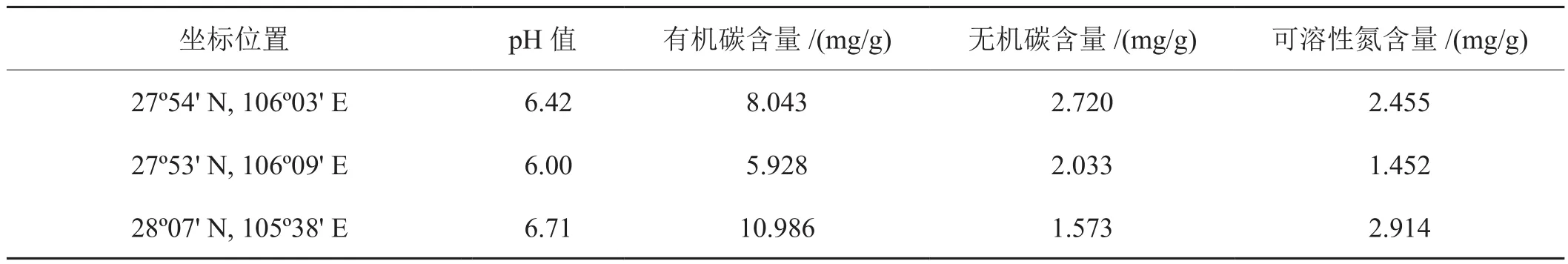
表1 本研究所用根际土壤的基本信息Tab.1 Information on tested tobacco rhizosphere
2 结果与分析
2.1 16S rDNA PCR扩增
对28株固氮菌,利用细菌16S rDNA通用引物27F和1492R对固氮菌基因组DNA进行扩增,得到一条1500 bp左右的特异性条带,扩增产物无拖带现象。图1为部分菌株的16S rDNA电泳图。

图1 供试菌株16S rDNA片段PCR扩增结果Fig.1 PCR amplicons of 16S rDNA fragment of tested strains
2.2 ARDRA分析
实验发现AluI的多态性较好,最终以AluI的分类结果为标准,以每1个16S rDNA 限制片断长度多态性类型代表了一个操作分类单元(Operational Taxonomic Unit,OTU),共得到5 种OTU(图2),不同OTU对应菌株数量如下。OTU1:14株;OTU2:5 株;OTU3:7 株;OTU4 1 株;OTU5 1 株。
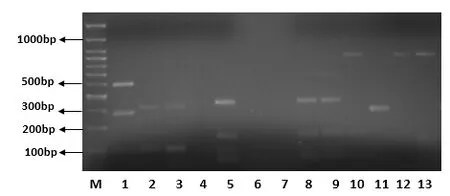
图2 ARDRA琼脂糖凝胶电泳图谱Fig.2 Agarose gel electrophoresis of ARDRA
将ARDAR 结果构建树状聚类图(图3),并分别从OTU1中选取5个固氮菌株,OTU2中选取2个固氮菌株,OTU3中选取3个固氮菌株,OTU4中选取1个固氮菌株,OTU5中选取1个固氮菌株,共12株固氮菌,命名为N1-N12进行后续试验。
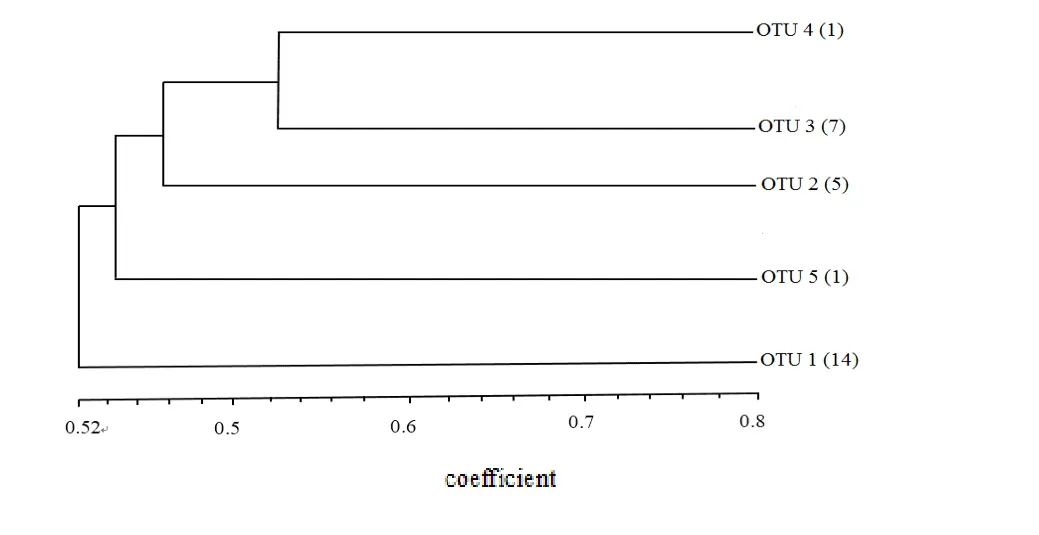
图3 ARDRA聚类分析图Fig.3 Cluster analysis of ARDRA
2.3 16S rDNA序列同源性及遗传进化分析
将获得的测序结果输入NCBI网站Blast检索,在Clustal-x程序中进行多重序列匹配排列(Multiple Alignments)分析,再用Mega3.0中的Neighbor-Joining法构建系统发育树(图4)。从测序结果和图2中可以看出,⑴ N1的16S序列与Bacillus thuringiensis相似性为99%,推断该菌株是苏云金芽孢杆菌(B.thuringiensis);⑵ N2、N5、N6、N9、N10的16S序列与Bacillus subtilis相似性达到98%,推断这些菌株应属枯草芽孢杆菌(B.subtilis);⑶N4、N8、N12的16S序列与Bacillus methylotrophicus相似性为99%,推断这些菌株是甲基营养型芽孢杆菌(B.methylotrophicus);⑷ N7的16S序列与Bacillus megaterium相似性达到98%,推断该菌株是巨大芽孢杆菌(B.megaterium);⑸ N3、N11的16S序列与Bacillus anthracis相似性达到97%,推断这两个菌株应为炭疽杆菌(B.anthracis)。
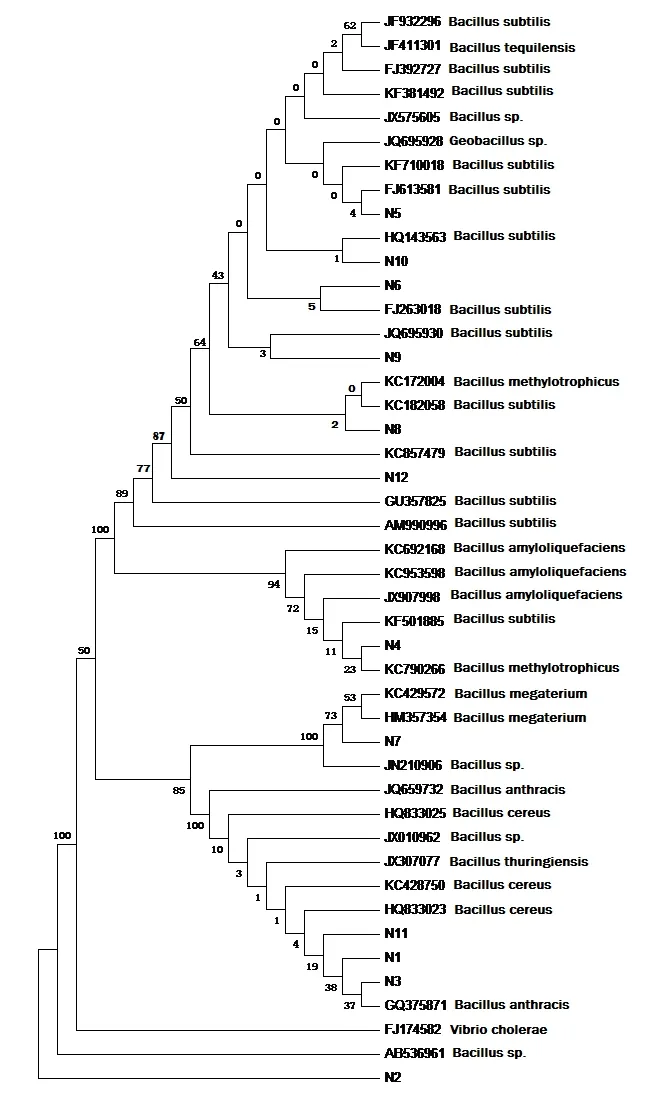
图4 根据16S rDNA序列分析构建的系统发育树Fig.4 Phylogenetic tree based on analysis of 16S rDNA sequences of cellulose-degrading isolates
2.5 优化培养结果
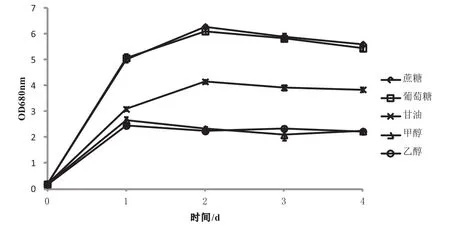
图5 不同碳源对N7生长的效应Fig.5 Effects of different carbon sources on growth of N7
图5显示,N7可利用的碳源较广泛,除甲醇和乙醇效果稍差外,葡萄糖、蔗糖、甘油均为较好的碳源被N7利用,且以蔗糖为碳源的培养基生长量最高。
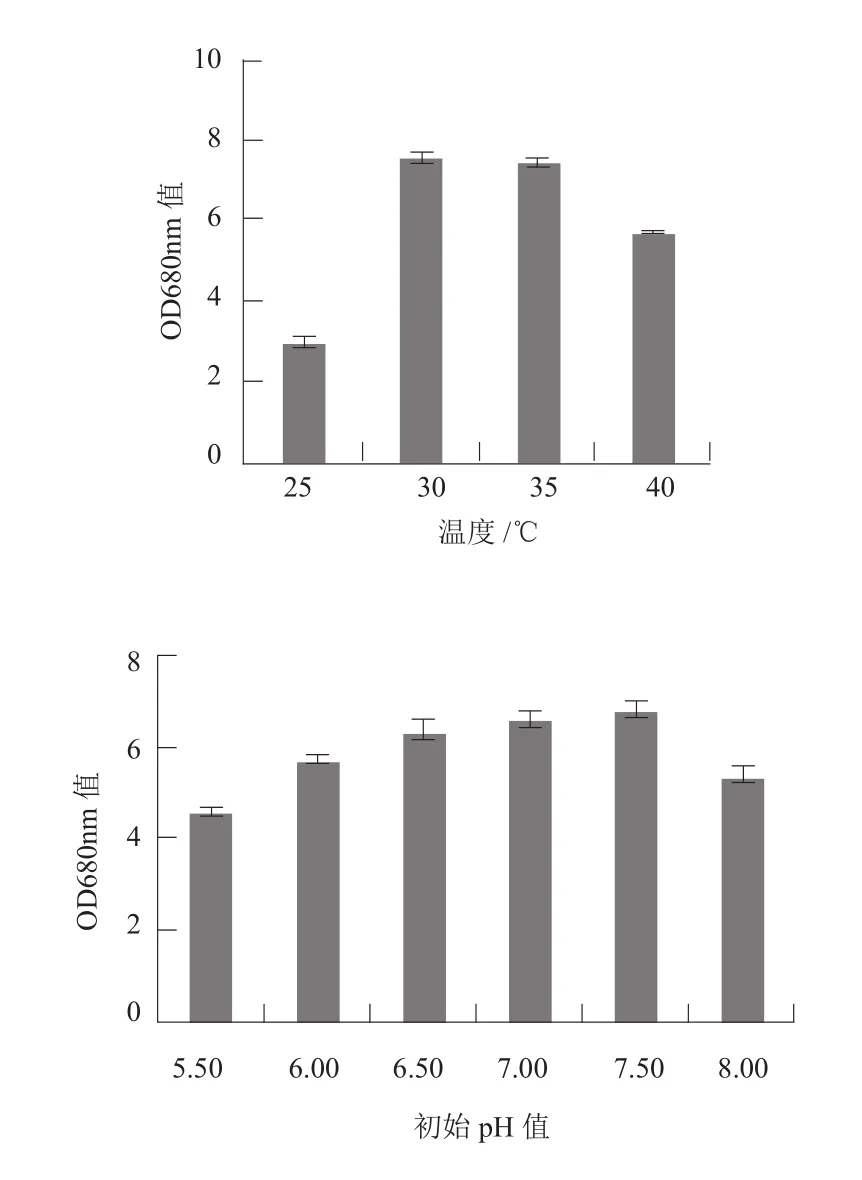
图6 不同温度和初始pH值和对N7生长的效应Fig.6 Effects of different initial pH values and temperatures on growth of N7
初始pH值和培养温度的单因素实验结果表明(图6),N7在初始pH值6.5-7.5均能生长,快速生长的最优初始pH值为7.50。N7菌株的培养温度在25-40℃范围内均可生长,30℃是培养N7的最佳温度。
3 结论与讨论
自生固氮菌是一类生活在土壤有机质中促进植物生长的根际细菌[12]。本试验筛选出的固氮菌都属于自生固氮菌,均为杆菌。苏云金芽孢杆菌、枯草芽孢杆菌、甲基营养型芽孢杆菌、巨大芽孢杆菌都是具有固氮功能的细菌。
N7的16S序列与Bacillus megaterium相似性达到98%,可推断这个菌株是巨大芽孢杆菌。巨大芽孢杆菌是一种益生菌,在20世纪40年代,巨大芽孢杆菌就已进行实验研究,学者Sundar、Molla以及Ellott等发现以巨大芽孢杆菌为核心制成混合菌剂,可降解难以溶解的含磷化合物[13-15]。1958年Hin在日本首次分离得一株具有高固氮活性的巨大芽孢杆菌,相对于生物肥料来说,巨大芽孢杆菌具有自身独特的优良特点,其生存能力及适应能力较强,对于在非人工氮素供应上这类菌株将起着十分重要的作用[16-17]。巨大芽孢杆菌不仅具有高效降解烟草中亚硝酸盐的功能[18],更有研究表明由巨大芽孢杆菌制成的微生物制剂喷洒在烟草叶片上,能有效的提高叶片的香味,并且降低蛋白质含量,对烟草的品质有很大提高[19]。并且巨大芽孢杆菌与节杆菌双菌种共同作用能有效提高废次烟叶的综合利用和烟草薄片质量,这对烟草企业有巨大的经济意义[20]。
N2、N5、N6、N9、N10的16S序列与Bacillus subtilis相似性达到98%,由此可推断这几个菌株是枯草芽孢杆菌。枯草芽孢杆菌是一种益生菌,不仅能够提高植物种子的发芽率,更具有固氮活性[21]。目前有研究表明,枯草芽孢杆菌是一种内生固氮菌,定殖在宿主植物体内,直接分泌固氮产物给植物吸收,不易受到外界环境条件的干扰,更有利于充分发挥固氮效能,表现出更高的固氮效率[22]。在甘蔗内生固氮菌的研究中,证实了枯草芽孢杆菌和巨大芽孢杆菌的高效固氮活性[23]。English等研究显示,烟叶分别或混合接种枯草芽孢杆菌和环状芽孢杆菌后,能迅速产生一种令人愉悦的香气[24]。并且研究表明利用枯草芽孢杆菌还可以高效防治烟草青枯病[25]。
N1的16S序列与Bacillus thuringiensis相似性达到99%,由此可推断该菌为苏云金芽孢杆菌。苏云金芽孢杆菌不仅常用作微生物杀虫剂,也具有高效固氮功能。N4、N8、N12的16S序列与Bacillus methylotrophicus相似性达到99%,由此可推断这几个菌是甲基营养型芽孢杆菌,具有高效固氮功能。但是目前对苏云金芽孢杆菌和甲基营养型芽孢杆菌的固氮功能研究相对较少,这两个菌种的固氮活性需要做进一步的研究。ARDRA的分析结果大致一致,证实了我们分类的正确性。
本试验对巨大芽孢杆菌的适宜培养条件、最适pH值等进行了研究。把蔗糖作为N7的最优碳源进行下一步的研究。与蔗糖相比,葡萄糖属于单糖,一般较容易被细菌利用,但在其代谢过程中产酸速度较快,从而使得培养基pH值快速降低,这可能是导致其生长量较蔗糖低的主要原因[9]。N7快速生长的最优初始pH值为7.50,菌株在中性或偏碱性的条件下生长好,这与文献报道的植物生长促生菌的适宜培养条件一致[26-29]。在温度优化培养中,N7的最适生长温度是30℃,可能是由于较低的温度(25℃),菌体新陈代谢较慢,导致菌生长和分裂速度受影响;较高的温度(40℃),由于该温度超过了菌体内酶的最适温度,使得其催化效率有所下降,从而影响了细菌的生长。
[1]王鹏,张吉立,李洋,等.大豆饼肥对烤烟氮积累及烟叶产值的影响[J].干旱地区农业研究,2012,5:143-146.
[2]苏帆,付利波,陈华,等.应用15N研究烤烟对饼肥氮素的吸收利用规律[J].中国生态农业学报,2008,2:335-339.
[3]习向银,赵正雄,李春俭.肥料氮和土壤氮对烤烟氮素吸收和烟碱合成的影响[J].土壤学报,2008,4:750-753.
[4]卢江平,李安源.生物固氮菌在烤烟上的应用[J].烟草科技,1996(5):32-36.
[5]阎启富.共生性固氮菌在山地烤烟上的应用[J].烟草科技,1997(4):12-15.
[6]王豹祥,李富欣,张朝辉,等.应用PGPR菌肥减少烤烟生产化肥的施用量[J].土壤学报,2011,4:813-822.
[7]罗红燕.VA菌根真菌对烤烟生长及根际土壤微生态环境的影响[D].重庆:西南农业大学,2002:17-26.
[8]唐凤灶.安徽铜陵铜尾矿原生演替过程中的土壤固氮菌研究[D].广州:中山大学,2010:1-58.
[9]姚拓,张德罡,胡自治.高寒地区燕麦根际联合固氮菌研究[J].草木学报,2004,2(13):106-110.
[10]谢光辉,苏宝林,崔宗均.长江流域水稻根际芽孢杆菌属固氮菌株的分离和鉴定[J].微生物学报,1998,38(6):480-483.
[11]尤崇杓.水稻根际联合固氮菌[M].北京:农业出版社,1990:329-335.
[12]Glick B R.The enhancement of plant growth by free-living bacteria.Can[J].J Microbiol,1995,41:109-117.
[13]Sundar O,Racand W B,Sinha MK.Phosphate dissolving microorganisms in the rhizosphere and soil[J].India Agric Sci,1963,33(4):272-278.
[14]Molla MZ,Chowdhury MA.Microbial mineralization of organic phosphate in soil[J].Plant and Soil,1984,78(1):393-399.
[15]Ellott JM,Mathre DE,Sands DC.Identification and characterization of rhizosphere competent bacteria of wheat[J].Appl Environ Microbiol,1987,53(2):2793-2799.
[16]覃小红.固氮巨大芽孢杆菌在桉树栽培上的应用初探[D].广西:广西大学,2013:1-6.
[17]Javier V,María I.García-Sánchez,et a1.Purification and characterization of ferredoxin-nitrite reductase from the eukaryotic microalga Monoraphidium braunii [J].Plant Physiol Biochem,2002,40:401-405.
[18]杨艳.巨大芽孢杆菌产亚硝酸盐还原酶的研究[D].沈阳:沈阳农业大学,2007:1-40.
[19]汪长国,戴亚,朱立军,等.采收前叶面喷施微生物制剂改善烟叶品质试验[J].烟草科技,2006,4:31-34.
[20]艾继涛.双菌种发酵提高烟草薄片和废次烟叶品质研究[D].北京:中国农业大学,2006:1-53.
[21]振粉.牧草内生枯草芽孢杆菌的功能多样性及其16S rDNA鉴定[D].甘肃:甘肃农业大学,2010:1-59.
[22]丁国春,付鹏,李红梅.枯草芽孢杆菌AR11菌株对南方根结线虫的生物防治[J].南京农业大学学报,2005,28(2):46-49.
[23]周发俊.甘蔗内生固氮菌的分离鉴定及16SrRNA基因克隆和序列分析[D].福建:福建师范大学,2009:1-52.
[24]English CF,Bell EJ,Berger AJ.Isolation of thermophiles from broadleaf tobacco and effect of pure culture inoculation on cigar aroma and mildness[J].Appl Microbio,1967,15:117-119.
[25]易有金,罗坤,罗宽,等.内生枯草芽孢杆菌B-001菌株内生定殖研究及生物学特性[J].核农学报,2007,21(4):349-352.
[26]张高峡,卢振祖.作物根际联合固氮芽孢杆菌的分离鉴定及生态分布[J].氨基酸和生物资源,1998,20(1):12-15.
[27]刘荣昌,李凤汀.小麦接种联合固氮菌增产效果研究[J].华北农学报,1989,4(3):74-84.
[28]李永兴,王继文,李久蒂.玉米根际联合固氮菌的基本特性的研究[J].微生物学报,1993,33(6):151-158.
[29]方敦煌,赵玉虎,沐应祥.拮抗菌株GPl3的基本生物学特性的研究[J].西南农业大学学报,2002,24(4):359-361.
Screening,identi fi cation and culture optimization of nitrogen- fi xing bacteria in tobacco rhizosphere
LIU Xiaolu1,YANG Liuqing1,LYU Le1,GUO Tao2,LIU Yongzhi1,ZHAO Peng1,DONG Xin1,YAN Hai1
1 School of Chemistry and Biological Engineering,Beijing University of Science and Technology,Beijing 100083,China;
2 Shandong Rice Research Institute,Shandong Academy of Agriculture Science,Jinan 250100,China
Twenty-eight diazotrophs were isolated from rhizosphere soil samples from Guangyuan tobacco growing area,Sichuan province.These diazotrophs were isolated by using free nitrogen medium.Ampli fi ed rDNA restriction analysis(ARDRA)showed that all strains isolated could be classified into 5 Operational Taxonomic Units(OUT).Different OUTs was identified by 16S rDNA sequencing,and those were identi fi ed as Bacillus:Bacillus thuringiensis; Bacillus subtilis; Bacillus methylotrophicus; Bacillus megateriumandBacillus anthracis.The batch culture conditions of isolate N7(Bacillus megaterium) were optimized via adjusting carbon sources,temperature and pH values.It was found that the best carbon source is sucrose,while the best initial pH value 7.5,and the best temperature 30℃.
tobacco; nitrogen- fi xing bacteria; screening; 16S rDNA; optimized culture
刘晓璐,杨柳青,吕乐,等.烟草根际固氮菌的筛选、鉴定及优化培养[J].中国烟草学报,2015,21(1)
北京高等学校青年英才计划项目(No.YETP0394)
刘晓璐(1983—),博士,副教授,主要研究方向为功能基因组学、资源与应用微生物学,Email:xiaoluliu@ustb.edu.cn
闫海(1962—),博士,教授,主要研究方向为环境微生物学,Email:haiyan@ustb.edu.cn
2014-10-12
:Liu Χiaolu,Yang Liuqing,Lyu Le,et al.Screening,identification and culture optimization of nitrogen-fixing bacteria in tobacco rhizosphere [J].Acta Tabacaria Sinica,2015,21(1)
