紫花苜蓿根响应盐胁迫的比较蛋白质组学分析
2015-11-26熊军波杨青川蔡化田宏张鹤山刘洋
熊军波 杨青川 蔡化 田宏 张鹤山 刘洋

摘要:6 d龄紫花苜蓿(Medicago sativa L.)幼苗在0、200 mmol/L NaCl处理9 d后,采用双向电泳分别分离了其根部蛋白组。最终每块胶中有超过900个蛋白质点被分离,采用MALDI-TOF-TOF/MS质谱技术结合MASCOT软件在线检索,成功鉴定21个表达量发生1.5倍以上变化的蛋白质点,为19种不同的蛋白质。生物信息学分析表明,这些差异表达蛋白质主要参与胁迫防御、碳水化合物和能量代谢、次生代谢、转录和翻译调控、信号传导和离子转运等调控途径。
关键词:紫花苜蓿(Medicago sativa L.);盐胁迫;根;蛋白质组
中图分类号:S551+.7 文献标识码:A 文章编号:0439-8114(2015)21-5422-07
DOI:10.14088/j.cnki.issn0439-8114.2015.21.057
Comparative Proteomic Analysis of Salt-stress Response of Alfalfa Proteins in Root
XIONG Jun-bo1,YANG Qing-chuan2,CAI Hua1,TIAN Hong1,ZHANG He-shan1,LIU Yang1
(1.Institute of Animal Science, Hubei Academy of Agricultural Science, Wuhan 431700, China;2.Institute of Animal Science of Beijing, Chinese Academy of Agricultural Science, Beijing 100194, China)
Abstract: 6 day old alfalfa (Medicago sativa L.) seedlings were exposed to 0(control),and 200 mmol/L NaCl for 9 days. Proteins extracted from the root of alfalfa seedlings were separated by two-dimensional gel electrophoresis(2-DE). More than 900 protein spots were detected on each gel,and 21 spots at least one point five-fold differences in abundance were identified by matrix-assisted laser desorption ionization time-of-flight/time-of-flight mass spectrometry (MALDI-TOF-TOF/MS) and MASCOT online. Bioinformatics analysis induced that these proteins were associated with a variety of functions,including stress defense,carbohydrate and energy metabolism,secondary metabolism,transcription and translation related,signaling and ion transport.
Key words:alfalfa(Medicago sativa L.); salt-stress;root; proteomic
根据联合国粮食与农业组织(Food and Agriculture Organization)的估算,全世界约有3 400万hm2(灌溉面积的11%)受到不同程度的盐渍化影响[1]。据农业部组织的第二次全国土壤普查资料统计,我国现有盐渍土的面积为0.35亿hm2(不包括滨海滩涂),其中已开垦种植的为576.84万hm2。盐渍化土壤中高浓度的盐离子会对植物的正常生理代谢产生影响,如水分缺失、离子毒害、营养失衡、氧化胁迫等,从而导致植物生长减缓,甚至死亡[2]。土壤盐渍化大大限制了作物生产,威胁到粮食安全,研究作物抗盐机制,提高作物抗盐能力,是全球农业发展的重要方向。
紫花苜蓿(Medicago sativa L.)为豆科苜蓿属多年生草本植物,是世界上栽培种植利用最为广泛的人工牧草,素有“牧草之王”和“饲料皇后”的美称。紫花苜蓿属于中等耐盐碱植物,在电导率范围为2.0 dS/m和渗透压在1.5 bars内的土壤中能正常生长,超过此范围,电导率每上升一个单位,产量下降7%[3]。生理生化研究表明,紫花苜蓿可以通过改变外在形态、加强活性氧胁迫保护、合成渗透物、离子选择吸收、隔离和外排、改变细胞壁和细胞膜结构等措施以适应盐胁迫[4]。这些适应性调节机制与盐胁迫下紫花苜蓿基因网络的特异性表达密切相关,采用各种高通量技术,已鉴定出大量盐胁迫响应基因[5,6]。然而,这些研究都是基于转录水平的差异表达来寻找胁迫应答基因,mRNA只是基因行使功能的中间载体,而蛋白质才是执行各种生命活动的主体,且研究表明,蛋白质的表达水平和mRNA水平间相关性不强,因此有必要从蛋白质水平对紫花苜蓿响应盐胁迫的调节机制进行研究。近年来,国内外研究者采用蛋白质组学的方法对超过34种植物的抗盐胁迫蛋白质组学进行了研究,并成功鉴定出大量盐胁迫响应蛋白质[7]。根系是植物感受多种胁迫伤害的最初位点,对根系响应盐胁迫的研究有助于更深入地了解盐胁迫的调节机制。本研究以紫花苜蓿根系为研究对象,对根响应盐胁迫的比较蛋白质组学进行分析,以期更深入地揭示紫花苜蓿响应盐胁迫的调节机制。
1 材料与方法
1.1 试验材料
紫花苜蓿“中苜一号”种子由中国农业科学院畜牧研究所牧草研究室提供。挑选籽粒饱满、无病虫害种子,用1%次氯酸钠溶液消毒5 min,然后用蒸馏水冲洗3次。清洗的种子用蒸馏水浸种12 h后,放置于湿润的滤纸中培养3 d。之后将幼苗移入1/2 Hoagland营养液进行水培,6 d后开始胁迫。将培养的幼苗分为两组:一组在1/2 Hoagland营养液中培养;另一组在1/2 Hoagland营养液中添加50 mmol/L NaCl适应生长24 h,其后放入终浓度为200 mmol/L NaCl的1/2 Hoagland营养液培养。每两天更换一次培养液,期间不定时搅拌,培养9 d后同时收割两组苜蓿根部,液氮保存。
1.2 药品与试剂
固相pH 梯度干胶条(pH 4-7)、IPG buffer、2D clean-up试剂盒、2D-Quant试剂盒、尿素(Urea)、甘氨酸、CHAPS、丙烯酰胺(Acrylamide)、甲叉双丙烯酰胺(Bis-Acrylamide)、过硫酸铵(AP)、甘油(glycerol),干胶条覆盖液,均购至Amersham Biosciences公司;碘乙酰胺、二硫苏糖醇(DTT)、四甲基乙二胺(TEMED)购自Sigma公司;溴酚蓝、蛋白Marker、碳酸钠、乙酸钠、硫代硫酸钠、EDTA二钠盐、十二烷基磺酸钠(SDS)、低熔点琼脂糖购自BBI(Bio Basic Inc,加拿大);其他试剂为国产分析纯。所有溶液均用Milli-Q制备的纯水配制。
1.3 总蛋白质的提取和定量
蛋白质提取方法参照文献[8],部分进行调整。称取0.5 g样品液氮研磨后,转入离心管加入3 mL TRIzol (2% DTT), 振荡混匀,添加0.6 mL氯仿,振荡混匀,放置5 min;4 ℃,15 000 r/min离心10 min,去上清,添加0.9 mL无水乙醇,振荡混匀,放置5 min;4 ℃,15 000 r/min,离心5 min,取上清,加入4.5 mL异丙醇,振荡混匀,4 ℃放置5 min;此后4 ℃,15 000 r/min离心10 min,去溶液,用6 mL含300 mmol/L盐酸胍的95%乙醇洗涤沉淀3次;4 ℃,15 000 r/min离心10 min,留沉淀,用6 mL无水乙醇洗涤一次,冷冻干燥。其后加入裂解液[8Murea, 2% CHAPS(W/V),1%DTT(W/V),0.5% IPG buffer(V/V)(pH 4~7) 和 0.002% Bromophenol blue(W/V)],超声20 min促溶,4 ℃静置4 h以上,离心沉淀(4 ℃,40 000 r/min,1 h),吸取上清备用。使用Amersham公司2D-Quant试剂盒对蛋白质进行定量分析,步骤按试剂盒说明进行。
1.4 等电聚焦电泳和SDS-PAGE电泳
使用水化液[8Murea,2% CHAPS(W/V),1%DTT(W/V),0.5%IPG buffe(V/V)(pH 4~7)和0.002% Bromophenol blue(W/V)]稀释蛋白质溶液,最终将120 mg/450 mL蛋白质溶液上样到24 cm pH 4~7 IPG胶条上。等电聚焦在Ettan IPGphor II (GE Healthcare)仪器上进行,温度设置为20 ℃,程序为:30 V,12 h;150 V,1 h;500 V,1 h;1 000 V,1 h;8 000 V,2 h;8 000 Vh 到 40 000 Vh。等电聚焦后胶条立即平衡,首先在含有平衡液[6 mol/L urea, 30% glycerol(W/V),2%SDS(W/V),50 mmol/L Tris-HCl,pH 8.8,1% DTT(W/V)]的平衡液管中水平放置15 min,其后换入含有平衡液的管中水平放置15 min。平衡后的胶条转移到12%的SDS-PAGE凝胶中进行二向分离,首先在电泳液[250 mmol/L Tris-base,1.92 mol/L glycine和1% SDS(W/V)]中0.2 W/strip运行1 h,其后相同环境中使用15 W/strip运行到结束。每组试验设置4次组内重复。
1.5 蛋白染色和图像分析
凝胶选用银染,方法参照GE handbook 做适当修改。凝胶首先在含有40%乙醇,10%乙酸的水溶液中固定1 h,其后使用含有30%乙醇,0.2%硫代硫酸钠(W/V)和6.8%乙酸钠溶液中敏化30 min。经超纯水漂洗3次,每次5 min;后转入含有2.5 g/L的硝酸银溶液中银染20 min,其后使用超纯水漂洗2次,每次1 min;转入显色液(25 g/L 碳酸钠,240 ml/L 甲醛)中显色2次,第1次1 min,第2次4 min。反应完后转入含有1.46%的EDTA溶液中10 min终止反应,最后使用纯水漂洗3次,每次5 min。染色完成的胶用Powerlook 2100XL扫描仪扫描,并使用ImageMasterTM 2D Platinum 6.0软件分析,包括凝胶图像的背景消除、点确认、定量和点的匹配等,选取蛋白质差异达1.5倍以上的蛋白质点进行质谱分析。
1.6 蛋白质谱鉴定和分类分析
根据ImageMaste分析软件结果挖取差异蛋白质点,委托北京华大基因公司进行基质辅助激光解吸/电离飞行时间串联质谱(MALDI-TOF-TOF/MS)分析。将所得到的肽片段质量数据运用MASCOT软件进行在线检索(http://www.matrixscience.com),选取NCBI数据库作为检索数据库。鉴定成功的蛋白质点根据aimGo数据库(http://www.geneontology.org/)功能注释进行分类统计。
2 结果与分析
2.1 双向电泳凝胶图谱分析和质谱鉴定
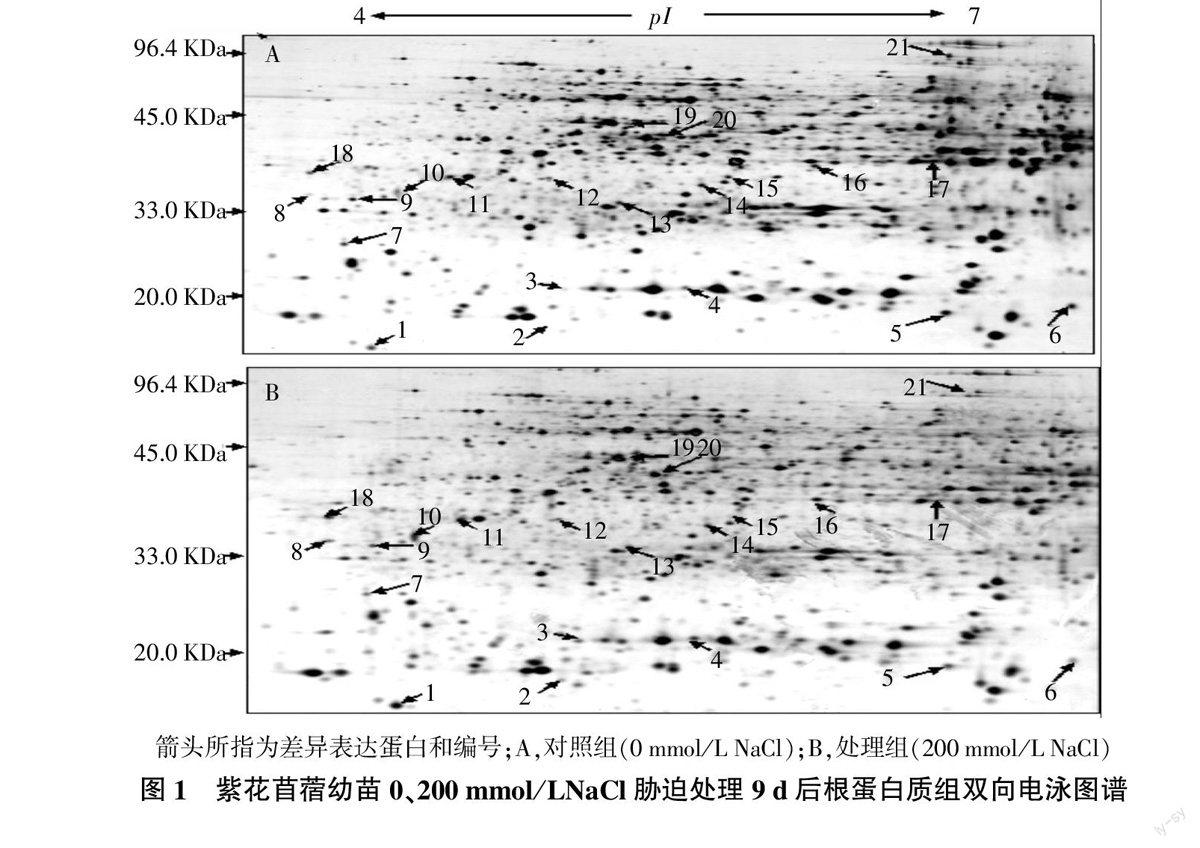
分别提取对照组和处理组紫花苜蓿根部蛋白质进行双向电泳,经银染后最终电泳图谱见图1。基于ImageMaster图像软件分析表明,对照组凝胶蛋白质点有(957±35)个,而处理组(200 mmol/L NaCl处理)凝胶上蛋白质有(935±27)个,两个试验组内变异系数都在5%以内。软件匹配和手工匹配相结合,最终处理组和对照组间有725个蛋白质点成功匹配。选取相对丰度(vol%)发生1.5倍改变的点为差异表达蛋白质点,结合 MALDI-TOF-TOF/MS 分析,Mascot 软件搜索NCBInr数据库Green Plants, 最终成功鉴定出21个蛋白质点,为19种不同的蛋白质(表1)。
2.2 差异表达蛋白质的功能分类
基于质谱结果, 将这些蛋白的功能分为以下五大类。
Ⅰ类:胁迫防御类蛋白,共有4个蛋白质点。谷胱甘肽过氧化物酶(Glutathione peroxidase,spot 3)、2个抗坏血酸过氧化物酶(Ascorbate peroxidase,spot 8,18)、病原相关蛋白2(Pathogenesis-related protein 2,spot 12)。
Ⅱ类:碳水化合物和能量代谢,共4个蛋白质点。线粒体苹果酸脱氢酶(Malate dehydrogenase mitochondrial,spot 6)、甘油醛-3-磷酸脱氢酶(Glyceraldehyde 3-phosphate dehydrogenases,spot 14)、线粒体ATP合酶β支链2(ATP synthase bate china 2 mitochondrial,spot 1)、核苷二磷酸激酶1(Nucleoside diphosphate kinase 1,spot 21)。
Ⅲ类:次级代谢,共5个蛋白质点。异甘草黄苷2′-甲基转移酶(Isoliquiritigenin 2′-O-methyltransferase,spot 7)、查尔酮还原酶(Chalcone reductase, spot 13)、3-异丙基苹果酸脱氢酶(3-Isopropylmalate dehydrogenase,spot 16)、异黄酮还原酶(Isoflavone reductase,spot 11);乙醇脱氢酶(Alcohol dehydrogenase,spot 17)。
Ⅳ类:转录、翻译和调节类蛋白,共4个蛋白质点。真核转录起始因子5A-2(Eukaryotic translation initiation factor 5A-2,spot 4)、热激蛋白70 (Heat shock protein 70,spot 5)、RNA结合蛋白(RNA-binding protein,spot 9)、mRNA结合蛋白前体(mRNA binding protein precursor,spot10)。
Ⅴ类:信号传导和离子转运相关蛋白,共3个蛋白质点。液泡膜联蛋白VCaB42(Vacuole-associated annexin VCaB42,spot 15)、膜联蛋白(Annexin,spot 19)、细胞质膜H+-ATP酶(Plasma membrane H+-ATPase,spot 2)。
3 讨论
3.1 胁迫防御类蛋白
生物正常的生理代谢过程,如光合成、光呼吸、脂肪酸氧化和衰老等都会产生活性氧(Reactive oxygen species,ROS),但当生物和非生物产生胁迫时,将引发ROS的迸发。ROS具有多种功能,一方面,低水平的ROS可作为信号传导分子,调控植物生长发育、细胞周期以及细胞程序化死亡、激素合成、生物或非生物的胁迫应答等;另一方面,过量ROS可导致蛋白质、膜脂和其他细胞组分的损伤,对植物的生长产生危害[9]。植物体内有多种ROS清除机制,以维持体内正常的ROS水平。在本研究中,3个过氧化物类酶表达量上调,其中包括2个抗坏血酸过氧化物酶(APX,8、18号)和1个谷胱甘肽过氧化物酶(GPX,3号)。APX和GPX分别以抗坏血酸和谷胱甘肽作为底物,与H2O2的亲合力较强,是植物体H2O2重要的清除剂。APX催化H2O2还原反应中产生的单脱氢抗坏血酸,通过谷胱甘肽还原酶途径被还原为抗坏血酸,而还原型谷胱甘肽作为还原剂参与抗坏血酸的再生,产生的氧化型谷胱甘肽可以通过谷胱甘肽还原酶得到还原,形成抗坏血酸-谷胱甘肽循环(Ascorbate-glutathione cycle),是植物清除H2O2的最主要途径。有研究认为,活性氧清除机制是植物抗盐碱机制的重要组成部分[10]。在本研究中活性氧清除蛋白质在盐胁迫下表达量均上升,这有利于清除盐胁迫引起的活性氧迸发,维持苜蓿细胞内部环境的稳定。
在本研究中还发现了病原相关蛋白2(Pathogenesis-related protein 2,PR2)在盐胁迫下表达量上升。病原相关蛋白是一类由真菌、细菌和病毒等病原体入侵诱导产生的抗逆性蛋白质,根据作用和功能的不同将其分为17个家族,本研究中鉴定的差异表达蛋白PR2属于β-1,3-葡聚糖酶家族,其以探明的功能包括水解真菌性病原菌的细胞壁,参与植物生长发育的各个阶段的调控[11]。在拟南芥(Arabidopsis thaliana)中发现盐胁迫下PR5蛋白质表达量下降,而在抗盐碱能力相对较强的盐芥(Thellungiella halophila)中,盐胁迫下PR5蛋白质表达量下降[12],这表明部分PR蛋白质也参与到盐胁迫调节。在此前的研究中还未发现PR2与盐胁迫响应相关,其功能还有待深入研究。
3.2 参与碳水化合物和能量代谢的相关蛋白
植物生长发育过程中需要大量的能量以维持体内正常的生理代谢,这些能量主要通过碳水化合物代谢,如糖酵解(Embden-Meyerhof-Parnas pathway,EMP)和三羧酸循环(Tricarboxylic acid cycle,TCA)产生。在本研究中,甘油醛-3-磷酸脱氢酶(glyceraldehyde 3-phosphate dehydrogenase,GAPDH,14号)在盐胁迫下表达量上升。GAPDH是糖酵解、糖异生和卡尔文循环过程中的关键酶,催化甘油醛-3-磷酸形成1,3-二磷酸甘油酸的可逆反应,是糖酵解(糖异生)中惟一的氧化(还原)反应。此前对水稻的研究表明,抗盐碱性水稻的材料中GAPDH蛋白表达量显著高于敏盐性材料,表明GAPDH的高表达可能与水稻抗盐碱相关[13]。另有研究表明,非磷酸化GAPDH(NP-GAPDH)可催化糖酵解“旁路”反应,催化依赖于NADP+,将3-磷酸甘油醛氧化为3-磷酸甘油酸,同时伴有NADPH生成的不可逆反应[14]。盐胁迫下,GAPDH的表达量上升一方面可为机体合成代谢提供还原力NADPH,维持胞质中NADPH的水平,另一方面在磷饥饿或ADP水平低下而无法合成ATP时,可以使碳源顺利流经糖酵解途径,保证逆境条件下碳源流的通畅[15]。本研究中,GAPDH在盐胁迫下表达量上升可能是苜蓿适应盐胁迫的调节机制。
线粒体是植物生成能量的主要细胞器,在本研究中鉴定出2个线粒体内蛋白质表达量发生改变。线粒体苹果酸脱氢酶属于NAD-依赖性MDH,其为三羧酸循环循环中的关键酶,催化苹果酸与草酰乙酸之间的可逆转换,生产ATP,为机体提供能量[16]。线粒体ATP合成酶参与氧化磷酸化和光合磷酸化,在跨膜质子动力势的推动下合成ATP,将能量用于合成生物中的能量通货-ATP的能量转换。这2个蛋白表达量的下降从一个侧面表明了盐胁迫下,紫花苜蓿能量代谢减缓,这与盐胁迫下光合作用受阻而导致碳水化学物合成减少相关。此外研究还鉴定出1个核苷二磷酸激酶1(NDPK1)在盐胁迫下表达量降低。NDPK被称为ATP的管家酶,维持细胞中CTP、GTP、UTP的水平。在植物中NDPK已被证明参与干旱、寒害、热和盐胁迫的抗逆中,在水稻小穗期响应盐胁迫的蛋白质研究中鉴定出该蛋白表达量下调[17]。
3.3 次生代谢相关蛋白质
植物在多条代谢途径中都会产生乙醇,但当特定外界胁迫时会导致体内乙醇积累,过量乙醇聚合成高活性的有毒分子,攻击细胞内亲核物质如核酸、蛋白和碳水化合物等,最终危害到植物的正常生长[18]。乙醇脱氢酶(ADH,17号)是植物体内主要短链醇代谢的关键酶,生理学功能为催化伯醇和醛之间的可逆反应。有研究表明,ADH的表达与干旱、低温、病原菌入侵等生物逆境的应答相关[19]。在本研究中,ADH在盐胁迫下表达量下降,这与此前在水稻中的研究观察到的结果相反[20],这可能与胁迫浓度和植物自身的抗盐碱差异性相关。
类黄酮化合物是植物合成的一类重要次生代谢产物,目前已知化学结构的有6 000多种,在植物生长发育中发挥着重要作用[21]。近期研究表明,类黄酮化合物还参与植物的胁迫防御中,如植物受微生物侵染时其作为植保素在植物体内积累,或作为植物体内活性氧的脱毒系统[22,23]。在鉴定的差异表达蛋白中有2个蛋白质与类黄酮代谢途径相关,其中包括查尔酮还原酶(13号)和查尔酮还原酶(11号)。查尔酮还原酶是查尔酮合成类黄酮代谢分支的第一步催化酶。查尔酮还原酶是合成植物抗毒素类异黄酮的重要酶。本研究中,这2个蛋白质表达量都呈现出下降的趋势,这表明盐胁迫下,类黄酮合成代谢减缓。
在鉴定的蛋白质中,3-异丙基苹果酸脱氢酶(16号)表达量下升,该蛋白质为异亮氨酸合成蛋氨酸过程中的催化蛋白酶。已有研究表明,异亮氨酸也是苜蓿抗渗透胁迫的因子[24]。本研究中该蛋白质表达量下调,有利于异亮氨酸的积累,可能是紫花苜蓿渗透调节机制之一。
3.4 参与转录调控,蛋白质合成和代谢类的蛋白质
植物感受到外界环境刺激,通过特定的受体将这一信号传递到细胞核,并诱导相关基因的表达来适应外界环境,在这过程中,受到复杂的转录、翻译和剪切修饰等调控。在鉴定的差异表达蛋白质中,有3个蛋白质参与到转录起始和转录调控,其中包括1个真核转录起始因子5A-2(eIF-5A-2,4号)和2个RNA结合蛋白质。eIF-5A是普遍存在于真核生物和原始细菌中的转录启始因子。已有研究表明,eIF-5A与细胞中的许多生命活动有关,如细胞增殖、蛋白质翻译、mRNA降解、细胞周期的转化及细胞衰老与凋亡等[25]。对拟南芥eIF-5A家族成员的分析表明,不同的家族成员参与的转录调控与植物不同的生理防御相关,其中eIF-5A-2参与拟南芥受到病毒感染和伤害后的信号传导,以及通过细胞分裂素信号通路调控拟南芥根木质部的发育,在细胞的分裂、生长和死亡中发挥着重要作用[24]。在本研究中,eIF-5A-2在盐胁迫下表达量上升,表明其表达与盐诱导相关。
基因表达的转录调控中每一步都需要大量的RNA结合蛋白质和RNA相互作用来起稳定、保护、组装和转移等作用。近年来的研究表明,一些RNA结合蛋白质参与动植物各种胁迫调控并发挥着重要生理功能,如富含甘氨酸RNA结合蛋白质调控植物逆境诱导反应,许多逆境因子,包括冷害、致伤、干旱、过敏和水逆境等均能诱导其表达量发生变化[26]。在本研究中mRNA结合蛋白质(10号)在盐胁迫下表达量下降,而RNA结合蛋白质(9号)表达量则上升,表明盐胁迫下紫花苜蓿在转录水平存在差异性调节机制。
盐胁迫会导致植物体内蛋白质错误折叠增加,重新建立正常的蛋白质折叠、构象对维持细胞内稳态尤为重要。热激蛋白70(Hsp70)是重要的分子伴侣,在维持蛋白质构象、阻止蛋白质聚合、重折叠变性蛋白质以及协助错误折叠蛋白质的降解等方面发挥着重要作用[27,28]。在本研究中,Hsp70(5号)在盐胁迫下表达量上升,这对维持体内蛋白质正常的生理功能有重要意义。
3.5 信号传导和离子转运相关蛋白
Ca2+是植物体内重要的信号分子,在受到多种胁迫时都会诱导细胞基质中Δ[Ca2+]cyt,特定的膜联蛋白质(Annexins)通过结合Δ[Ca2+]cyt而进行信息传递[29]。Annexins是一个多基因蛋白质,属于Ca2+依赖性的磷脂结合蛋白质家族成员,通过与磷脂的结合以及与钙离子的相互作用参与到各种膜有关的过程,其中包括信号传导、自由基清除、DNA复制和细胞凋亡等过程。目前,最少有3条线支持这一结论的证据:各种生物胁迫都会诱导Annexins表达量发生改变;改变某些Annexins的表达量将改变植物对非生物胁迫的耐受性;Annexins可能直接参与调节胁迫激活信号通路[30]。在本研究中,鉴定出2个膜联蛋白质表达量上升,分别为膜联蛋白质和液泡膜联蛋白VCaB42,这表明盐胁迫下紫花苜蓿信号传导发生改变。
将Na+转运到液泡,减少细胞质中Na+离子浓度是植物抗盐胁迫的重要机制之一。在本研究中细胞质膜H+-ATP酶(15号)表达量上升。质膜H+-ATPase主要作用是形成跨膜的质子梯度,驱动Na+/H+逆向转运蛋白质主动运输,进而将Na+区隔在液泡中,减少对细胞器的毒害[31]。盐胁迫下,该蛋白质表达量上升有助于降低细胞基质中盐离子的浓度,从而减小盐离子对植物的危害。
4 结论
根是植物感受多种胁迫伤害的最初位点,根对胁迫的敏感程度直接关系到植物的生长,对根系响应盐胁迫的研究有助于更深入了解盐胁迫的调节机制。在本研究中,鉴定出19个不同的蛋白质表达量发生改变,其中包括14个表达上调蛋白质,5个表达下降蛋白质。这些蛋白质中大部分蛋白质都是功能已知的蛋白质,此前在其他物种抗盐碱胁迫中也鉴定出,部分蛋白质在此前研究中未见报道,其具体功能还有待进一步验证。本研究为深入揭示紫花苜蓿响应盐胁迫的调节机制奠定了基础,也为挖掘紫花苜蓿潜在抗盐碱基因提供了数据。
参考文献:
[1] FAO.The state of the worlds land and water resources for food and agriculture (SOLAW)-Managing systems at risk [EB/OL].London:The Food and Agriculture Organization of the United Nations and Earthscan. http://www.fao.org/docrep/015/i1688e/i1688e00.pdf,2011.
[2] VINOCUR B,ALTMAN A. Recent advances in engineering plant tolerance to abiotic stress: Achievements and limitations[J]. Current Opinion in Biotechnology,2005,16(2):123-132.
[3] MAAS E, HOFFMAN G. Crop salt tolerance: Evaluation of existing data[A]. In: Managing Saline Water for Irrigation Proceedings of the International Salinity Conference Ed HE Dregne[C]: 1977. 187-198.
[4] LIMAMI A M, RICOULT C, PLANCHET E, et al. Response of Medicago truncatula to abiotic stress[EB/OL].http://www noble org/MedicagoHandbook,2007-06-15.
[5] POSTNIKOVA OA, SHAO J, NEMCHINOVL G. Analysis of the alfalfa root transcriptome in response to salinity stress[J]. Plant & cell physiology, 2013, 54(7):1041-1055.
[6] JIN H, SUN Y, YANG Q, et al. Screening of genes induced by salt stress from Alfalfa[J]. Molecular Biology Reports,2010, 37(2):745-753.
[7] ZHANG H, HAN B, WANG T, et al. Mechanisms of plant salt response: insights from proteomics[J]. J Proteome Res,2012, 11(1):49-67.
[8] XIONG J, YANG Q, KANG J, et al. Simultaneous isolation of DNA, RNA, and protein from Medicago truncatula L[J]. Electrophoresis,2011,32(2):321-330.
[9] LALOI C, APEL K, DANON A. Reactive oxygen signalling: The latest news[J]. Current Opinion in Plant Biology,2004, 7(3):323-328.
[10] ABOGADALLAH G M. Antioxidative defense under salt stress[J]. Plant Signal Behav, 2010, 5(4):369-374.
[11] BORAD V, SRIRAM S. Pathogenesis-related proteins for the plant protection[J]. Asian J Exp Sci, 2008, 22(3):189-169.
[12] PANG Q, CHEN S, DAI S, et al. Comparative proteomics of salt tolerance in Arabidopsis thaliana and Thellungiella halophila[J].Journal of Proteome Research,2010, 9(5):2584-2599.
[13] LIU C W, CHANG T S, HSU Y K, et al. Comparative proteomic analysis of early salt stress-responsive proteins in roots and leaves of rice[J]. Proteomics, 2014, 14(15):1759-1775.
[14] 卢 倩,弭晓菊,崔继哲.植物甘油醛-3-磷酸脱氢酶作用机制的研究进展[J].生物技术通报,2013,12(8):1-6.
[15] RIUS S P, CASATI P, IGLESIAS A A, et al. Characterization of Arabidopsis lines deficient in GAPC-1, a cytosolic NAD-dependent glyceraldehyde-3-phosphate dehydrogenase[J]. Plant Physiology, 2008, 148(3):1655-1667.
[16] 汪新颖,王 波,侯松涛,等.苹果酸脱氢酶的结构及功能[J].生物学杂志,2009,26(4):69-72.
[17] TANG L, KIM M D, YANG K S, et al. Enhanced tolerance of transgenic potato plants overexpressing nucleoside diphosphate kinase 2 against multiple environmental stresses[J]. Transgenic Research, 2008, 17(4):705-715.
[18] SCHAUENSTEIN E, ESTERBAUER H, ZOLLNER H. Aldehydes in biological systems[M]. London: Pion, 1977.
[19] 石之光,叶 磊,巩鹏涛,等.乙醇脱氢酶(ADH)家族生物信息学分析[J].基因组学与应用生物学,2009,28(3):429-432.
[20] SENGUPTA S,MAJUMDER A L.Insight into the salt tolerance factors of a wild halophytic rice,Porteresia coarctata:A physiological and proteomic approach[J].Planta,2009,229(4):911-929.
[21] 邹凤莲,寿森炎,叶纨芝,等.类黄酮化合物在植物胁迫反应中作用的研究进展[J].细胞生物学,2004,26(1):39-44.
[22] LIN C M,CHEN C T,LEE H H,et al. Prevention of cellular ROS damage by isovitexin and related flavonoids[J]. Planta Medica,2002,68(4):365-367.
[23] PICMAN A K,SCHNEIDER E F,PICMAN J.Effect of flavonoids on mycelial growth of Verticillium albo-atrum[J]. Biochemical Systematics and Ecology,1995,23(7):683-693.
[24] FENG H, CHEN Q, FENG J, et al. Functional characterization of the Arabidopsis eukaryotic translation initiation factor 5A-2 that plays a crucial role in plant growth and development by regulating cell division, cell growth, and cell death[J]. Plant Physiology, 2007, 144(3):1531-1545.
[25] 时广红,王彦珍,魏建华.eIF-5A与DHS功能研究及应用进展[J].生物技术通报,2009,21(5):21-26.
[26] 陈 璇,李文正,邵 岩,等.动植物中 RNA 结合蛋白的研究进展[J].生物技术通报,2007,25(3):9-15.
[27] WANG W,VINOCUR B,SHOSEYOV O,et al. Role of plant heat-shock proteins and molecular chaperones in the abiotic stress response[J]. Trends in Plant Science 2004,9(5):244-252.
[28] HARTL F U.Molecular chaperones in cellular protein folding[J]. Nature,1996,381(6583):571-579.
[29] MORTIMER J C,LAOHAVISIT A,MACPHERSON N,et al. Annexins:Multifunctional components of growth and adaptation[J].Journal of Experimental Botany,2008,59(3):533-544.
[30] KONOPKA-POSTUPOLSKA D,CLARK G,GOCH G,et al.The role of annexin 1 in drought stress in Arabidopsis[J].Plant Physiology,2009,150(3):1394-1410.
[31] SHI H,QUINTERO F J,PARDO J M,et al.The putative plasma membrane Na+/H+ antiporter SOS1 controls long-distance Na+ transport in plants[J].The Plant Cell Online,2002,14(2):465-477.
