Fenton羟自由基反应体系的修正
2015-11-26樊琛李燕曾庆华王会陆长民郑焕芹
樊琛 李燕 曾庆华 王会 陆长民 郑焕芹


摘要:通过单因素试验和正交试验探讨了FeS04溶液用量、水杨酸-乙醇溶液用量、H202溶液浓度、反应温度、反应时间对Fenton反应体系的影响,筛选出羟自由基反应体系的最优反应条件,并检测了乙醇体积分数、pH对反应体系的影响。结果表明,最佳反应条件为1.8 mmol/L的FeS04溶液2.50 mL,1.8 mmol/L的水杨酸-乙醇溶液2.00 mL,0.05% H202溶液0.10 mL,蒸馏水0.50 mL,20 ℃水浴10 min。反应体系的pH及待测液乙醇体积分数对反应体系有明显影响,建议待测液含乙醇时,应做相同体积分数乙醇对照组进行修正。
关键词:Fenton反应;羟自由基;分光光度法;水杨酸
中图分类号:S-3 文献标识码:A 文章编号:0439-8114(2015)21-5382-05
DOI:10.14088/j.cnki.issn0439-8114.2015.21.046
Correction of Fenton Hydroxy Radical Reaction System
FAN Chen, LI Yan, ZENG Qing-hua, WANG Hui, LU Chang-min, ZHENG Huan-qin
(College of Agricultural, Liaocheng University, Liaocheng 252059, Shandong, China)
Abstract:Through single factor experiment and orthogonal experiment were conducted to study the effects of FeS04 solution dosage, salicylic acid-ethanol dosage,H202 concentration, temperature, time of reaction system, screening out the optimum reaction conditions of hydroxyl free radical reaction system, and 1.8 mmol/L FeS04 solution for 2.50 mL,1.8 mmol/L of salicylic acid-ethanol solution 2.00 mL, 0.05% H202 solution 0.10 mL,0.50 mL of distilled water, in 20 ℃ water bath for 10 min. In addition, the effects of volume fraction of ethanol solution and the pH were also discussed. The results showed that pH and ethanol had obvious effects on the reaction system. The Control group should add ethanol with same concentration of experimental group.
Key words: Fenton reaction; hydroxyl radicals; spectrophotometric method; salicylic acid
羟自由基(·OH)消除率是反映药物抗氧化作用的重要指标[1-3]。在几种常用的羟自由基(·OH)检测方法中,分光光度法较高效液相色谱法和电子自旋共振法简便、直接,且由于其所需设备简单,而被广泛采用[4-8]。目前,常采用的方法是基于水杨酸可以捕获羟自由基(·OH)生成2,3-二羟基苯甲酸和2,5-二羟基苯甲酸,在波长510 nm处有最大吸收的原理,建立的用分光光度法检测Fenton反应产生的羟自由基(·OH)的方法[9]。但是·OH的化学反应活性强、存在寿命短[10,11],实际应用过程中易引起明显误差。
本试验以FeS04、H2O2、水杨酸-乙醇为反应体系,通过对影响反应体系的条件进行优化,筛选最佳反应条件,并对其稳定性进行检测。在此基础上,测定pH、乙醇等对羟自由基(·OH)反应体系清除率的影响,为修正羟自由基检测的实际应用提供理论依据。
1 材料与方法
1.1 材料
硫酸亚铁、水杨酸、30%过氧化氢、无水乙醇、盐酸、氢氧化钠、维生素C(抗坏血酸),所用试剂均为分析纯,试验用水为二次蒸馏水。
1.2 仪器与设备
UV-1800型紫外分光光度计(上海美谱达仪器有限公司);SB-2000型水浴锅(上海爱朗仪器有限公司);T-214型电子天平(北京赛多利斯仪器系统有限公司)。
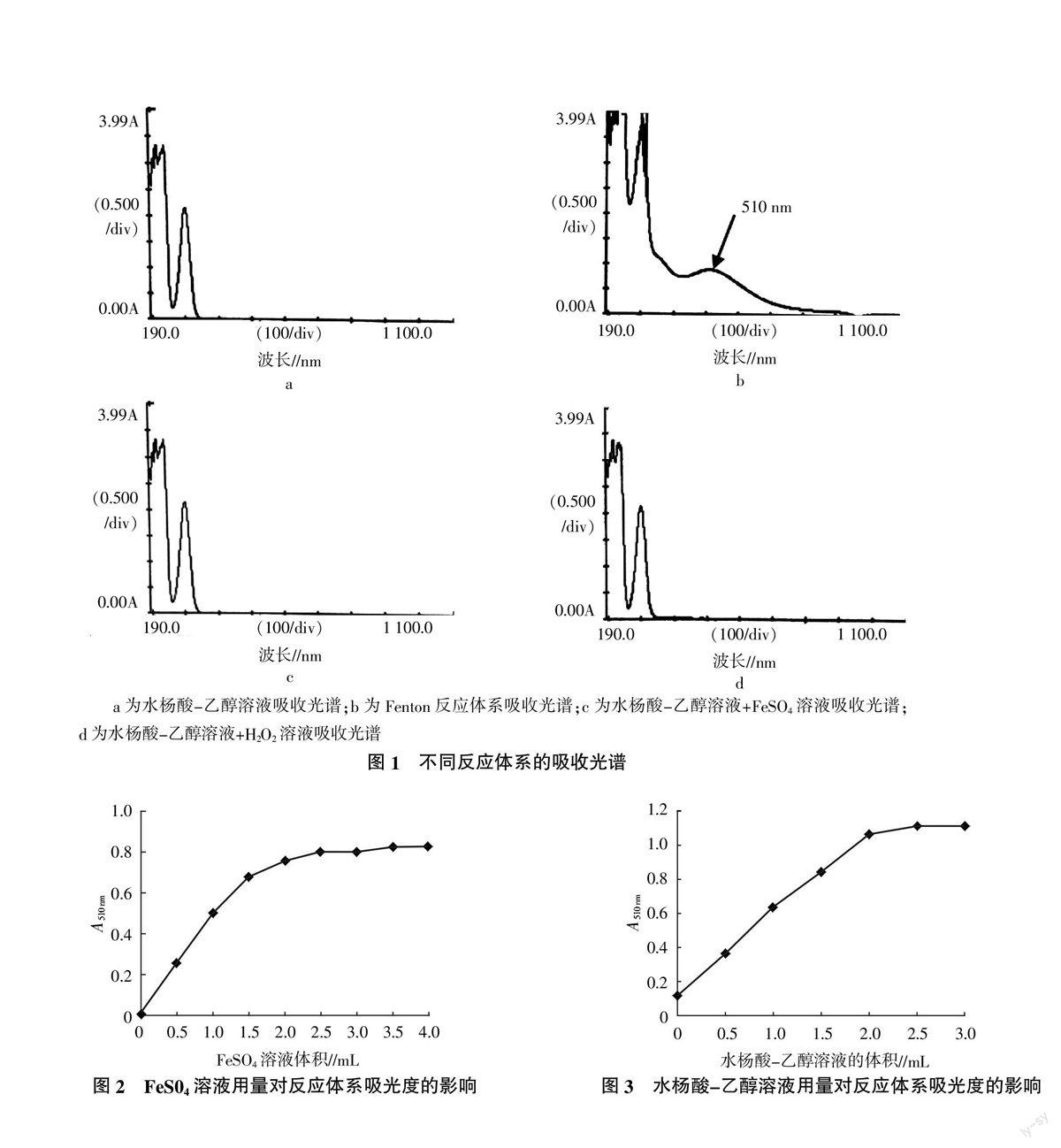
1.3 反应体系吸收光谱
取水杨酸-水溶液、水杨酸-乙醇-水溶液、水杨酸-乙醇溶液,在波长190~1 100 nm范围内分别测定吸收光谱。
第一组:向各试管中依次加入3.00 mL蒸馏水,水杨酸-乙醇1.50 mL,最后加 H2O2 (0.03%)0.10 mL振荡混合;第二组:向试管中依次加入1.00 mL蒸馏水,FeSO4溶液2.00 mL,水杨酸-乙醇1.50 mL,最后加 H2O2(0.03%) 0.10 mL,振荡混合;第三组:向各试管中依次加入1.10 mL蒸馏水,FeSO4溶液2.00 mL,水杨酸-乙醇1.50 mL;第四组:水杨酸-乙醇,各组均在37 ℃水浴中40 min,在波长190~1 100 nm处测定其吸光度,比较各组的吸收光谱图。
水杨酸-水溶液、水杨酸-乙醇-水溶液吸收光谱检测方法同上。
1.4 单因素试验
1.4.1 FeS04用量的影响 改变FeSO4溶液的体积,其他反应条件不变,考察FeSO4溶液不同用量对反应体系吸光度的影响。向各试管中依次加入FeSO4溶液,分别为0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 mL,水杨酸-乙醇1.50 mL,蒸馏水补足体积至5.5 mL,最后加 H2O2(0.03%) 0.10 mL,振荡混合,11 ℃条件下反应10 min,在510 nm处测定其吸光度。
1.4.2 水杨酸-乙醇溶液用量的影响 取水杨酸-乙醇溶液0、0.5、1.0、1.5、2.0、2.5、3.0 mL,其他条件不变,考察水杨酸-乙醇溶液不同用量对反应体系吸光度的影响。
1.4.3 H2O2体积分数的影响 加入不同体积分数(0、0.010%、0.025%、0.035%、0.050%、0.100%、0.150%、0.200%、0.250%、0.300%、0.350%)的H2O2溶液0.10 mL启动反应,其他条件不变,考察不同H2O2体积分数对体系吸光度的影响。
1.4.4 反应温度的影响 在不同温度条件下8、13、17、22、27、32、37、42、46 ℃反应,其他条件不变,考察不同温度对体系吸光度的影响。
1.4.5 反应时间的影响 反应1、2、3、4、5、6、7、8、9、10、11、12、13、14、15 min,其他条件不变,考察不同反应时间对体系吸光度的影响。
1.5 正交试验设计
上述单因素试验表明温度和时间两个因素对反应体系的影响不明显。因此,确定FeSO4溶液用量,水杨酸-乙醇溶液用量,H2O2溶液体积分数为正交试验的三个因素,分别记作A、B、C,各因素均取3个水平,正交试验因素和水平见表1。
1.6 验证试验
1.6.1 动力学试验 根据正交试验最优组合,向试管中依次加入蒸馏水0.50 mL,FeSO4溶液2.50 mL,水杨酸-乙醇溶液2.00 mL,最后加入0.05%的H2O2溶液0.10 mL。加入H2O2溶液后立即(时间控制在15 s内)倒入比色皿中,在510 nm处测定其吸光度,每隔5 s测一次。
1.6.2 乙醇的影响 在试管中依次加入FeSO4溶液2.50 mL,水杨酸-乙醇溶液2.00 mL,不同体积分数乙醇溶液(0、30%、50%、70%)以及无水乙醇0.5 mL,H2O2(0.05%) 0.10 mL,振荡混合,20 ℃水浴10 min,在510 nm下测量其吸光度。
1.6.3 pH的影响 在各试管中依次加入蒸馏水0.50 mL,FeSO4溶液2.50 mL,水杨酸-乙醇溶液2.00 mL,加H2O2(0.05%)0.10 mL,用盐酸溶液或氢氧化钠溶液调节各试管反应体系的pH,分别为2.0、3.0、3.5、4.0、6.0、6.2、6.4、6.7、7.0,20 ℃水浴10 min,在510 nm下测量吸光度。
1.6.4 VC对羟自由基的清除作用 在试管中依次加入FeSO4溶液2.50 mL,水杨酸-乙醇溶液2.00 mL,不同质量分数的VC溶液(0、50、100、150、200、300、400、500 μg/mL)0.5 mL,H202(0.05%) 0.10 mL,振荡混合,20 ℃水浴10 min,在510 nm下测量吸光度。自由基清除率计算公式为:
D=[(AO-As)/AO]×100%
式中,AO为空白管的吸光度值,As为加入自由基清除剂后的吸光度值。
2 结果与分析
2.1 Fenton反应体系吸收光谱
Fenton反应体系在510 nm波长处有吸收峰,而水杨酸-乙醇溶液单独与FeSO4或者H2O2反应时在510 nm波长处没有明显的光吸收(图1),说明水杨酸溶液作为捕捉剂可捕捉Fenton试剂产生的羟自由基(·OH),产物在510 nm波长有特征吸收峰,因此选用510 nm波长为测定波长。
由图1可见,吸收光谱b与a、c、d在510 nm波长处有明显差异,表明FeSO4溶液与H2O2溶液单独使用时几乎不与水杨酸作用产生有色物质,反应体系产生的紫红色物质为羟自由基与水杨酸作用产生的。试验结果表明,水杨酸-乙醇溶液、水杨酸-水溶液、水杨酸-乙醇-水溶液,3种溶液的特征光吸收相近,由于水杨酸晶体易溶于乙醇,故反应体系选用水杨酸-乙醇溶液。
2.2 单因素试验结果
2.2.1 FeSO4用量的影响 如图2所示,随着FeSO4溶液用量的增大,反应体系颜色逐渐加深,反应体系的吸光度增大,当FeSO4溶液用量增大到2.0 mL后,吸光度变化逐渐趋于平稳,再增加FeSO4溶液的用量对反应体系吸光度无明显影响。
2.2.2 水杨酸-乙醇溶液用量的影响 随着水杨酸-乙醇溶液用量增加,反应体系颜色逐渐加深。 如图3所示,随着水杨酸-乙醇溶液用量的增加,反应体系吸光度增大,当水杨酸-乙醇溶液用量达到2.0 mL后,反应体系吸光度趋于平稳,再增加水杨酸-乙醇溶液的用量对反应体系无明显影响。
2.2.3 H2O2体积分数的影响 随着H2O2体积分数的增加,反应体系颜色逐渐加深。如图4所示,随H2O2溶液体积分数的增大,吸光度随之增大,H2O2溶液体积分数在0~0.035%之间对反应体系吸光度的影响明显,当H2O2溶液体积分数大于0.035%后,吸光度趋于平稳,再增大H2O2溶液的体积分数对反应体系无明显影响。
2.2.4 反应温度的影响 随着反应温度的变化,反应体系颜色无明显差异。如图5所示,在17~22 ℃之间,反应体系吸光度较高;反应温度大于22 ℃或小于17 ℃,反应体系吸光度值降低,但降低的程度不明显。
2.2.5 反应时间的影响 随反应时间增长,反应体系颜色无明显变化。如图6所示,在反应1 min时,其吸光度为0.849,随着反应时间的增加,反应体系吸光度变化不明显,表明反应时间对体系影响不明显。
单因素试验结果表明,FeSO4溶液用量,水杨酸-乙醇溶液用量和H2O2溶液体积分数3个因素对反应体系的影响明显,而温度和时间对反应体系的影响不明显。
2.3 正交试验结果
采用四因素三水平的正交试验方法,研究不同因素对Fenton反应体系的影响,正交试验结果见表2。由表2可见,RC>RA>RB,各因素对Fenton反应体系影响的主次顺序为C、A、B。即H2O2溶液的体积分数影响最大,其次是FeSO4溶液的用量,而水杨酸-乙醇溶液用量的影响最小。A3B2C3为最优组合,即:FeSO4溶液的用量为2.50 mL,水杨酸-乙醇溶液的用量为2.00 mL,H2O2溶液的体积分数为0.05%,用量为0.10 mL,加水量为0.50 mL。
2.4 验证试验
2.4.1 动力学试验 如图7所示,反应体系在最初75 s内就产生了较多的羟自由基,在170 s时,吸光度达到1.003,此后吸光度值无明显变化。
2.4.2 不同体积分数乙醇的影响 如图8所示,不同体积分数(30%、50%、70%)的乙醇溶液以及无水乙醇对Fenton反应体系有明显影响。随着乙醇体积分数的增大,反应体系吸光度值逐渐降低,表明乙醇可消除部分羟自由基。因此,实际应用时,若待测液中含有乙醇,应做相同体积分数的乙醇对照来修正待测液的羟基自由基清除率,避免出现假阳性结果。
2.4.3 pH的影响 如图9所示,反应体系pH 2.0~7.0时,其吸光度先升高后降低。pH小于4.0及大于6.4时反应体系的吸光度值较小,当体系pH大于7.0时,易产生沉淀。因此,反应体系较合适的pH范围为4.0~6.4,最适pH范围为6.0~6.4。
2.4.4 维生素C对羟自由基的清除作用 维生素C溶液可显著清除Fenton体系产生的羟自由基。由图10可见,当维生素C的质量分数达到200 μg/mL时,反应体系的羟自由基清除率可达100%。维生素C(抗坏血酸) 是一种有效的自由基清除剂,它通过逐级供给电子而转变成脱氢抗坏血酸,以清除羟自由基(·OH)等自由基[12]。
3 小结
1)在单因素试验中FeSO4溶液、水杨酸-乙醇溶液、H2O2溶液3个因素对反应体系的影响明显,而温度和时间对反应体系的影响不明显。
2)最适体系为:1.8 mmol/L FeSO4溶液2.50 mL,1.8 mmol/L水杨酸-乙醇溶液2.00 mL,0.05%的H2O2溶液0.10 mL,蒸馏水0.50 mL,20 ℃水浴10 min,在波长510 nm下测定吸光度。
3)最适反应体系的pH为6.0~6.4;待测液的乙醇体积分数对反应体系有影响,实际应用中应对待测液的pH及乙醇体积分数做对照组修正。
参考文献:
[1] 杨 芬,张瑞萍,贺玖明.羟自由基的产生、捕集及检测方法[J].药学学报,2007,42(7):692-697.
[2] 颜 军,苟小军,邹全付,等.分光光度法测定Fenton反应产生的羟基自由基[J].成都大学学报(自然科学版),2009(6):91-93.
[3] 王仕良,张 曾,黄干强.羟基自由基的产生与测定[J].造纸科学与技术,2003,22(6):45-47.
[4] STOKES N J,TABNER B J,HEWITT C N.Determination of hydroxyl radical concentration in environmental chambers using electron spin resonance[J]. Arch Biochem Biophys,1990,278(2):478-481.
[5] STEINER M G,BABBS C F.Quantitation of the hydroxyl radical by reaction with dimethyl sulfoxide[J]. Arch Biochem Biophys,1994,278(2):478-481.
[6] 徐向荣,王文华,李牛斌.比色法测定Fenton反应产生的羟自由基及其应用[J].生物化学与生物物理进展,1999,26(1):67-69.
[7] 朱琳娜,何争光,昊 超.NR光度法测定Fenton试剂所生成的羟基自由基[J].福建分析测试,2006,15(3):10-12.
[8] 方光荣,刘 洁,刘丽虹.分光光度法测定中药对羟自由基的清除率[J].湖北大学学报(自然科学版),2004,26(2):151-154.
[9] 于怀东,项 念,杨 扬.锰离子对Fenton反应的影响[J].武汉大学学报(理学版),2006,52(4):453-457.
[10] 冯慧萍,李亦聪.羟自由基与水杨酸反应机理的初探[J].光谱实验室,2009,26(4):931-938.
[11] 杨明惠,何丽仙,李珍贵.分光光度法测定Fenton体系中产生的羟自由基[J].大理学院学报,2007,6(4):38-40.
[12] 阿吉姑·阿布都热西提,买尔旦·马合木提,马合木提·乌斯满,等.维生素C清除自由基能力3种检测方法的比较[J].新疆医科大学学报,2008,31(5):578-579.
