Fmoc固相合成生长激素释放肽-2
2015-11-26王小青尹志峰王良友河北省中药研究与开发重点实验室承德医学院中药研究所河北承德067000
王小青,郑 霄,尹志峰,王良友(河北省中药研究与开发重点实验室/承德医学院中药研究所,河北承德 067000)
Fmoc固相合成生长激素释放肽-2
王小青,郑 霄,尹志峰,王良友
(河北省中药研究与开发重点实验室/承德医学院中药研究所,河北承德 067000)
GHRP-2;Fmoc固相合成;纯化
生长激素释放肽(GHRP)于20世纪70年代末、80年代初依据蛋氨酸-亮氨酸脑啡肽的结构首次合成[1],之后又合成了数种类型的GHRP[2]。研究发现,结构改造后的GHRP-2(又名KP-102,药品名为Pralmorelin,氨基酸序列为D-Ala-(D-β-naphthyl)-Ala-Trp-D-Phe-Lys-NH2)具有更强的刺激生长激素释放和改善儿童生长激素缺乏症的作用[3-4]。2004年,Pralmorelin用于治疗身材矮小症的Ⅱ期临床试验已在日本开始进行[5]。GHRP造价低廉,给药简便,在下丘脑生长激素释放激素无效时仍可产生作用,不影响或少影响生长素的内源节律性释放,具有明显的药物发展前景[2,5]。
20世纪90年代末,王勤等[6-8]采用Merrifild固相法合成了生长激素释放肽并对其活性进行了测定。但现有的制备方法操作难度大,不利于工业生产,而我们也未检严守纪律到国内以Fmoc固相合成方法合成生长激素释放肽的文献。本研究以GHRP-2为研究对象,采用Fmoc固相合成策略,优化合成工艺,合成了含有3个D型氨基酸的GHRP-2,以期为工业化量产提供参考。
1 仪器与试剂
1.1 仪器 戴安U3000高效液相色谱仪(UV检测器,美国戴安公司),Newstyle型反相高效半制备液相色谱仪(苏州汉邦科技有限公司),戴安液相色谱质谱联用仪Ultimate 3000/ MSQ(美国戴安公司),CHRIST冻干机(北京博励行仪器有限公司),高速大容量离心机(上海安亭科学仪器厂)。
1.2 试剂 固相合成载体Rink-Amide-AM树脂(天津南开合成科技有限公司,替代度为0.58mmol/g),肽链中所有保护氨基酸(成都诚诺新技术有限公司),HOBt、DIC(苏州中科天马肽工程中心有限公司),冰乙醚、TFA(天津市风船化学试剂科技有限公司),哌啶、苯甲硫醚、间甲酚与苯甲醚(上海晶纯试剂有限公司),EDT(Sigma-Aldrich),DMF(天津市科密欧化学试剂有限公司),DCM(天津博迪化工股份有限公司)。
2 方法与结果
2.1 Fmoc-Lys(Boc)-Rink Amide-AM树脂的制备 在洗净并干燥的反应柱中,加入896.2mg(0.5mmol)Rink Amide-AM树脂,加DMF通氮气溶胀30min,充分溶胀后抽掉DMF,加入适量DBLK溶液(哌啶/DMF(V/V)=1:4)脱Fmoc保护基两次,时间分别为5min和7min,茚三酮检测合格后,用DMF和DCM分别洗涤树脂,抽干溶剂。称942.0mg(2 mmol)Fmoc-L-Lys(Boc)-OH 和27.1mg HOBt(2mmol)溶于DMF,冰浴并加入310μl(2mmol)DIC活化5min,加入反应柱反应,茚三酮检测合格后,抽干,分别用DMF与DCM洗涤树脂,并进行替代度检测,加入11ml的醋酸酐与吡啶(V/V,6:5)混合液封闭14小时。冲洗树脂,加甲醇收缩两次(5min/次),减压干燥至恒重,得干燥树脂0.971g。
2.2 GHRP-2逐 步 偶 联 将2.1制 备 的Fmoc-Lys(Boc)-Rink Amide-AM树脂置于反应柱中,加入DMF溶胀30 min,按照附表进行氨基酸偶联,偶联结束后脱去最后一个氨基酸氨基并用甲醇收缩树脂,抽干并称重得GHRP-2肽树脂1.185g。
偶联D-Phe、D-βNal和D-Ala三个D型氨基酸时反应时间控制在120min以内,反应时间在100min时茚三酮检测合成效果最好,反应时间越长,粗肽HPLC检测杂质越多,得率也较低。GHRP-2序列中含有疏水性氨基酸Ala,Phe以及D-βNal等,在反应的过程中添加N-甲基-2吡咯烷酮(NMP)来增强疏水性氨基酸的溶解性,加快反应。见附表:
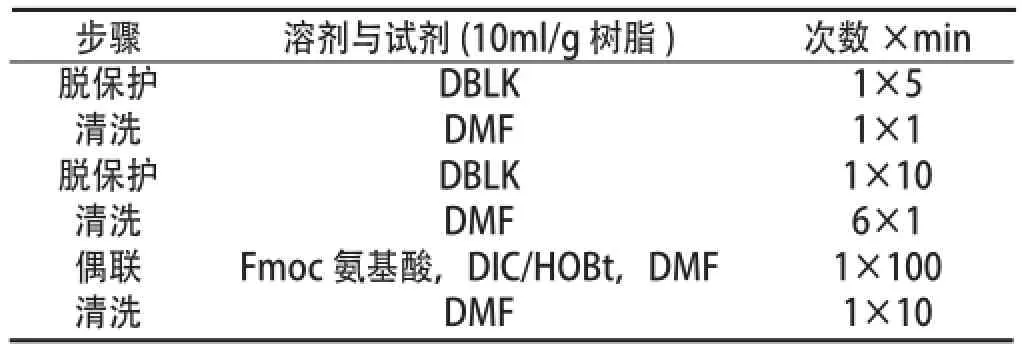
附表 固相Fmoc保护策略偶联反应的一般程序
2.3 肽树脂的裂解 平行称取干燥至恒重的GHRP-2-Rink Amide-AM树脂200.0mg 3 份,置于玻璃烧瓶中,分别加入裂解液①TFA:间甲酚(99:1)、②TFA:苯甲硫醚:EDT:苯 甲 醚(9:0.5:0.3:0.2)、③TFA:EDT:间 甲 酚(9.5:0.4:0.1)各2ml,冰浴反应30min,逐渐升至室温,于室温下反应1h。过滤,用少许TFA洗涤树脂,将滤液倾入40ml无水冰乙醚中,析出白色固体,0℃静置沉降20min。4000 r/min离心4min,弃去上清液,重复5次,真空干燥至恒重,得白色固体。
2.4 粗肽的纯化与鉴定 粗肽无氧水溶解,加少量醋酸助溶,置于4℃冰箱放置过夜。半制备液相条件:半制备柱Hedera ODS-2反相硅胶柱(20×250mm,10μm);检测波长215nm;采用乙腈/0.1%TFA水分离体系,流速8ml/min,乙腈25%-55%,洗脱时间30min。纯化后样品经戴安U3000高效液相分析,反相柱Kromasil C18(4.6×250mm,5μm),以乙腈/水为分析体系(0.1%TFA),乙腈5%-95%,流速1ml/ min,20min梯度洗脱,检验洗脱液纯度。粗肽纯度为80%,经半制备液相纯化得GHRP-2纯度大于99.0%。结构经ESIMS分析确证,质谱图显示[M+H]+峰m/z 818.6,[M+H]2+ 峰m/z 410.0,质谱数据与理论值相符。
3 讨论
GHRP-2含有D-氨基酸和β-氨基酸,产物结构与活性密切相关,环境对产物影响较大,易发生消旋、氧化等副反应,产率也较其它多肽产品低。本研究选择消旋率小的缩合体系,控制反应时间和反应温度,优化裂解条件和纯化手段得到纯度大于99.0%的目标产物。
固相合成中固相载体的选择非常关键,不仅关系到合成速率,对合成目标肽的纯度、收率都有重要的影响。本研究选用的Rink Amide-AM树脂主要用来合成末端羧基氨基化的多肽[9-10],同时,在实验过程中对不同替代度的树脂进行了比较,发现树脂替代度在0.4-0.45mmol/g时产物的得率和纯度最好。根据氨基酸种类选择三种裂解液配比与裂解方法进行了平行比较,结果粗肽得率无统计学差异。因此,本研究选择成本最低的TFA:间甲酚=99:1进行裂解。温度、反应时间和裂解试剂剂量是实验中重要的影响条件。
采用F moc固相合成方法合成GHRP-2,该方法简单,目标产物得率与纯度较高,能够为工业化量产提供理论依据。
[1]Bowers CY, Momany F, Reynolds GA, et al. Structure-Activity Relationships of a Synthetic Pentapeptide that Specifically Releases Growth Hormone in Vitro[J]. Journal of Endocrinological Investigation, 1980,106(3):663-670.
[2]陈晨.生长素释放肽的发现、发展及展望[J].基础医学与临床,2002,22(1):1-5.
[3]Wu D, Chen C, Katoh K, et al. The effect of GH-Releasing Peptide-2 (GHRP-2 or KP 102) on GH secretion from primary cultured ovine pituitary cells can be abolished by a specific GH-Releasing Factor (GRF) receptor antagonist[J]. Journal of Endocrinological Investigation, 1994, 140(2):R9-13.
[4]Pralmorelin.改善儿童生长激素缺乏症[J].国外医药-合成药生化药制剂分册,1999,20(2):81-82.
[5]厉保秋.多肽药物研究与开发[M].北京:人民卫生出版社,2011.185.
[6]王勤,高立伟,胡小愚,等.生长激素释放肽(GHRP)的合成及促生长效应[J].兰州大学学报(自然科学版),1996,32(1):98-101.
[7]嘉庆,高立伟.生长激素释放肽的合成及促生长作用研究[J].西南工学院学报,2000,15(4):26-29.
[8]胡晓愚,王勤.生长激素释放肽的合成及促生长活性[J].生物化学与生物物理进展,1995,22(6):549-552.
[9]王德心,冯鹤鹤,杨潇骁,等.活性多肽与药物开发[M].北京:中国医药科技出版社,2008.489.
[10]郑彦慧,张艳平,张浩.Rink Amide树脂结构对多肽合成的影响研究[J].离子交换与吸附,2008,24(6):563-569.
(技术方法栏目编辑:张 健)
R914.5
A
1004-6879(2015)02-0144-03
2014-09-13)
