重组人干扰素β-1a注射液对大鼠肝纤维化模型的治疗作用
2015-11-26林孝发张微微王中汉田建明
王 妍,林孝发,张微微,韦 康,王中汉,田建明*
(1.深圳职业技术学院,广东深圳518044;2.吉林省中医药科学院,长春130021;
3.吉林大学第二临床医院,长春130041)
重组人干扰素β-1a注射液对大鼠肝纤维化模型的治疗作用
王 妍1,林孝发1,张微微2,韦 康2,王中汉3,田建明2*
(1.深圳职业技术学院,广东深圳518044;2.吉林省中医药科学院,长春130021;
3.吉林大学第二临床医院,长春130041)
目的 研究重组人干扰素β-1a注射液及白蛋白注射液对肝纤维化大鼠的治疗作用。方法 通过给大鼠灌服50%的四氯化碳花生油溶液1 mL/kg,每周2~3次,5周后开始使用受试药物(隔日注射1次),同时继续同上灌服50%的四氯化碳花生油溶液。9周后取血、取肝脏,测定血清ALT、AST、TP、ALB、TBIL,测定肝组织羟脯氨酸含量,并对肝脏做病理组织学检查。结果 干扰素β-1a、白蛋白注射液均能明显降低肝纤维化模型大鼠血清的ALT、AST、TBIL,能明显升高肝纤维化大鼠血清ALB、ALB/GLB,且能明显降低肝纤维化大鼠肝组织羟脯氨酸含量。结论 干扰素β-1a、白蛋白注射液对肝纤维化模型大鼠的肝纤维化程度均有明显的抑制作用。
重组人干扰素β-1a注射液;白蛋白注射液;大鼠肝纤维化模型
肝纤维化是指由各种致病因子所致肝内结缔组织异常增生,导致肝内弥漫性细胞外基质过度沉淀的病理过程,如病毒性肝炎,酒精性肝炎及一些自身免疫疾病都可发展导致肝纤维化[1]。目前临床对于肝纤维化的治疗主要是针对原发疾病的处理以及一些护肝、抑制炎性增生的治疗措施,而具体对于抗纤维化的治疗仍是缺乏的。在80年代早期,Tacobs最早开始人干扰素方面的研究,至今已取得了飞跃性的发展。现在β-la和β-1b干扰素(IFN)均已在全世界范围内用于多发性硬化(MS)复发及缓解期的治疗,并取得了满意的疗效[2-4]。本项目组曾报道[5]重组人干扰素β-1a对BALB/C小鼠硬化症的疗效评价,证实重组人干扰素β-1a对小鼠硬化症模型有明显的改善作用,本文继续就本院自主研发的重组人干扰素β-1a及白蛋白注射液在治疗大鼠肝纤维化的机制方面做进一步的探讨。报道如下。
1 实验材料
1.1 动物 Wistar大鼠80只,雄性,体质量100~120 g,购自辽宁长生生物技术有限公司,许可证号:SCXK(辽)2010-0001。
1.2 受试药物 重组人干扰素β-1a注射液(简称β-1a),浓度0.22 mg/mL,活性3.2×106IU/mL,批号20140701,深圳职业技术学院提供;白蛋白注射液,浓度0.17 g/mL,批号20140801,深圳职业技术学院提供;利比(进口重组人干扰素β-1a注射液),规格:22 μg/0.5 mL,产品批号:BA003059,由默克雪兰诺公司意大利药厂提供。
1.3 试剂 苯巴比妥,分析纯,含量≥99% ,天津化学试剂三厂,生产批号:20140518;谷丙转氨酶(ALT)试剂盒,深圳迈瑞医疗电子股份有限公司,批号140114032;谷草转氨酶(AST)试剂盒,深圳迈瑞医疗电子股份有限公司,批号140214024;总胆红素(TBIL)试剂盒,深圳迈瑞医疗电子股份有限公司,批号140215004;总蛋白(TP)试剂盒,深圳迈瑞医疗电子股份有限公司,批号140813021;白蛋白(ALB)试剂盒,深圳迈瑞医疗电子股份有限公司,批号140914018;羟脯氨酸测定试剂盒:由南京建成生物工程研究所提供;规格:50T/48样,生产批号20141219,有效期至20150618。
1.4 仪器 迪瑞CS-600B全自动生化分析仪;GFD800型半自动生化分析仪,山东高密彩虹分析仪器有限公司。
2 方法
2.1 肝纤维化模型制备[6-8]取Wistar雄性大鼠80只,将造模大鼠先自由饮用35 mg/dL的苯巴比妥溶液,2周后灌胃给予50%的四氯化碳花生油溶液1.0~1.2 mL/kg体质量,每周2~3次,共9周。
2.2 分组 在灌胃给予50%的四氯化碳造模的第5周,将造模大鼠分成5组:模型组、阳性药利比组、白蛋白注射液组、β-1a干扰素低、高剂量组,另一组为正常对照组。
2.3 剂量设计 阳性对照药利比,22 μg/0.5 mL,临床用量1~4周内22 μg/人,即0.314 3 μg/kg(人均体质量按70 kg计),折算成大鼠的剂量为2.05 μg/kg(5.6×105IU/kg);β-1a大鼠的低、高剂量分别为5.6、11.2×105IU/kg;阳性对照药白蛋白注射液,浓度为0.17 mg/mL,按1 mL/kg的容积给药,剂量为0.17 mg/kg。2.4 给药途径及频次 途径:造模的第5周开始,各组按上述剂量分别注射各受试药物(干扰素β-1a皮下注射、白蛋白腹腔注射、利比皮下注射),隔日1次,共计给药5周。给予受试药期间仍然继续按前述剂量灌胃给予50%的四氯化碳,直到试验结束。
2.5 取材 末次给药后24 h,6%水合氯醛麻醉,腹主动脉取血,3 000 r/min离心5 min,取血清备用;取肝组织称重;取肝组织约80 mg备用;再取肝组织(一个肝叶),置10%福尔马林溶液中固定备用。
2.6 检测指标
2.6.1 血清生化指标 血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、总蛋白(TP)、白蛋白(ALB)、总胆红素(TBIL)。
2.6.2 肝组织羟脯氨酸含量 方法:取80 mg左右的肝组织,按照羟脯氨酸试剂盒说明书Ⅵ(样本减水解法)进行操作及计算含量。
2.6.3 病理组织学检查 取肝用10%的福尔马林溶液固定,常规石蜡包埋,切片,HE染色,进行病理组织学检查,照相。
3 结果
3.1 对肝纤维化大鼠体质量及肝脏脏体系数的影响见表1。
表1 干扰素β-1a、白蛋白对肝纤维化大鼠体质量及肝脏脏体系数的影响(±s)

表1 干扰素β-1a、白蛋白对肝纤维化大鼠体质量及肝脏脏体系数的影响(±s)
注:与正常组比较 ,###P<0.001;与模型组比较 ,△P<0.05
脏体系数正常对照组 12 574.9±41.46 13.57±1.02 2.37±0.17模型组 14 439.6±43.97### 14.91±2.93 3.38±0.53###β-1a 5.6×105IU/kg组 13 459.0±34.93 15.33±1.81 3.35±0.43 β-1a 11.2×105IU/kg组 12 490.4±47.03△ 15.58±2.25 3.19±0.47白蛋白0.17 mg/kg组 13 463.0±42.92 13.39±2.68 2.99±0.42△利比5.6×105IU/kg组 11 459.5±31.16 14.35±2.15 3.12±0.39组 别 n 体质量/g 肝脏重/g
3.2 对肝纤维化大鼠血清生化指标的影响见表2。
表2 干扰素β-1a对肝纤维化大鼠血清生化指标的影响(±s)
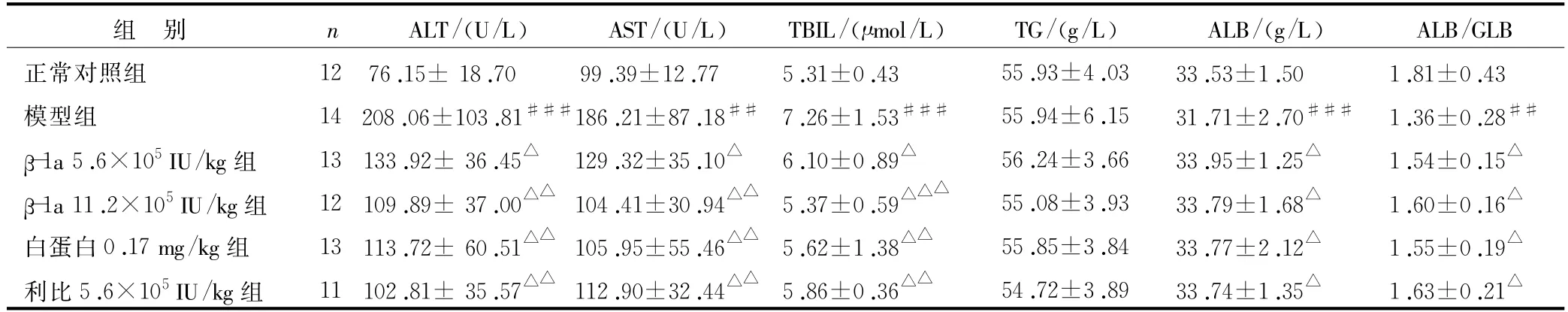
表2 干扰素β-1a对肝纤维化大鼠血清生化指标的影响(±s)
注:与正常组比较,##P<0.01,###P<0.001;与模型组比较,△P<0.05,△△P<0.01,△△△P<0.001
GLB正常对照组 12 76.15±18.70 99.39±12.77 5.31±0.43 55.93±4.03 33.53±1.50 1.81±0.43模型组 14 208.06±103.81###186.21±87.18## 7.26±1.53### 55.94±6.15 31.71±2.70### 1.36±0.28##β-1a 5.6×105IU/kg组 13 133.92±36.45△129.32±35.10△ 6.10±0.89△ 56.24±3.66 33.95±1.25△ 1.54±0.15△β-1a 11.2×105IU/kg组 12 109.89±37.00△△104.41±30.94△△ 5.37±0.59△△△ 55.08±3.93 33.79±1.68△ 1.60±0.16△白蛋白0.17 mg/kg组 13 113.72±60.51△△105.95±55.46△△ 5.62±1.38△△ 55.85±3.84 33.77±2.12△ 1.55±0.19△利比5.6×105IU/kg组 11 102.81±35.57△△112.90±32.44△△ 5.86±0.36△△ 54.72±3.89 33.74±1.35△ 1.63±0.21组 别 n ALT/(U/L) AST/(U/L) TBIL/(μmol/L) TG/(g/L) ALB/(g/L) ALB/△
3.3 对肝组织羟脯氨酸含量的影响 见表3。
3.4 病理组织学检查 病理形态观察结果判定。纤维化程度分期[9]:0期,无纤维化;1期,汇管区扩大,轻度纤维化;2期,汇管区周围纤维化,纤维隔形成,小叶结构保留;3期,纤维隔伴小叶结构紊乱,无肝硬化;4期,早期肝硬化。光镜下阅片,观察组织病理学改变,对评分数据进行统计分析。结果,正常组12只全部为0期;模型组有2只为3期、12只为4期;β-1a干扰素5.6×105IU/kg组有4只为2期、3只为3期、6只为4期;β-1a干扰素11.2×105IU/kg组有1只为2期、3只为2期、4只为3期、4只为4期;白蛋白组有1只为2期、7只为3期、5只为4期;利比组有3只为2期、3只为3期、5只为4期。
表3 干扰素β-1a对肝纤维化大鼠肝组织羟脯氨酸含量的影响(±s) μg/mg
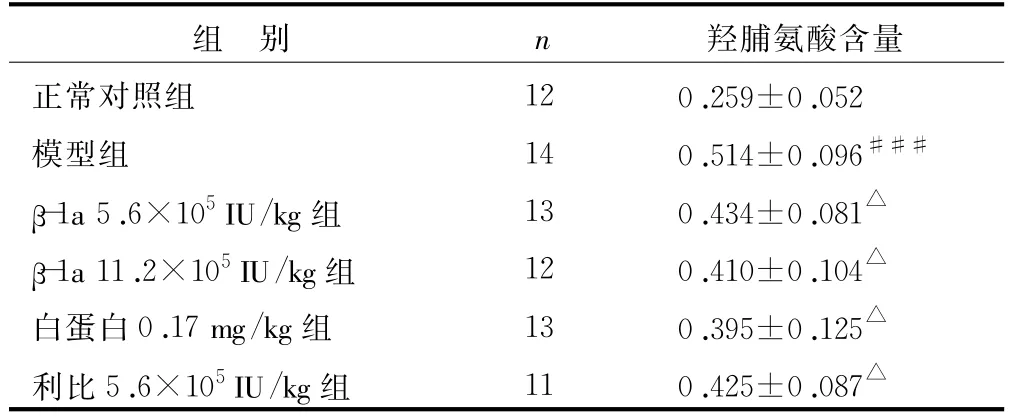
表3 干扰素β-1a对肝纤维化大鼠肝组织羟脯氨酸含量的影响(±s) μg/mg
注:与正常组比较 ,###P<0.001;与模型组比较 ,△P<0.05
羟脯氨酸含量正常对照组 12 0.259±0.052模型组 14 0.514±0.096###β-1a 5.6×105IU/kg组 13 0.434±0.081△β-1a 11.2×105IU/kg组 12 0.410±0.104△白蛋白0.17 mg/kg组 13 0.395±0.125△利比5.6×105IU/kg组 11 0.425±0.087组 别 n△
4 讨论
正常时肝的纤维组织形成和降解保持动态的平衡。如果在各种致病因子的作用下,纤维组织形成增多而降解减少则可导致肝纤维化[10-11]。本试验动物肝脏病理形态学观察结果统计表明,大鼠口服CCl4可造成肝纤维化及早期肝硬化,注射受试药物β-1a干扰素、利比及白蛋白进行干预治疗后,肝纤维化程度均有不同程度的明显减轻。
肝纤维化后,肝细胞受损,肝脏合成蛋白质水平下降,导致器官发育受阻,导致体质量减轻,而由于肝纤维化时肝脏内成纤维细胞分泌大量胶原纤维,可致肝脏重量增加[12]。表1所示,经受试药干预后,体质量下降、脏体系数升高均有一定改善,其中β-1a高剂量组体质量明显高于模型组,白蛋白组肝脏脏体系数明显低于模型组。
肝脏是体内多种生化反应的主要场所,当其受到损伤引发病理性病变时,可引起ALT、AST、TBIL、TG等血清学指标的变化[13]。表2所示,经受试药干预后ALT、AST、TBIL与模型组比较明显下降,ALB、ALB/GLB与模型组比较明显升高。
由于羟脯氨酸为胶原纤维所特有,故测定组织羟脯氨酸的含量,可间接换算出胶原蛋白的含量,以判断肝纤维化程度[14],据此也可以判断治疗效果。表3所示,各受试药物均能明显降低肝硬化小鼠肝内羟脯氨酸的含量,降低胶原蛋白的含量,使肝组织胶原纤维化程度明显减轻。由于蛋白质类药物具有高活性、特异性强、低毒等特点,所以近年来治疗肝纤维化的蛋白质药物有了很大发展,但很多该类药物还停留在实验研究阶段[15]。
本研究证实,干扰素β-1a、白蛋白注射液能抑制肝纤维化大鼠肝内成纤维细胞合成胶原纤维的功能 ,使肝内细胞外基质积聚减少,有效延缓肝纤维化进程,改善肝功能。本研究对肝纤维化从宏观水平深入到细胞、分子水平进行了研究,阐述了干扰素β-1a、白蛋白注射液预防性治疗大鼠肝纤维化的效果和机理 ,证实干扰素β-1a、白蛋白注射液能有效地治疗四氯化碳诱导的肝纤维化,具有广阔的开发前景。
[1]吴晓宁,尤红.抗肝纤维化的治疗策略[J].现代消化及介入诊疗,2012,17(4):220-223.
[2]阮春云,曾秋明,张怡,等.干扰素β-1b对多发性硬化患者生活质量影响的1年随访[J].国际神经病学神经外科学杂志,2014,41(3):216-220.
[3]贺电,李娅 ,徐竹,等 .干扰素-β治疗复发-缓解型多发性硬化系统评价[J].中国现代神经疾病杂志,2014,14(9):775-788.
[4]邵清,张健 ,李梵,等.聚乙二醇干扰素α-2a联合利巴韦林治疗慢性丙型肝炎对肝纤维化的影响[J].传染病信息,2013,26(3):152-154.
[5]张丽君,张英,陈献雄,等.重组人干扰素β-1a对BALB/C小鼠硬化症的疗效评价[J].中国新药与临床杂志 ,2014,33(9):677-682.
[6]徐叔云.药理实验方法学[M].3版 .北京:人民卫生出版社,2002:1350-1351.
[7]那坤,武亮,李滢,等.大鼠肝纤维化实验动物模型的建立方法[J].中国中医基础医学杂志,2015,21(3):272-274.
[8]冯英巧,杨元生,崔淑兰,等.肝纤维化实验动物模型造模方法及应用研究进展[J].广东药学院学报,2013,29(5):570-574.
[9]韦坤,王兴华,张海清,等.肝纤维化指数评价实验兔肝纤维化程度的研究[J].中国中西医结合影像学杂志,2014,12(3):272-274.
[10]袁晓栋.肝纤维化的病理机制[J].西安医专论坛,2012,4(1):113-115.
[11]邵祥强,肖华胜.肝纤维化发病机制与临床诊断的研究进展[J].世界华人消化杂志,2011,19(3):268-274.
[12]丁宁.肝纤维化形成机制的研究进展[J].临床肝胆病杂志,2009,25(1):73-77.
[13]张金金,胡振林,张俊平.肝纤维化的细胞和分子机制[J].生命的化学,2011,31(5):684-687.
[14]张磊,李俊,朱鹏里,等.四氯化碳诱导大鼠肝纤维化进展期和恢复期模型的建立[J].中国药理学通报,2011,27(12):1757-1760.
[15]韩军勇,高永华.治疗肝纤维化的蛋白质药物研究进展[J].现代生物医学进展,2012,12(13):2596-2600.
Therapeutical effect of human-interferon recombineβ-1a injection on model of rats with hepatic fibrosis
WANG Yan1,LIN Xiaofa1,ZHANG Weiwei2,WEI Kang2,WANG Zhonghan3,TIAN Jianming2*
(1.Shenhzen Polytechnic,Shenzhen 518044,China;2.Jilin Academy of Traditional Chinese Medicine,Changchun 130021,China;3.The Second Clinical Medical College of Jilin University,Changchun 130041,China)
Objective To analyze the therapeutical effect of human-interferon recombineβ-1a injectio and the albumin injectio on the rats hepatic fibrosis.Methods Feed rats with 50%solutions of CCl peanut oil 1 mL/kg,2-3 times/week,use the testing drugs after 5 weeks(alternates day per times),and at the same time continuously feed the rats with 50%solutions of CCl peanut oil.Sample the blood and liver after 9 weeks and measure ALT,AST,TP,ALB,TBIL of the blood plasma and the Hyp of the liver tissue,and undertake the histopathology of the liver tissue.Results Human-interferon recombine β-1a injectio and the albumin injectiocan obviously decrease the ALT,AST,TBIL of blood plasma of the model of the hepatic fibrosis rats evidently,and increase Hyp of the liver tissue of the model of the hepatic fibrosis rats at the meantime.Conclusi on Human-interferon recombineβ-1a injectio and the albumin injectio can inhibit the level of the hepatic fibrosis of the model rats.
human-interferon recombineβ-1a injection;albumin injectio;model of rats with hepatic fibrosis
R963
A
2095-6258(2015)05-0904-04
10.13463/j.cnki.cczyy.2015.05.008
2015-05-05)
广东省教育厅项目(2012B091100408);深圳市科技创新委项目(CXZZ20120619162250509)。
王 妍(1962-),女,博士,研究员,主要从事分子生物学研究。
*通信作者:田建明,女,硕士,主任药师,电话-13500806753,电子信箱-tianjm62@sina.com
