云南省玉溪市玉米致死性坏死病毒原的分子鉴定
2015-11-25夏子豪董家红陈永对张仲凯范在丰
李 帅, 朱 敏, 夏子豪, 王 廿, 周 涛,董家红, 陈永对, 张仲凯, 范在丰*
(1. 中国农业大学植物病理学系, 北京 100193; 2. 云南省农业科学院生物技术与种质资源研究所, 昆明 650223)
研究简报ResearchNotes
云南省玉溪市玉米致死性坏死病毒原的分子鉴定
李 帅1#, 朱 敏1#, 夏子豪1, 王 廿1, 周 涛1,董家红2*, 陈永对2, 张仲凯2, 范在丰1*
(1. 中国农业大学植物病理学系, 北京 100193; 2. 云南省农业科学院生物技术与种质资源研究所, 昆明 650223)
玉米致死性坏死病是由玉米褪绿斑驳病毒(Maizechloroticmottlevirus, MCMV)和一种或多种马铃薯Y病毒科病毒复合侵染引起的。2014年1月在对云南省玉溪市玉米病毒病害的调查中发现了一些表现严重花叶、矮化叶片甚至整个植株坏死症状的玉米。对采集样品进行RT-PCR检测,所有样品中都同时检测到了MCMV和甘蔗花叶病毒(Sugarcanemosaicvirus, SCMV),在一个样品中同时检测到了MCMV、SCMV和南方水稻黑条矮缩病毒(Southern rice black-streaked dwarf virus)。
玉米致死性坏死病; 玉米; RT-PCR
玉米致死性坏死病(corn lethal necrosis, CLN或maize lethal necrosis disease, MLND)最早于1973年发现于秘鲁[1],随后在美国的堪萨斯州和内布拉斯加州也发现了该病害[2]。该病害是由玉米褪绿斑驳病毒(Maizechloroticmottlevirus, MCMV)和马铃薯Y病毒科(Potyviridae)中侵染禾本科植物的病毒[例如小麦线条花叶病毒(Wheatstreakmosaicvirus, WSMV)、玉米矮花叶病毒(Maizedwarfmosaicvirus, MDMV)、甘蔗花叶病毒(Sugarcanemosaicvirus, SCMV)]复合侵染后发生协生作用而导致的,其症状表现为褪绿斑驳、花叶,叶片坏死,甚至整个植株坏死。玉米产量损失严重时高达90%[1-4]。周雪平课题组于2011年首次报道了MCMV和玉米致死性坏死病在我国云南省的发生[5]。
MCMV主要分布在阿根廷、墨西哥、秘鲁和美国等国家,近年已扩展到亚洲和非洲的部分玉米种植区[6-8]。在临近云南省北部的四川省攀枝花地区的玉米标样中也检测出了MCMV[9]。该病毒的寄主限于禾本科植物(包括玉米、小麦、大麦、燕麦、高粱等),可以通过机械摩擦[1-4]和种子[7]传播。MCMV的夏威夷分离株可由玉米花蓟马(威廉斯花蓟马Frankliniellawilliamsi)传播[8],从泰国进境的分离株可由西花蓟马(F.occidentalis)传播[10]。用MCMV-Kansas株系作毒原研究发现叶甲科的谷物叶甲(Oulemamelanopa)、玉米跳甲(Chaetocnemapulicaria)、红头跳甲(Systenafrontalis)、南部玉米食根叶甲(Diabroticaundecimpunctata)、北部玉米食根叶甲(D.longicornis)和西部玉米食根叶甲(D.virgifera)等6种昆虫是MCMV的传播介体,以非持久性方式传毒[11]。受该病毒侵染的玉米在侵染初期主要表现出轻度的褪绿斑驳,逐步发展为黄色条纹,甚至还引起雌花的畸形和植株的矮化等。MCMV属于番茄丛矮病毒科(Tombusviridae),玉米褪绿斑驳病毒属(Machlomovirus),病毒粒子为球状,直径约为30 nm;其基因组为正义单链RNA分子,全长为4 436~4 437 nt[12-13],包含7个开放读框[13]。
SCMV是引起我国玉米矮花叶病的主要病原,其自然寄主限于禾本科植物。植株受侵染后主要表现为叶片不均匀褪绿而形成花叶、条纹等,重病株表现不同程度的矮化,不能抽穗,千粒重下降等。SCMV是马铃薯Y病毒属(Potyvirus)的成员,基因组为正义单链RNA分子,全长约为 9.6 kb[14]。SCMV基因组RNA编码一个大的多聚蛋白和一个移码蛋白,经病毒自身编码的蛋白酶切割后形成11个成熟的蛋白质[14-15]。
南方水稻黑条矮缩病毒(Southern rice black-streaked dwarf virus, SRBSDV)是在我国首先发现的一种导致水稻黑条矮缩病的病毒[16-17]。该病毒属于呼肠孤病毒科(Reoviridae),斐济病毒属(Fijivirus)[16-17],由白背飞虱以持久性方式传播[17-18]。SRBSDV的基因组由10条双链RNA组成[16]。
2014年1月,作者在对云南省玉溪市玉米病毒病害的调查中发现了一些表现严重花叶、矮化、叶片甚至整株坏死以及粗缩症状的玉米,严重地块发病率达50%以上。采集了8个症状明显的样品提取叶片总RNA,使用MCMV,SCMV和SRBSDV的特异性引物进行RT-PCR检测、序列测定和比对分析后,发现上述8个样品中均含有MCMV和SCMV,其中1个表现粗缩症状的样品受到MCMV、SCMV和SRBSDV 3种病毒的复合侵染。
1 材料与方法
1.1 样品采集
2014年1月在云南省玉溪市元江县采集表现严重花叶、矮化,叶片甚至整个植株坏死症状(图1)的玉米植株8份,经整理后一部分用于病毒的检测,其余样品于-40 ℃保存备用。

图1 玉米致死性坏死病的田间症状Fig.1 The symptom of maize lethal necrosis disease in the field
1.2 叶片总RNA的提取
利用TRIzol法提取玉米叶片总RNA。取约0.1 g的叶片用液氮研磨成粉末状,迅速移入1.5 mL离心管中后立即加入1 mL TRIzol,剧烈振荡混匀,室温静置5 min后加入200 μL氯仿,剧烈振荡20 s再于室温静置3 min后于4 ℃,12 000g离心15 min,取上层水相(约500~550 μL)转移到新的1.5 mL离心管中,加入等体积的异丙醇,混匀后于室温静置10 min,然后于4 ℃,12 000g离心10 min后用75%乙醇洗涤沉淀2次。最后用DEPC处理的ddH2O溶解沉淀。
1.3 反转录PCR、序列克隆和测定
以2 μg总RNA为模板,加入0.5 μL Oligo(dT)引物(0.5 μg/μL)(Promega公司),0.5 μL随机六聚体引物(Promega公司)(10 μmol/L),1 μL dNTPs(10 mmol/L),4 μL 5×RT缓冲液,0.5 μL核酸酶抑制剂(ribonuclease inhibitor),1 μL M-MLV(Promega公司),最后加入DEPC处理的ddH2O将反应体系补齐至20 μL,充分混匀后于37 ℃反应60 min。
以反转录得到的cDNA为模板,分别用检测SCMV,MCMV和SRBSDV的特异性引物进行PCR。各检测引物的序列、退火温度、目的片段长度及参考文献见表1。50 μL PCR反应体系如下:2 μL cDNA,5 μL 10×Taq缓冲液,1 μL dNTPs(10 mmol/L),上下游检测引物(10 μmol/L)各2 μL,0.4 μL GoldenTaqDNA 聚合酶,37.6 μL ddH2O。PCR反应条件为:94 ℃预变性5 min;按以下条件进行30个循环:94 ℃变性30 s,50或58 ℃(视引物的Tm值而定)退火30 s,72 ℃延伸(延伸时间视目标片段大小而定);最后72 ℃延伸10 min。所有PCR产物经1% 琼脂糖凝胶电泳分析后,切取目标条带,经天根公司的琼脂糖凝胶回收试剂盒回收纯化后克隆到pMD18-T载体(TaKaRa,大连)。连接产物转化大肠杆菌DH5α菌株,取阳性克隆测序获得序列。
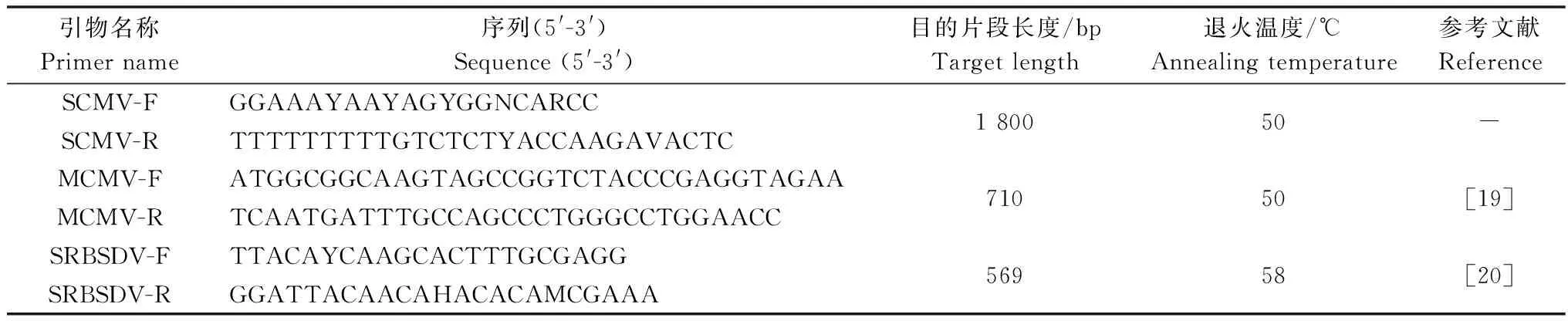
表1 检测使用引物信息1)
1) Y=C/T;N=A/G/C/T;R=A/G;V=A/G/C
1.4 序列比对和分析
利用NCBI网站(http:∥blast.ncbi.nlm.nih.gov/Blast.cgi)上的BLAST程序对克隆得到的序列进行比对分析,根据核苷酸序列的相似性确定病毒的种类。采用Clustal W(http:∥www.genome.jp/tools/clustalw/)进行相关核苷酸序列的初步比对运算,再用MEGA 6.06软件构建进化树。
2 结果与分析
2.1 样品的RT-PCR检测
以cDNA为模板,分别用SCMV、MCMV和SRBSDV的特异性引物进行PCR检测。从采集的8个样品中均扩增得到了约710 bp和约1 800 bp的条带(图2a,b),从5号样品中扩增得到了约569 bp的条带(图2c)。结果表明8个样品均被MCMV和SCMV侵染;5号样品受到MCMV、SCMV和SRBSDV 3种病毒的复合侵染。
2.2 序列分析
将PCR获得的目标片段纯化,克隆到pMD18-T载体并进行序列测定。用BLAST程序进行序列相似性比对分析的结果表明:从云南玉溪市采集的8个玉米样品中分离得到的710 bp片段的序列完全相同(MCMV-Yuanjiang 2,GenBank登录号:KJ873134.1)与MCMV四川分离物(MCMV-Sichuan,GenBank登录号:JQ982470.1)的序列一致率最高,为99%;从这8个样品中扩增得到的约1 800 bp片段的序列与SCMV广东分离物(SCMV-GD,GenBank登录号:AJ310105.1)的序列一致率最高,均为98%;而从5号样品中扩增得到的569 bp片段的序列与SRBSDV云南分离物(SRBSDV-YN,GenBank登录号:JQ773428.1)的序列一致率最高,为100%。表明,在云南省玉溪市采集的8个玉米样品均受到MCMV和SCMV的复合侵染,其中5号样品受到MCMV、SCMV和SRBSDV这3种病毒的复合侵染。
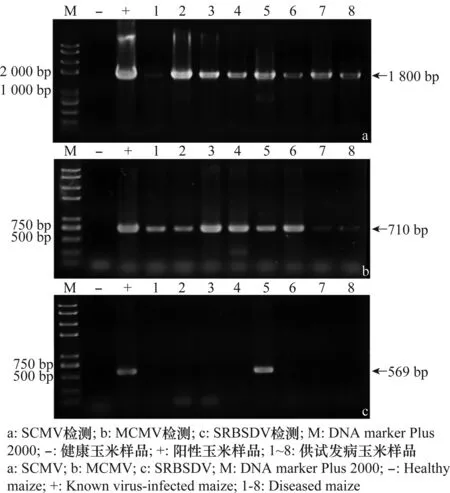
图2 利用反转录PCR检测发病玉米样品中SCMV,MCMV和SRBSDVFig.2 Detection of SCMV, MCMV and SRBSDV in diseased maize samples through RT-PCR
3 讨论
玉米致死性坏死病是一种毁灭性的病毒病害,近年来在东南亚及非洲东部的部分国家和地区大面积发生[6, 21],造成了严重的经济损失,威胁了当地的粮食安全。MCMV是玉米致死性坏死病的主要病原,也是我国进境检疫性病毒,目前仅在我国的云南和四川两省有发生[5, 9]。其在云南主要发生在冬春玉米上,严重时连片发生几千亩。该病毒可由叶甲或蓟马传播,也可经种子传播[7-8,10-11]。我国植物检疫部门多次从国外进境的玉米种子中检测到MCMV[19, 21-22]。MCMV与马铃薯Y病毒科的一种或多种病毒的复合侵染,例如MCMV与SCMV复合侵染可导致玉米致死性坏死病的发生。我们的检测结果显示,从云南省玉溪市采集的玉米样品中扩增得到的MCMV的片段序列与MCMV-Sichuan的序列一致率高达99%,将我国和部分美国的MCMV外壳蛋白基因绘制成系统发生进化树(图3),进化树显示我国的MCMV聚为一类且与美国的MCMV相似。从这批样品中扩增得到的SCMV的片段序列与SCMV-GD的序列一致率高达98%。这表明这两种病毒可能是通过种子携带在华南和西南地区传播的。近年冬春季,许多育种单位在云南进行南繁育种,这可能是该类病害传入云南的途径之一。因此,加强对玉米种子调运的管理以及严格执行检疫措施将有利于控制该病毒在国内外的传播和扩散,对于预防和阻止玉米致死性坏死病的发生和蔓延具有重要作用[21-22]。此外,我国是全球主要的玉米消费国,每年从国外进口大量的玉米,加大对玉米种子的检测力度也能在很大程度上防止各种检疫性危险病毒的入侵。
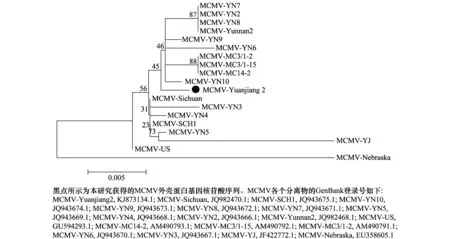
图3 MCMV不同分离物外壳蛋白基因的系统进化树Fig.3 Phylogenetic tree based on nucleotide sequences of the coat protein gene of different isolates of MCMV
[1] Castillo J, Hebert T T.Nueva enfermedad virosa afectando al maiz en el Peru [J].Fitopatologia 1974, 9:79-84.
[2] Niblett C L, Claflin L E.Corn lethal necrosis—a new virus disease of corn in Kansas [J].Plant Disease Reporter, 1978, 62(1):15-19.
[3] Goldberg K B, Brakke M K.Concentration of Maize chlorotic mottle virus in mixed infections withMaizedwarfmosaicvirus, strain B [J].Phytopathology,1987, 77: 162-177.
[4] Uyemoto J K, Bockelman D L, Claflin L E.Severe outbreak of corn lethal necrosis disease in Kansas [J].Plant Disease, 1980, 64: 99-100.
[5] Xie Li,Zhang Jingze,Wang Qiang,et al.Characterization ofMaizechloroticmottlevirusassociated with maize lethal necrosis disease in China [J].Journal of Phytopathology, 2011, 159: 191-193.
[6] Wangai A W, Redinbaugh M G, Kinyua Z M, et al. First report ofMaizechloroticmottlevirusand maize lethal necrosis in Kenya [J].Plant Disease,2012, 96(10):1582-1583.
[7] Jensen S G, Wysong D S, Ball E M, et al. Seed transmission ofMaizechloroticmottlevirus[J].Plant Disease,1991,75:497-498.
[8] Jiang X Q, Meinke L J, Wright R J, et al.Maizechloroticmottlevirusin Hawaiian-grown maize: vector relations, host range and associated viruses [J].Crop Protection, 1992, 11:248-254.
[9] Wu Jianxiang, Wang Qiang, Liu Huan, et al. Monoclonal antibody-based serological methods forMaizechloroticmottlevirusdetection in China[J].Journal of Zhejiang University-Science B (Biomedicine & Biotechnology),2013,14(7):555-562.
[10]Zhao Mingfu, Ho Honhing, Wu Yixin,et al. Western flower thrips (Frankliniellaoccidentalis) transmitsMaizechloroticmottlevirus[J].Journal of Phytopathology,2014,162:532-536.
[11]Nault L R, Styer W E, Coffey M E.Transmission ofMaizechloroticmottlevirusby chrysomelid beetles [J].Phytopathology,1978, 68: 1071-1074.
[12]Nutter R C, Scheets K, Panganiban L C, et al. The complete nucleotide sequence ofMaizechloroticmottlevirusgenome [J].Nucleic Acids Research,1989,17: 3163-3177.
[13]King A M Q, Adams M J, Carstens E B, et al. Virus taxonomy [C]∥Ninth Report of the International Committee on Taxonomy of Viruses. New York:Academic Press, 2012.
[14]范在丰,陈红运,李怀方. 玉米矮花叶病毒原北京分离物的分子鉴定[J].农业生物技术学报,2001, 19(1):12.
[15]Chung B Y, Miller W A, Atkins J F, et al. An overlapping essential gene in thePotyviridae[J].Proceedings of the National Academy of Sciences of the United States of America, 2008,105: 5897-5902.
[16]Zhang Hengmu, Yang Jiang, Chen Jiaping, et al. A black-streaked dwarf disease on rice in China is caused by a novel fijivirus [J].Archives of Virology, 2008,153: 1893-1898.
[17]Zhou Guohui, Wen Jingjung, Cai Dejiang, et al. Southern rice black-streaked dwarf virus: A new proposedFijivirusspecies in the family Reoviridae [J].Chinese Science Bulletin, 2008, 53(23): 3677-3685.
[18]Pu Lingling, Xie Guohua, Ji Chunyan, et al. Transmission characteristics of Southern rice black-streaked dwarf virus by rice planthoppers [J].Crop Protection, 2012,41:71-76.
[19]刘洪义,刘忠梅,张金兰,等.进境玉米种子中玉米褪绿斑驳病毒的检测鉴定[J].东北农业大学学报,2011,42(10):36-40.
[20]季英华,高瑞珍,张野,等.一种快速同步检测水稻黑条矮缩病毒和南方黑条矮缩病毒的方法[J].中国水稻科学,2011,25(1):91-94.
[21]龚海燕,张永江,张治宇,等. 进境玉米种子携带玉米褪绿斑驳病毒的检测与鉴定[J].植物病理学报,2010,40(4):426-429.
[22]雷屈文,李旻,丁元明,等.泰国进口玉米种子玉米褪绿斑驳病毒的检测[J].华中农业大学学报,2013, 32(5):51-54.
(责任编辑:杨明丽)
Molecular identification of the viruses causing maize lethal necrosis disease in Yuxi, Yunnan Province
Li Shuai1, Zhu Min1, Xia Zihao1, Wang Nian1, Zhou Tao1, Dong Jiahong2, Chen Yongdui2, Zhang Zhongkai2, Fan Zaifeng1
(1. Department of Plant Pathology, China Agricultural University, Beijing 100193, China; 2. Institute of Biotechnology and Germplasm Resources, Yunnan Academy of Agricultural Sciences, Kunming 650223, China)
Maize lethal necrosis disease is caused by synergistic interaction betweenMaizechloroticmottlevirus(MCMV) and one or several potyviruses. Severe mosaic, leaf necrosis (even plant lethal necrosis) or rough dwarf were found during a survey on virus diseases in maize carried out in Yuxi District, Yunnan Province in January 2014. RT-PCR, molecular cloning and sequence analysis were performed to identify the viruses present in the sampled plants. The results showed that all of the diseased samples tested were co-infected with MCMV andSugarcanemosaicvirus(SCMV) and one of the plants was co-infected with MCMV, SCMV and Southern rice black-streaked dwarf virus (SRBSDV).
corn lethal necrosis disease; maize; RT-PCR
2014-03-25
2014-06-10
国家科技重大专项(2013ZX08003-001); 云南省科技计划项目(2012CH007)
S 432.41
A
10.3969/j.issn.0529-1542.2015.03.021
* 通信作者 E-mail:dongjhn@126.com;fanzf@cau.edu.cn
# 对文章有同等贡献,为并列第一作者
