初治肺结核患者外周血树突状细胞免疫功能的体外研究
2015-11-24许怡杨莉赵磊曹金凤韩玮张志高会霞刘玉珍戴二黑
许怡,杨莉,赵磊,曹金凤,韩玮,张志,高会霞,刘玉珍,戴二黑
初治肺结核患者外周血树突状细胞免疫功能的体外研究
许怡,杨莉,赵磊,曹金凤,韩玮,张志,高会霞,刘玉珍,戴二黑△
目的研究初治肺结核患者外周血树突状细胞(DC)表面成熟标志的表达、分泌细胞因子以及对T淋巴细胞的刺激作用。方法收集初治肺结核患者68例,其中菌阴组35例,菌阳组33例。收集健康体检者40例作为对照组。分离外周血单个核细胞,诱导其分化成DC。流式细胞术检测各组DC的表面标志CD83和CD86的表达率;MTT法检测DC促进同种异体T淋巴细胞的增殖能力;ELISA法检测DC培养上清中白细胞介素(IL)-12、IL-10、干扰素(INF)-γ的含量。结果初治肺结核患者与对照组相比,DC表面标志CD83和CD86的表达量均显著降低(P<0.05),刺激淋巴细胞增殖的能力均显著降低(P<0.05),培养上清中IL-12的含量均显著增高(P<0.05),培养上清中IL-10、INF-γ的含量各组间差异无统计学意义(P>0.05)。结论初治肺结核患者外周血DC的成熟度显著下降,刺激混合淋巴细胞增殖的能力也显著降低,分泌IL-12的能力增强。
树突细胞;结核,肺;细胞因子类;流式细胞术
结核病是一种严重危害人类健康的慢性传染病,是我国重点控制的重大传染病之一。目前研究证实机体抗结核感染的免疫应答主要以T细胞介导的细胞免疫为主[1]。树突状细胞(dendritic cell,DC)作为体内功能最强大的抗原提呈细胞(antigen present⁃ing cell,APC),能够显著刺激初始T淋巴细胞进行增殖,是机体免疫应答的始动者,可以通过表达抗原刺激信号和共刺激信号启动免疫应答[2]。因此DC在
抗结核感染免疫应答中的作用日益受到关注。本研究旨在通过体外细胞培养的方法对初治肺结核患者DC表面成熟标志的表达、分泌的相关细胞因子以及对T淋巴细胞增殖的干预功能进行研究,探讨初治肺结核患者体内DC的免疫功能状态。
1 对象与方法
1.1 研究对象2013年6月—2014年1月就诊于我院的初治肺结核患者68例,诊断均符合中华医学会结核病学分会制定的《临床诊疗指南-结核病分册》的诊断标准,所有患者均未接受任何抗结核治疗及免疫治疗。3次痰涂片及1次培养阴性的肺结核患者入组菌阴肺结核组(菌阴组);痰标本直接涂片抗酸杆菌镜检阳性或痰标本结核分枝杆菌培养阳性的肺结核患者入组菌阳肺结核组(菌阳组)。将HIV抗体初筛试验呈阳性,既往有抗结核治疗史,感染其他传染病(如感染乙型肝炎、丙型肝炎),患有其他慢性疾病(如糖尿病、肿瘤等),患有自身免疫性疾病的肺结核患者排除。菌阴组35例,男20例,女15例,年龄(42.9±19.8)岁。菌阳组33例,男18例,女15例,年龄(38.3±16.2)岁。选择本院同期40例健康体检者为对照组,男23例,女17例,年龄(36.3±15.6)岁。3组间性别(χ2=0.073)、年龄(F=3.911)比较差异无统计学意义(均P>0.05)。
1.2 实验试剂及仪器重组人白细胞介素(rhIL)-4和重组人粒细胞巨噬细胞集落刺激因子(rhGM-CSF)均购自美国CYTOLAB公司;AIM-V培养基购自美国Gibco公司;FITC标记的CD83及PE标记的CD86单克隆抗体(mAb)均购自美国Baker Catalog公司;检测白细胞介素(IL)-12、IL-10、干扰素(INF)-γ的ELISA试剂盒购自美国R&D公司;淋巴细胞分离液购自天津市灏洋生物制品科技有限责任公司;MTT试剂购自美国Sigma公司;Epics-XLⅡ型流式细胞仪由美国Beckman Coulter公司生产;Sunrise型酶标仪由奥地利帝肯公司生产。
1.3 DC的分离和培养无菌采集肝素抗凝外周静脉血5 mL,经Ficoll密度梯度离心法分离单个核细胞(PBMC),生理盐水洗涤2次后,AIM-V培养基调整细胞浓度为1×106个/ mL,加入到6孔细胞培养板中(5 mL/孔),在CO2培养箱中贴壁3 h后,倒置显微镜下观察可见细胞开始贴壁生长。洗去非黏附细胞,获得的贴壁细胞为拟诱导DC的细胞,加入含有rhGM-CSF(50µg/L)和rhIL-4(10µg/L)的AIM-V培养基5 mL,放入CO2培养箱中培养。隔天半量换液,并补充细胞因子。培养至第7天,收集所培养细胞,计数并进行表面标志的测定,同时收集培养上清,-80℃保存。
1.4 流式细胞仪检测CD83、CD86的表达用生理盐水调整细胞悬液的浓度至1×106个/mL,吸取100 μL,加入20µL FITC标记的CD83和5µL PE标记的CD86,震荡混匀,室温避光孵育15 min,加入PBS洗涤2次,上机进行检测。
1.5 MTT法检测混合淋巴细胞增殖能力以正常人的混合淋巴细胞悬作效应细胞(浓度为2×106个/mL),以经丝裂霉素C作用过的各组DC为刺激细胞(浓度为1×106个/mL),在96孔板中每孔加入100µL刺激细胞和100µL效应细胞,以诱导混合淋巴细胞的增殖,每组诱导DC设3个重复孔,并设空白对照(以AIM-V培养基代替DC悬液)。放入CO2培养箱中培养48 h,在培养结束前4 h每孔加入10µL MTT(5 g/ L),继续培养至实验结束,在酶标仪490 nm波长处测光密度(OD)值,以刺激指数(SI)作为判断淋巴细胞增殖的程度。计算公式为SI=(实验组OD值-对照组OD值)/对照组OD值× 100%。
1.6 培养上清中细胞因子的检测采用酶联免疫吸附测定(ELISA)法检测各组DC培养上清中的IL-12、IL-10、INF-γ的含量,操作按试剂盒说明进行。
1.7 统计学方法采用SPSS 13.0统计软件包。符合正态分布的计量资料以表示,多组间比较采用方差分析。不符合正态分布的计量资料以中位数(四分位数间距)表示,比较采用Kruskal-Wallis H秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组外周血DC细胞形态DC细胞培养至第7天,镜下可见细胞体积增大,细胞表面有数量不等、形态各异的突起,为典型的DC形态。菌阴组和菌阳组的DC在培养过程中,DC生长密度比对照组低,形态也不如对照组典型。菌阴组和菌阳组的DC数量明显低于对照组,差异有统计学意义(P<0.05),见图1、表1。

Fig.1Cell morphology under inverted microscope in the 7thday at initial treatment(×400)图1 第7天倒置显微镜下观察细胞的形态(×400)
2.2 各组DC表面标志表达水平及对T细胞刺激能力的比较菌阴组和菌阳组CD83、CD86的表达均低于对照组,菌阳组CD83的表达低于菌阴组(P<0.05),菌阴组与菌阳组CD86的表达差异无统计学
意义(P>0.05);菌阴组和菌阳组SI均低于对照组(P<0.05),该2组SI差异无统计学意义(P>0.05),见表1、图2。
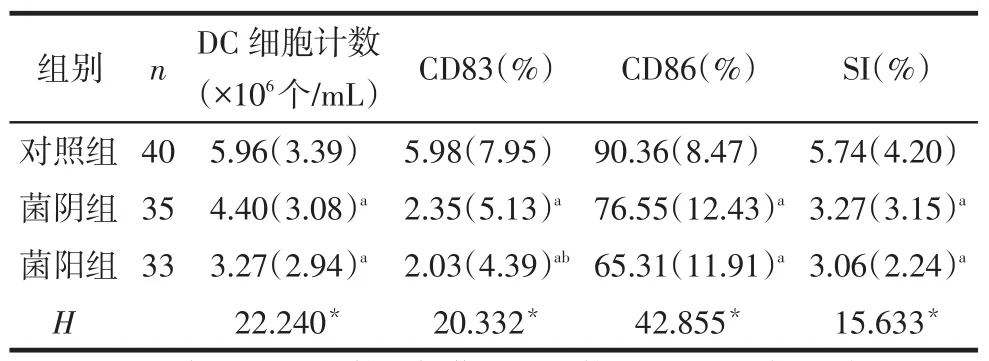
Tab.1Theexpressions of CD83 and CD86 on DCs and T lymphocyte proliferation in different groups表1 各组DC表面标志表达水平及对T细胞刺激能力的比较[M(Q)]

Fig.2Expressions of CD83 and CD86 on DCs from different groups shown by FACs图2 流式细胞仪检测各组DC的CD83、CD86的表达
2.3 各组DC培养上清中IL-12、IL-10和IFN-γ含量比较IL-12的含量,菌阴组和菌阳组高于对照组(P<0.05),菌阴组与菌阳组比较差异无统计学意义(P>0.05)。IL-10、IFN-γ的含量,3组差异均无统计学意义(P>0.05),见表2。
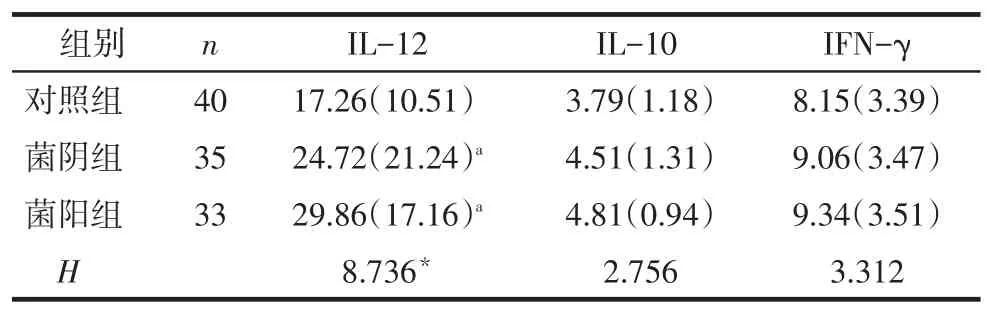
Tab.2Contents of IL-12,IL-10 and IFN-γ in DC culture supernatant of different groups表2 各组DC培养上清中IL-12、IL-10和IFN-γ的含量比较[ng/L,M(Q)]
3 讨论
近年来的研究证实,以T细胞介导的细胞免疫在结核病的发病过程中起着决定性作用[3]。而DC可以通过激活CD4+T细胞和CD8+T细胞启动细胞免疫,发挥抗结核的免疫作用。本研究显示初治肺结核患者各组诱导生成DC数量不仅在显微镜下明显减少,而且收集细胞计数后显示患者组诱导生成的DC细胞数明显低于对照组,表明初治肺结核患者体内生成DC的功能受损。这与胥萍等[4]研究的肺结核患者外周血DCs数量低于健康对照组的结果相符。许多研究显示肺结核患者外周血的CD4+T数量显著低于健康对照组[5]。有可能是由于DC免疫功能受损,继而影响CD4+T淋巴细胞的分化增殖以及吞噬细胞的活化,使机体的抗结核免疫应答受到抑制。
DC分化成熟过程中具有未成熟(immature den⁃dritic cell,iDC)与成熟(mmature dendritic cell,mDC)两个阶段,iDC具有极强的摄取、加工处理抗原的能力,而提呈抗原、激发免疫应答的能力弱,mDC摄取、加工处理抗原能力弱,而提呈抗原、启动免疫应答能力强[6]。另有研究发现CD83为DC成熟度的特征性标志,CD86是DC通过提呈抗原激活T淋巴细胞的第二信号的表面标志[7]。本研究结果显示初治肺结核患者无论是菌阴组还是菌阳组DC表面标志CD83的表达明显低于对照组,提示初治肺结核患者外周血DC的成熟度明显降低,患者组CD86的表达亦明显低于对照组,表明患者DC提呈抗原、激活免疫应答的功能受损。另外,两组初治肺结核患者的DC刺激混合淋巴细胞增殖的能力比对照组明显降低,进一步表明初治肺结核患者激活T淋巴细胞的功能受损。菌阳组CD83的表达显著低于菌阴组,虽然菌阳组CD86的表达、SI与菌阴组无差异。可见菌阳肺结核患者外周血DC提呈抗原能力的受损较菌阴肺结核患者更严重,启动细胞免疫应答的能力更弱于菌阴肺结核患者,是否是由于感染初期菌阳肺结核患者体内结核菌数量比菌阴肺结核患者多,造成患者免疫细胞受损更严重,这有待于今后进一步研究。
目前的研究已经证实在Th0向Th1分化的过程中,IL-12起着关键性作用[8],而且越来越多的研究发现DC可以通过分泌高水平的IL-12促进Th1类型的免疫应答[9]。本研究结果显示初治肺结核患者DC培养上清IL-12水平显著高于对照组,这说明患者DC通过产生IL-12可以促进Th1型淋巴细胞介导的免疫应答的发生。有学者认为肺结核病患者有着一定程度的DC缺损,并且结核分枝杆菌可以抑制DC的成熟[10]。本研究也发现初治肺结核患者外周血DC的成熟度降低,激活T淋巴细胞的能力显著减弱。但是,DC分泌IL-12水平反而增高,可能是由于MTB感染早期,抑制DC的功能主要表现在DC提呈抗原的功能受损,而并未影响DC分泌IL-12的功能。DC通过分泌更多的IL-12,促进
Th1型淋巴细胞介导的免疫应答的发生,来弥补成熟受阻的DC由于抗原提呈功能下降引起的抗结核免疫应答的抑制。这与Cools等[11]发现在MTB感染后,DC在较短的时间内能分泌IL-12的结论一致。
IFN-γ为另一种Th1型细胞因子,研究发现IFN-γ可以促进T细胞的增殖,同时增强T细胞的杀伤功能,活化巨噬细胞以及参与肉芽肿的形成,在抗MTB感染中起着保护性免疫的作用[12]。菌阴组和菌阳组的培养上清中IFN-γ的含量与对照组相比虽无差异,但均有一定程度的升高,可能是由于初治肺结核患者DC在感染初期分泌IL-12增多,而IL-12可以促进IFN-γ的分泌[13]。IL-10是一种负性免疫调节因子,可以抑制DC的成熟,诱导免疫耐受的发生。各组DC的培养上清中IL-10的含量无差异,由此可见,初治肺结核患者DC在感染初期分泌IL-12、IFN-γ等细胞因子的能力增强,通过IL-12、IFN-γ分泌增多来增强T细胞的杀伤功能,促进细胞免疫应答,达到抗结核作用。
在对培养上清中细胞因子的检测发现菌阳组与菌阴组的差异无统计学意义,提示初治肺结核患者血清及培养上清中IL-12、IL-10、IFN-γ的水平与肺结核患者自身的排菌量无明显相关性。MTB感染机体后,体内多种类型的细胞及细胞因子协同发挥免疫效应,其间相互关系及影响十分复杂,根据这3种细胞因子的水平尚不能有效地分析病情的严重程度。此观点有待于今后进一步探讨。
综上所述,初治肺结核患者外周血单个核细胞诱导形成DC的能力下降,形成的DC成熟度下降,抗原提呈能力受损,使机体启动免疫应答的能力下降,而患者外周血DC分泌细胞因子的能力并未减弱,可见肺结核患者初期机体启动免疫应答的能力下降可能与DC提呈抗原能力受损有关。如果能采用各种免疫治疗方法使患者体内DC数量增多,且使其抗原提呈能力增强,可能有利于体内MTB的清除。随着DC参与结核病免疫调节的机制被逐步阐明,将为开展有效的免疫治疗和开发新型的抗结核疫苗提供重要的科学依据。
[1]Kleinnijenhuis J,Oosting M,Joosten LA,et al.Innate immune rec⁃ognition of Mycobacterium tuberculosis[J].Clin Dev Immunol,2011,2011:405310.doi:10.1155/2011/405310.
[2]Garcia-Romo GS,Pedroza-Gonzalez A,Lambrecht BN,et al.My⁃cobacterium tuberculosis manipulates pulmonary APCs subverting early immune responses[J].Immunobiology,2013,218(3):393-401.doi:10.1016/j.imbio.2012.05.022.
[3]Huang JY,Song XY.The mechanisms of dendritic cells in immune response to mycobacterium tuberculosis[J].International Journal of Immunology,2009,32(3):234-237.[黄家禹,宋秀宇.树突状细胞在结核病免疫应答中的作用及机制[J].国际免疫学杂志,2009,32(3):234-237].doi:10.3760/cma.j.issn.1673-4394.2009.03.019.
[4]Xu P,Shi MH,Fei XF,et al.Changes in peripheral blood of pa⁃tients with pulmonary tuberculosis of dendritic cells and T helper cell level and its clinical significance[J].Journal of Soochow Uni⁃versity,2010,30(1):114-117.[胥萍,施美华,费晓峰,等.肺结核患者外周血树突状细胞和T辅助细胞水平的变化及其临床意义[J].苏州大学学报,2010,30(1):114-117].
[5]Wang QF,Han XQ,Chen YL,et al.T-lymphocyte subsets detec⁃tion and clinical significance in patients with pulmonary tuberculo⁃sis[J].Beijing Medicine,2013,35(12):993-995.[王庆枫,韩喜琴,陈玉玲,等.肺结核患者T淋巴细胞亚群的检测及临床意义[J].北京医学,2013,35(12):993-995].
[6]Kou PM,Schwartz Z,Boyan BD,et al.Dendritic cell responses to surface properties of clinical titanium surfaces[J].Acta Biomater,2011,7(3):1354-1363.doi:10.1016/j.actbio.2010.1 0.020.
[7]Feng ZX,Liu JY.Research progression of dendritic cell[J].Medi⁃cal review,2012,18(20):3347-3350.[冯钟煦,刘剑勇.树突状细胞的研究进展[J].医学综述,2012,18(20):3347-3350].
[8]Takei M,Umeyama A,Shoji N,et al.Polyacetylenediols regulate the function of human monocyte-derived dendritic cells[J].Int Immu⁃nopharmacol,2010,10(8):913-921.doi:10.1016/j.intimp.2010.05.002.
[9]Mazurek J,Ignatowicz L,Kallenius G,et al.Divergent effects of mycobacterial cell wall glycolipids on maturation and function of hu⁃man monocyte-derived dendritic cells[J].PLoS One,2012,7(8):e42515.doi:10.1371/journal.pone.0042515.
[10]Morris D,Gonzalez B,Khurasany M,et al.Characterization of den⁃dritic cell and regulatory T cell functions against Mycobacterium tu⁃berculosis infection[J].Biomed Res Int,2013,2013:402827.doi: 10.1155/2013/402827.
[11]Cools N,Ponsaerts P,Van Tendeloo VF,et al.Balancing between immunity and tolerance:an interplay between dendritic cells,regu⁃latory T cells,and effector T cells[J].Leukoc Biol,2007,82(12):1365-1374.doi:10.1189/jlb.0307166.
[12]Liu YY,Bao FK,Liu AH,et al.Progress in study on relationship between interferon gamma and tuberculosis[J].Tropical Medicine China,2012,12(10):1275-1280.[刘媛媛,宝福凯,柳爱华,等. γ-干扰素与结核病关系研究进展[J].中国热带医学,2012,12(10):1275-1280].
[13]Zhang J,Guo SL,Luo YA.The relationship between dendritic cell specific intercellular adhesion molecule-3 withnon integrin expres⁃sion and tuberculosis[J].Chin J Tuberc Respir Dis,2009,32(8):572-575.[张劼,郭述良,罗永艾.树突状细胞特异性细胞间黏附分子-3结合非整合素因子表达差异与结核病发病的关系[J].中华结核和呼吸杂志,2009,32(8):572-575].doi:10.3760/cma. j.issn.1001-0939.2009.08.006.
(2014-12-30收稿 2015-05-12修回)
(本文编辑 魏杰)
Study of immune function of dendritic cells in peripheral blood of tuberculosis patients after initial treatment
XU Yi,YANG Li,ZHAO Lei,CAO Jinfeng,HAN Wei,ZHANG Zhi,GAO Huixia,LIU Yuzhen,DAI Erhei△The Fifth Hospital of Shijiazhuang,Shijiazhuang 050021,China△
ObjectiveTo investigate expressions of surface maturation markers,secreting cytokines and the stimulat⁃ing effect on T lymphocytes in the dendritic cells(DC)from peripheral blood of tuberculosis(TB)patients after loading dose treatment.MethodsTB patients who received initial treatment(n=68)were collected at the fifth hospital of Shijiazhuang from 2013 June to 2014 January.Base on clinical diagnosis and treatment guidelines of tuberculosis,they were divided into sputum smear-negative group(35 cases)and sputum smear-positive group(33 cases).Forty cases of healthy adult were se⁃lected as control group.Mononuclear cells were isolated from peripheral blood and were cultured in medium to differentiate into DCs.Expression levels of CD83 and CD86 on DCs were examined by flow cytometry.The proliferation of allogeneic mixed lymphocyte stimulated by DCs was dectected using MTT assay.Contents of IL-12,IL-10 and INF-γ in the cultural supernatant of DCs and blood serum from TB patients were detected by ELISA.ResultsCompared with controls,the ex⁃pressions of CD83 and CD86 on DCs in TB patients after loading dose treatment decreased obviously(P<0.05),and the ability to stimulate the proliferation of lymphocytes reduced evidently(P<0.05).What's more,IL-12 level increased mark⁃edly(P<0.05)while IL-10 and INF-γ levels presented no significant difference among the three groups(P>0.05).ConclusionThe expressions of maturation markers of DC cells of the peripheral blood in TB patients after initial treatment de⁃creased.The ability of stimulating mixed lymphocyte proliferation is also significantly reduced while secretion of IL-12 was enhanced.
dendritic cells;tuberculosis,pulmonary;cytokines;flow cytometry
R521
A
10.11958/j.issn.0253-9896.2015.10.018
河北省卫生厅科研基金项目(20130650)
河北省石家庄市第五医院(邮编050021)
许怡(1984),女,主管检验师,硕士,主要从事感染免疫方面研究
△通讯作者E-mail:daieh2008@126.com
