腺病毒介导hBMP-2转染BMSCs复合DBM修复兔缺血性股骨头坏死的实验研究
2015-11-24石正松李强蔡伟良宁寅宽李诗鹏
石正松,李强,蔡伟良,宁寅宽,李诗鹏
腺病毒介导hBMP-2转染BMSCs复合DBM修复兔缺血性股骨头坏死的实验研究
石正松,李强△,蔡伟良,宁寅宽,李诗鹏
目的评价人骨形态发生蛋白(hBMP)-2/骨髓间充质干细胞(BMSCs)/脱钙松质骨(DBM)对兔股骨头坏死的修复作用,探索临床治疗股骨头坏死的新途径。方法髓芯减压联合液氮冰冻法制备兔股骨头坏死模型。将造模成功兔随机分为A、B、C、D 4组(n=12),A组不植入材料,为对照组,B、C、D分别植入DBM、DBM/BMSCs、hBMP-2/BMSCs/DBM。术后4、8及12周各组分别处死4只,运用X线技术、大体标本观察、HE染色技术评判股骨头坏死修复情况。结果X线示A组股骨头塌陷,无明显成骨;B、C、D组股骨头缺损区有骨再生现象,但D组再生情况明显优于B、C组。Lane-Sandhu X线评分A组<B、C组<D组(P<0.05),B和C组差异无统计学意义。大体观示A组股骨头塌陷,钻孔存在;B、C组股骨头未塌陷,钻孔存在;D组股骨头未塌陷,钻孔消失。HE染色示A组骨小梁坏死、碎裂,大量空骨陷窝;B、C组可见成骨细胞及新生幼稚骨小梁;D组大量骨细胞,新生骨小梁与正常骨小梁无异。空骨陷窝率A组>B、C组>D组(P<0.05),B和C组差异无统计学意义。结论hBMP-2/BMSCs/DBM植入体内后能够诱导BMSCs向成骨方向分化,对兔股骨头坏死具有较好的修复效果。
股骨头坏死;疾病模型,动物;腺病毒;骨形态发生蛋白-2;脱钙松质骨基;骨髓间充质干细胞;hBMP-2/ BMSCs/DBM
股骨头坏死(ONFH)确切病因不明,目前公认的致病因素有13种[1]。有研究显示,股骨头缺血性坏死已经替代了髋关节结核,跃居髋关节疾病的首位[2],并且ONFH患者有了年轻化趋势[3]。目前对于ONFH的治疗方法有中医疗法、体外微波冲击治疗、髓芯减压[4]、髋关节置换等多种[5],但是这些疗法均存在不同程度的不良反应。骨组织工程的发展在治疗ONFH方面展现了良好的前景,并逐渐成为研究热点。但是在采用何种种子细胞最好,选取哪种支架材料为宜,如何解决细胞调控因子持续表达的问题方面,国内外相关研究尚无定论[6]。本研究旨在评价由腺病毒介导的人骨形态发生蛋白(hBMP)-2基因转染兔骨髓间充质干细胞(BMSCs)复合脱钙松质骨(DBM)构建而成的组织工程骨(hBMP-2/BMSCs/ DBM)对兔ONFH的修复作用,以期为临床治疗ONFH提供新途径。
1 材料与方法
1.1 实验材料普通清洁级新西兰大白兔48只,雌雄不拘,体质量(3.12±0.19)kg,购于桂林医学院动物中心;hBMP-2/ BMSCs/DBM(本课题组前期已利用腺病毒介导hBMP-2转染BMSCs复合DBM的方法成功构建了的组织工程骨[7]);凝胶海绵(江西祥恩医疗科技发展有限公司);注射用青霉素钠(华北制药公司);4%多聚甲醛(北京索莱宝科技有限公司);10%硝酸溶液(深圳市力科贤科技有限公司);X线摄片机(岛津公司);显微镜(Olympus公司);10%水合氯醛(天津大茂化学试剂厂)。
1.2 方法
1.2.1 模型制作实验动物取右侧股骨头参与实验,参照李海冰等[8]髓芯减压术联合液氮冰冻的操作步骤,实验动物取俯卧位,10%水合氯醛3 mL/kg耳缘静脉注射麻醉。由臀大肌与阔筋膜张肌的间隙进入,暴露臀小肌及髓关节外旋肌群,并贴骨面将其切断,暴露关节囊以后小十字口切开,外旋股骨头,使股骨头暴露而不使其脱位,在大转子下约1 cm处,用直径为3.5 mm的无菌钻头,向股骨头方向打孔,直至软骨下,刮匙刮除股骨头内骨质,液氮持续冷冻,约5 min。
1.2.2 实验分组和材料植入术后4周行X线检测,股骨头较对侧扁平、萎缩为造模成功,模型随机分为A、B、C、D 4组,每组12只。A组为造模组,不做处理;B、C、D各组向钻孔内分别填塞DBM、DBM/BMSCs、hBMP-2/BMSCs/DBM,用医用凝胶海绵封闭隧道口,逐层关闭切口;术后各组均于臀大肌处肌内注射青霉素钠注射液40万U/(只·d),连续给药3 d,预防感染。
1.2.3 X线检查和评分各组分别于术后4、8、12周各选取4只动物于全麻下行双髋关节正位X线检查,以Lane-Sand⁃hu X线评分标准对股骨头修复情况进行评分。
1.2.4 股骨头大体观察行X线检查后处死实验动物,取出双侧股骨,清除表面组织,观察股骨头形态,测量钻孔孔径。
1.2.5 HE染色和镜检沿转子间连线锯断股骨头,将股骨头投入4%多聚甲醛固定5 d,10%硝酸脱钙液中脱钙5 d,梯度乙醇脱水,包埋,行5 μm厚冠状切片,HE染色[9]。A、B、C、D组及正常组(健侧股骨头)标本于倒置显微镜下观察骨小梁形态、成骨细胞并计算空骨陷窝率。空骨陷窝率=空骨陷窝数/总骨陷窝数。
1.3 统计学方法采用SPSS 18.0统计软件进行分析。符合正态分布的计量资料用表示,方差齐者多组之间比较采用单因素方差分析,组间多重比较采用LSD-t检验;方差不齐者采用Mann-Whitney U法。检验水准α=0.05。
2 结果
2.1 X线观察A组术后4周时,实验侧股骨头钻孔清晰可见,边缘锐利,骨缺损区呈现低密度影,部分标本出现了小囊性变,股骨头轮廓欠规则,扁平塌陷,密度不均;术后8周时,低密度透光区仍然清晰可见,缺损区周围有骨吸收现象,股骨头关节面进一步塌陷,且骨小梁结构不清晰;12周时股缺损区仍然透亮,股骨头外形缩小,缺损严重,完全塌陷,见图1a。B组术后4周时,股骨头骨密度降低,缺损区仍然存在,填充材料呈高密度影,未见明显吸收,周围见明显透光区,股骨头无塌陷;术后8周时,股骨头形态仍正常,填充材料周围透光区仍清晰,钻孔区密度高而均匀,钻孔边缘出现放射状骨小梁接合现象,但骨小梁结构比较紊乱;12周股骨头缺损区仍然存在,填充材料呈高密度影,体积较前略变小,与周围边界模糊,缺损区可见少许成骨反应及松散骨小梁结构,见图1 b。C组4、8、12周变化与B组大致相同,见图1c。D组术后4周时,人工骨影模糊,钻孔区有密度增高影,质地均匀,钻孔边缘变得模糊;术后8周时,人工骨影缩小,边界不清,周围透光区影模糊;12周股骨头内出现规则连续骨小梁,钻孔边
缘与人工骨交界区骨小梁接合很好,界限模糊,看不到骨缺损的低密度影,钻孔区骨密度接近周围骨质,未出现股骨头塌陷和关节间隙狭窄等骨性关节炎表现,见图1d。除B和C组4、8及12周的Lane-Sandhu X线评分差异均无统计学意义外,其他各组比较差异均有统计学意义,见表1。

Fig.1X-ray observation at 12周after operation图1 术后12周X线观察
Tab.1Lane-Sandhu X-ray score in each group at different time points表1 各组不同时间Lane-Sandhu X线评分比较(n=4,分,)

Tab.1Lane-Sandhu X-ray score in each group at different time points表1 各组不同时间Lane-Sandhu X线评分比较(n=4,分,)
**P<0.01;a与A组比较,b与B组比较,c与C组比较,P<0.05
组别A组B组C组D组F 4周0.75±0.50 1.75±0.50a 2.00±0.82a 5.00±0.82abc 29.273**8周1.25±0.50 4.25±0.50a 4.00±0.82a 6.75±0.50abc 57.118**12周3.25±0.50 5.00±0.82a 5.25±0.96a 10.25±0.50abc 69.560**
2.2 标本大体观察A组术后4周钻孔存在,孔径(3.200±0.163)mm,钻孔周围可见少许纤维组织,股骨头部分塌陷;8周孔径(3.225±0.150)mm,纤维组织继续增生;12周钻孔依然存在,孔径(3.275± 0.096)mm,股骨颈缩短,周围可见大量鲜红色纤维组织覆盖,股骨头完全塌陷,见图2a。B组术后4周钻孔清晰可见,孔径(3.000±0.141)mm,股骨头未见塌陷;8周时钻孔呈椭圆形,长径(2.776±0.151),周围可见少许成骨,股骨头无塌陷;12周时钻孔呈不规则形,长径(2.500±0.141)mm,股骨头无塌陷,见图2b。C组术后4周仍可见钻孔,孔径(3.200±0.163) mm,股骨头无塌陷;8周时孔径(2.825±0.126)mm,钻孔周围有少许成骨,股骨头未见塌陷;12周时钻孔径(2.475±0.170)mm,可见成骨反应,股骨头无塌陷,见图2c。D组术后4周可见钻孔不规则改变,孔径(2.475±0.170)mm,周围可见少许成骨反应,股骨头未见塌陷;8周时孔径(1.500±0.216)mm,周边可见明显成骨反应,开始有新生骨长入缺损区,色泽近似周围组织;12周钻孔已经完全消失,完全被新生骨替代,钻孔区仅残留少许结节样修复痕迹,新生骨色泽与正常组织无明显差异,股骨头完好,见图2d。
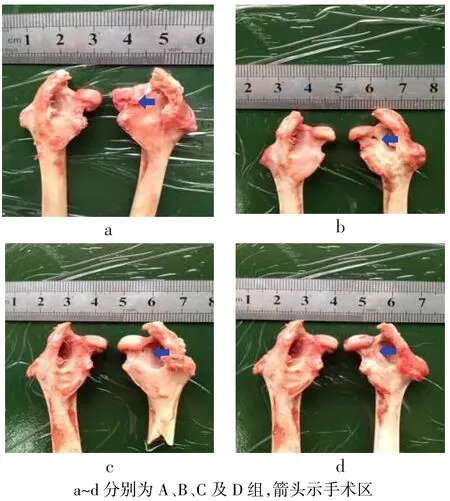
Fig.2General observation of the specimen after 12 weeks图2 术后12周大体观察
2.3 HE染色结果股骨头正常结构可见大量骨髓组织,骨小梁规则,骨细胞形态正常,见图3a。A组术后4周时骨小梁疏松,部分断裂,大量骨细胞坏死;8周时骨小梁结构紊乱、坏死,部分坏死骨小梁开始吸收,出现较多破骨细胞;12周时骨小梁广泛断裂、坏死、吸收,髓腔内出现大量坏死组织,空骨陷窝被挤压变形,见图3b。B组术后4周骨小梁结构不规则,少许断裂,软骨细胞、骨细胞、骨髓细胞坏死量较A组少;8周时可见成骨反应,出现少许结构不规则的幼稚骨小梁;12周时缺损区周边有成骨反应,有向中心部生长的趋向,新生骨小梁较前增多,但仍为幼稚骨小梁,仍可见坏死骨组织,见图3c。C组变化与B组大致相当,见图3d。D组术后4周充填区周边出现反应带,为软骨性骨痂形成,孔隙内见纤维肉芽组织及毛细血管长入,未见淋巴细胞浸润等炎症反应;8周周边新骨带明显增宽,成骨反应向中心部推进,而中心部空腔面积明显减小,部分充填
区基本为幼稚的骨小梁所占据,表面有较多的成骨细胞;12周时充填区分布相对较成熟的骨小梁致密饱满,无硬化带形成,表面骨细胞数量较多且清晰可见,见图3e。除B和C组术后各时间点空骨陷窝率、D组和正常侧组12周时差异无统计学意义外,其他各组比较差异均有统计学意义,见表2。
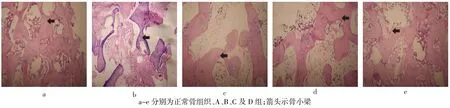
Fig.3Observation of bone trabeculars after 12 weeks(HE,×100)图3 术后12周骨小梁观察(HE,×100)
Tab.2Ratio of Empty Lacuna in each group at each time points表2 各组不同时间空骨陷窝率比较(n=4,)

Tab.2Ratio of Empty Lacuna in each group at each time points表2 各组不同时间空骨陷窝率比较(n=4,)
**P<0.01;a与A组比较,b与B组比较,c与C组比较,d与D组比较,P<0.05
12周0.361±0.031 0.304±0.024a 0.292±0.007a 0.152±0.012abc 0.135±0.009abc 108.153**组别A组B组C组D组正常组F 4周0.569±0.027 0.417±0.024a 0.415±0.047a 0.358±0.014abc 0.136±0.012abcd 128.551**8周0.474±0.017 0.365±0.010a 0.379±0.019a 0.224±0.021abc 0.121±0.007abcd 307.739**
3 讨论
ONFH是一种由多种因素共同作用导致股骨头血液供应受损和骨组织坏死的复杂病理过程[10]。ONFH具有终身渐进性和难治性,对髋关节有很大破坏性,预后大多不良[11-12]。目前ONFH病例约为500~750万,约占我国总人口的0.38%~0.58%,并且每年约有10~15万的新发病例出现[13]。
大量研究表明,BMSCs具有多向分化能力,免疫原性小、增殖能力强、来源充足、取材广泛等诸多优点,目前在组织工程和临床上已经广泛使用[14]。骨形态发生蛋白(BMP)具有诱导成骨作用,其中BMP-2成骨诱导作用最强,被认为是最有前途的骨诱导物质[15]。良好的支架材料不但要具有较好的吸附性和细胞安全性,还应该具有较好的组织相容性。目前学术界使用较多的支架材料有羟基磷灰石、壳聚糖、丝素蛋白、赖氨酸盐酸盐、钽金属,也有学者运用多种材料复合来作为支架材料,但是无论是这些单一材料还是复合材料,其本质均是化学原料,其植入动物体内后的相容性均不理想。DBM是用兔同种异体骨,采用Urist法制作成的脱钙松质骨,具备良好的黏附率和孔隙率,利于种子细胞的黏附和生存,且其生物组织相容性远优于上述化学材料,是比较理想的生物支架材料[16-17]。本实验采用腺病毒介导hBMP-2转染兔BMSCs复合DBM的方法体外构建组织工程骨,然后将该组织工程骨植入兔ONFH模型中进行观察,以评估hBMP-2/BMSCs/DBM对ONFH的效果。
本研究中X线检测示A组股骨头随着时间的推移,外观逐渐变形、塌陷,提示其已经坏死,钻孔缺损区增大,可能为坏死骨质吸收所致;B、C、D组股骨头外形未见塌陷,缺损区均有新生骨出现,但是D组新生骨量大于B、C 2组,提示hBMP-2/BMSCs/ DBM的修复效果好于单纯DBM和BMSCs。Lane-Sandhu X线评分标准是从骨形成、骨连接、骨塑性3个方面对骨的修复效果进行评价。各组在术后随时间延长,评分依次增高,提示随着时间的推移,4组缺损均有修复,但是A组修复效果最微弱,D组修复作用最强,B、C 2组修复作用居于二者之间,此与Xiao等[18]结论近似。
本研究股骨头大体观察示A组钻孔大而边缘规则,表明A组钻孔周围未见修复或修复作用微弱,B、C组钻孔较A组变小且形状改变,D组钻孔完全消失,提示B、C、D组有明显修复效果,且D组修复效果优于B、C组。正常骨组织中骨细胞核呈嗜碱性,细胞外基质和骨小梁呈嗜酸性,坏死的骨细胞会溶解吸收,留下空的骨陷窝,坏死的骨小梁会由嗜酸性变为嗜碱性。苏木素会与嗜碱性颗粒结合将其染成蓝色,伊红会与嗜酸性颗粒结合将其染成红色。A组中可见骨小梁稀疏,大部分染成蓝色,表明其骨小梁已经大部分坏死并被吸收,B、C组中骨小梁尚可,但有少许亦出现蓝染,D组中骨小梁饱满,未见蓝染,提示B、C、D组中股骨头均有修复,且D
组修复作用优于B、C组。
正常骨组织中由于细胞凋亡作用会存在一些空骨陷窝,但是其空骨陷窝率一般为12%左右。本研究显示,随着时间的推移和修复的进行,B、C组空骨陷窝率小于A组,但是仍然大于正常组,表明B、C组的修复作用优于A组,但是与正常水平仍有差距,D组12周时的空骨陷窝率与对侧正常股骨头空骨陷窝率差异无统计学意义,表明D组股骨头已经修复至正常水平。
综上所述,hBMP-2/BMSCs/DBM对ONFH有明显的修复作用,且其修复效果远远优于单纯DBM组和BMSCs/DBM组。虽然本研究通过组织工程方法在成骨方面已经取得一定成效,但是在成骨的同时亦发现其成血管能力较弱,如何在成骨的同时增加血管的再生能力尚需要进一步研究深入。
[1]Kim SY,Kim TH.Genetic Studies in Osteonecrosis of the Femoral Head[M]//Osteonecrosis.Springer Berlin Heidelberg,2014:61-69.
[2]Chamberlain JR,Schwarze U,Wang PR,et al.Gene targeting in⁃stem cells from individuals with osteogenesis imperfecta[J].Science,2004,303(4):1198-1201.
[3]Tan G,Kang PD,Pei FX.Glucocorticoids affect the metabolism of bone marrow stromal cells and lead to osteonecrosis of the femoral head:a review[J].Chin Med J,2012,125(1):134-139.doi:l0.3760/ cma.j.issn.0366.6999.2012.01.025.
[4]Wang CJ,Huang CC,Wang JW,et al.Long-term results of extracor⁃poreal shockwave therapy and core decompression in osteonecrosis of the femoral head with eight-to nine-year follow-up[J].Biomed J, 2012,35(6):481-485.doi:10.4103/2319-4170.104413.
[5]Pittenger MF,Mackay AM,Beck SL,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284(5411): 143-147.
[6]Bose S,Roy M,Bandyopadhyay A.Recent advances in bone tissue engineering scaffolds[J].Trends Biotechnol,2012,30(10):546-554.doi:10.1016/j.tibtech.2012.07.005.
[7]Chen JB,Li Q,Ru J,et al.Construction of tissue engineering bone with Ad-BMP-2-and EGFP-transfected bone marrow stromal cells and DBM in vitro[J].Chinese Journal of Osteoporsis,2014,20(8): 869-874.[陈佳滨,李强,茹嘉,等.腺病毒介导BMP-2和EGFP基因转染兔骨髓基质干细胞及种植脱钙骨的体外观察[J].中国骨质疏松杂志,2014,20(8):869-874].doi:10.3969/j.issn.1006-7108.2014.08.002.
[8]Li HB,Qu XY,Li M,et al.Use the subchondral drilling combined with liquid nitrogen freezing to prepare rabbit femoral head necrosis models[J].Third Mil Med Univ,2014,36(19):2051-2054.[李海冰,瞿向阳,李明,等.应用软骨下钻孔结合液氮冷冻制作兔股骨头缺损坏死模型[J].第三军医大学学报,2014,36(19):2051-2054].
[9]Zhang YR,Ma H,Zhang H,et al.The experimental study on the re⁃pair of ANFH in rabbit with the BMP-2 gene transfected autologons BMSCs[J].Chinese Journal of Clinical Anatomy,2013,31(4):447-452.[张雁儒,马辉,张辉,等.BMP-2转染BMSCs修复兔ONFH模型的实验研究[J].中国临床解剖学杂志,2013,31(4):447-452].
[10]Lu B,Tang TT,Yue B,et al.BMP-2 gene delivery repair experimental sheep femoral head necrosis[J].Chinese Journal of Orthopaeddics,2005, 25(10):603-607.[陆斌,汤亭亭,岳冰,等.BMP-2基因给药修复实验性羊ONFH[J].中华骨科杂志,2005,25(10):603-607].
[11]Chen C,Yang S,Feng Y,et al.Impairment of two types of circulating endothelial progenitor cells in patients with glucocorticoid-induced avascular osteonecrosis of the femoral head[J].Joint Bone Spine, 2013,80(1):70-76.doi:10.1016/j.jbspin.2012.02.015.
[12]Teng M,Geng Z,Huang L,et al.Stem cell transplantation in cardio⁃vascular disease:An update[J].Journal of International Medical Re⁃search,2012,40(3):833-838.
[13]Zhou CY.Experimental study on treatment of early steroid-induced avascular necrosis of femoral head in rabbit with BMSCs and rh⁃BMP-2/rhVEGF transplantation[D].ANHUI MEDICAL UNIVERSI⁃TY,2011.doi:10.3969/j.issn.1006-2084.2011.12.040.[周传友.骨髓基质干细胞联合rhBMP-2/rhVEGF治疗兔早期激素性股骨头缺血性坏死的实验研究[D].安徽医科大学,2011].doi:10.3969/j. issn.1006-2084.2011.12.040.
[14]Lebouvier A,Poignard A,Cavet M,et al.Development of a simple procedure for the treatment of femoral head osteonecrosis with in⁃tra-osseous injection of bone marrow mesenchymal stromal cells: study of their biodistribution in the early time points after injection[J].Stem Cell Research&Therapy,2015,6(1):68.doi:10.1186/ s13287-015-0036-y.
[15]Sekiya I,Larson BL,Vuoristo JT,et al.Adipogenic differentiation of human adult stem cells from bone marrow stroma(MSCs)[J].J Bone Miner Res,2004,19(2):256-264.doi:10.1359/JBMR.0301220.
[16]Li Q,Tang JC,Wang RY,et al.Biological characteristics of fully de⁃mineralized cancellous bone matrix[J].Journal of Clinical Rehabili⁃tative Tissue Engineering Research,2009,13(47):9257-9260.
[17]Li Q,Sun ZY,Yan DX,et al.Biological characteristics of demineral⁃ized bone matrix:degradation capacity,interval porosity and adhe⁃sion rate[J].Journal of Clinical Rehabilitative Tissue Engineering Research,2007,11(31):6121-6124.[李强,孙正义,严冬雪,等.脱钙骨基质材料的生物学表现:降解性能、孔隙率及其黏附性能特征[J].中国组织工程研究与临床康复,2007,11(31):6121-6124].
[18]Xiao ZM,Jiang H,Zhan XL,et al.Treatment of osteonecrosis of femo⁃ral head with BMSCs-seeded bio-derived bone materials combined with rhBMP-2 in rabbits[J].Chin J Traumatol,2008,11(3):165-170.
(2015-05-13收稿 2015-07-10修回)
(本文编辑 陆荣展)
Rehabilitation effect of BMSCs that was transfected with hBMP-2 through adenovirus combination with DBM on rabbit osteonecrosis in femoral head
SHI Zhengsong,LI Qiang△,CAI Weiliang,NING Yinkuan,LI Shipeng
Department of Emergency Traumatic Surgery,the Affilated Hospital of Guilin Medical University,Guilin,Guangxi 541001,China△
ObjectiveTo evaluate the effect of human bone morphogenetic protein 2(hBMP-2)/Bone Mesenchymal Stem Cells(BMSCs)/demineralized bone matrix(DBM)on repairing rabbits'femoral head after necrosis and to explore the new treatments for femoral head necrosis.MethodsFemoral head necrosis models was established by clinical core decom⁃pression combined with liquid nitrogen frozen.Then,animals were randomly devided into 4 groups(n=12 per group):Group A were not implanted anything as control group,Group B were implanted with DBM.Group C were implanted with hBMP-2/ DBM.Group D were implanted with hBMP-2/BMSCs/DBM.Four rabbits from each group were sacrificed at 4,8 and 12 weeks after surgery to evaluate the the repairing effect of Osteonecrosis of the femoral head(ONFH)through X-ray examina⁃tion,observation of the specimen and HE staining.ResultsX-ray revealed defect of femoral head in Group A without clear bone formation.There is a little fibrous hyperplasia and no obvious osteogenic response.By contrast,the femoral head defect areas became fuzzy in group B,group C and group D with new bone trabeculars.And the regenerate phenomenons of group D were significantly better than that of group B and group C of the same time point.As to the Lane-Sandhu X Ray scores,it is lower in group A than that in group B;It is lower in group C than that in group D(P<0.05).There is no statistical difference between Group B and Group C.General observation of the specimen revealed that the femoral head of group A collapsed with drilling holes.The femoral heads of group B and group C showed no collapse but the drilling holes existed.Femoral head in group D was not collapsed and the drilling holes disappeared.HE staining showed that bone trabeculars became ne⁃crotic and fragmented in Group A with a lot of air trapped cells.There were newborn immature bone trabeculars and osteo⁃
femur head necrosis;disease models,animal;adenovirus;bone morphogenetic protein-2;demineralized bone matrix;bone marrow mesenchymal stem cells;hBMP-2/BMSCs/DBM
R687.3
A
10.11958/j.issn.0253-9896.2015.10.012
国家自然科学基金资助项目(31160199);广西自然科学基金资助项目(2014jjAA40064)
桂林,桂林医学院附属医院急诊创伤外科(邮编541001)
石正松(1987),男,硕士在读,主要从事骨组织工程研究
△通讯作者E-mail:li.q12251970@163.com
blasts in group B and group C.Group D were of large number of bone cells,fat cells,and newborn mature bone trabeculars. The ratio of empty lacuna is higher in Group A than that in Group B;it is higher in Group C than that in Group D(P<0.05). ConclusionhBMP-2/BMSCs/DBM can induce BMSCs differentiation into osteoblasts after being implanted.It has good re⁃pairing effect on ONFH with good application prospect.
