槲皮素对肝细胞氧化应激损伤的保护作用
2015-11-24沈钦海秦召敏刘丽岳淑英吕建华鲁艳芹
沈钦海,秦召敏△,刘丽,岳淑英,吕建华,鲁艳芹
槲皮素对肝细胞氧化应激损伤的保护作用
沈钦海1,秦召敏1△,刘丽1,岳淑英1,吕建华1,鲁艳芹2
目的探讨槲皮素对氧化应激Chang liver细胞损伤的保护作用及其作用的分子机制。方法培养Chang liver细胞,将细胞随机分为正常对照组、H2O2组及槲皮素低、中、高剂量组。MTT法检测肝细胞的存活率;流式细胞术检测细胞凋亡率。2′,7′-二氯荧光素乙二酯(DCFH-DA)细胞内活性氧(ROS)荧光染色后,荧光显微镜观察照相及流式细胞仪检测细胞内活性氧水平。试剂盒测定细胞中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)活性及细胞中丙二醛(MDA)的含量。采用Western blot法检测Nrf2蛋白的表达。结果H2O2组较正常对照组细胞存活率、SOD、GSH-Px、CAT活性降低(P<0.05),凋亡率、平均荧光强度(MFI)及MDA升高(P<0.05)。不同剂量槲皮素组细胞存活率及细胞内SOD、GSH-Px、CAT活性高于H2O2组(P<0.05),MDA、凋亡率、MFI水平低于H2O2组(P<0.05)。槲皮素低、中及高剂量组Nrf2蛋白均高于H2O2组(P<0.05)。结论槲皮素对氧化应激肝细胞损伤具有保护作用,其机制可能与激活Nrf2-ARE通路,进而增强下游抗氧化基因的表达有关。
槲皮素;氧化性应激;超氧化物歧化酶;过氧化氢酶;谷胱甘肽过氧化酶;Chang liver细胞;Nrf2/ARE通路
研究认为,氧化应激与肝脏疾病的发生密切相关[1]。其主要通过启动膜脂质过氧化、改变生物膜功能、与生物大分子共价结合及破坏酶的活性等引起不同程度的肝损伤[2]。转录因子NF-E2相关因子2(Nrf2)及其诱导的下游靶基因是机体细胞最重要的抗氧化防御机制之一[3]。在氧化应激过程中,Nrf2被激活诱导靶基因保护肝脏[4]。槲皮素(quercetin)是一种天然黄酮类化合物,广泛存在于蔬菜、水果和茶叶中[5]。研究证实,槲皮素可通过降低脂质过氧化物水平、增加抗氧化系统的能力,从而对氧化损伤的肝
脏发挥保护效应[6];还可通过增加Nrf2的表达,提高细胞的抗氧化能力[7]。本研究利用H2O2在体外诱导Chang liver细胞建立肝损伤模型,旨在探讨槲皮素对肝细胞的保护作用及其抗氧化作用的机制。
1 材料与方法
1.1 材料Chang liver细胞购自中南大学湘雅中心实验室;2′,7′-二氯荧光素探针(2′,7′-dichlorofluorescin diacetate,DCFH-DA)、槲皮素、H2O2、四甲基偶氮唑蓝(MTT)及二甲基亚砜(DMSO)购自美国Sigma公司;胰蛋白酶及胎牛血清购自美国Hyclone公司;超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)试剂盒均购于南京建成生物工程研究所;Nrf2、β-actin抗体均购于美国Santa Cruze公司;RPMI-1640细胞培养基、硝酸纤维素膜购于美国Gibco公司。
1.2 细胞培养及分组Chang liver细胞培养于含10%优质胎牛血清RPMI-1640培养液中,加入1×105U/L青霉素和100 mg/L链霉素,于37℃、5%CO2中培养,每2~3 d用0.25%胰酶消化传代,直至细胞处于对数生长期。细胞随机分为正常对照组、H2O2组、槲皮素低剂量组、槲皮素中剂量组及槲皮素高剂量组。正常对照组仅用无血清培养基培养细胞,不加任何药物处理;H2O2组用无血清培养基预培养24 h,换液后加入含400 μmol/L H2O2的无血清培养基继续培养12 h;槲皮素各浓度组分别用含20、40、80µmol/L槲皮素的无血清培养基预培养24 h。
1.3 MTT检测细胞活力取对数生长期Chang liver细胞,以5×104个/孔的浓度接种于96孔板,200 μL/孔,每组3个复孔,各组处理时间终止时去除培养基,分别加入MTT,终浓度为0.5 g/L,37℃继续培养4 h后终止培养,吸弃孔内培养液;每孔加入150 μL DMSO,摇床上震荡10 min,使结晶物充分溶解;在酶标仪上490 nm波长处测定各孔光密度(OD)值。求出各实验组的细胞存活率。细胞存活率=实验组OD/对照组OD×100%。
1.4 流式细胞术检测细胞凋亡峰及凋亡率细胞接种于6孔培养板,按上述要求给予不同因素的处理后,收集各组肝细胞,离心,PBS洗涤3次,70%冰乙醇固定,制成5×106个/L细胞悬液,加样入流式细胞仪检测凋亡峰及凋亡率。
1.5 细胞内活性氧(ROS)的检测
1.5.1 显微镜观察及检测细胞内ROS各组处理时间终止后,用PBS洗涤3次,用10 μmol/L DCFH-DA染液于37℃孵育30 min,PBS洗涤3次,以充分去除未进入细胞内的DCFH-DA,于荧光显微镜下观察。
1.5.2 流式细胞仪检测胞内ROS各组处理时间终止后经PBS清洗2次,收集细胞,加入10 μmol/L DCFH-DA染液于37℃孵育30 min,用PBS洗涤3次,以充分去除未进入细胞内的DCFH-DA,用流式细胞仪以激发波长为488 nm,发射波长525 nm,检测平均荧光强度(MFI),该值代表细胞内活性氧水平。
1.6 细胞中SOD、GSH-Px、CAT活性及MDA含量检测各组处理时间终止后,用0.25%胰蛋白酶消化贴壁的Chang liver细胞,收集各组细胞,将细胞加100 μL细胞裂解液充分裂解后,按照试剂盒说明书检测细胞中SOD、CAT、GSH-Px活性及MDA含量。
1.7 Western blot检测Nrf2的表达各组处理时间终止后,收集细胞,用PBS洗涤3次,加入裂解液充分裂解,冰上裂解1 h。4℃,12 000 r/min离心15 min,取上清液进行蛋白质定量,取30 μg总蛋白样品在SDS-PAGE凝胶上电泳分离后,转移到硝酸纤维素膜上,用5%脱脂奶粉室温封闭1 h,用稀释的Nrf2一抗及标准内参β-actin孵育,4℃过夜。洗膜后加稀释的二抗室温孵育2 h,滴加电化学发光(ECL)试剂,显影、定影,结果用灰度比值表示。
1.8 统计学方法采用SAS 6.12软件进行分析。符合正态分布的计量资料以均数±标准差表示。多组间均数比较采用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
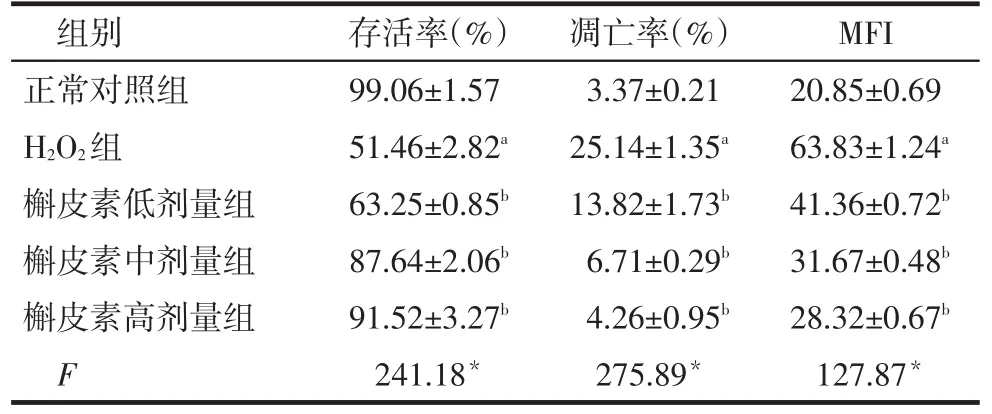
2.1 MTT检测细胞存活率H2O2组较正常对照组细胞存活率降低,不同剂量槲皮素组细胞存活率较H2O2组升高(P<0.05),见表1。
Tab.1Effects of quercetin on MFI,survival rate and appotosis rate表1 槲皮素对存活率、细胞凋亡率及平均荧光强度的影响(n=3)
Tab.1Effects of quercetin on MFI,survival rate and appotosis rate表1 槲皮素对存活率、细胞凋亡率及平均荧光强度的影响(n=3)
*P<0.05,**P<0.01;a与正常对照组比较,b与H2O2组比较,P<0.05;表2同
组别正常对照组H2O2组槲皮素低剂量组槲皮素中剂量组槲皮素高剂量组F存活率(%)99.06±1.57 51.46±2.82a 63.25±0.85b 87.64±2.06b 91.52±3.27b 241.18*凋亡率(%)3.37±0.21 25.14±1.35a 13.82±1.73b 6.71±0.29b 4.26±0.95b 275.89*MFI 20.85±0.69 63.83±1.24a 41.36±0.72b 31.67±0.48b 28.32±0.67b 127.87*
2.2 流式细胞术检测细胞凋亡率H2O2组较正常对照组凋亡率增高(P<0.05),且在正常二倍体细胞周期G0/G1峰前出现一个特征性的凋亡峰。不同剂量槲皮素组较H2O2组细胞凋亡率下降(P<0.05),且凋亡峰变小,见表1、图1。
2.3 ROS结果H2O2组较正常对照组的MFI增强,不同剂量槲皮素组MFI较H2O2组减弱(P<0.05),见表1、图2。
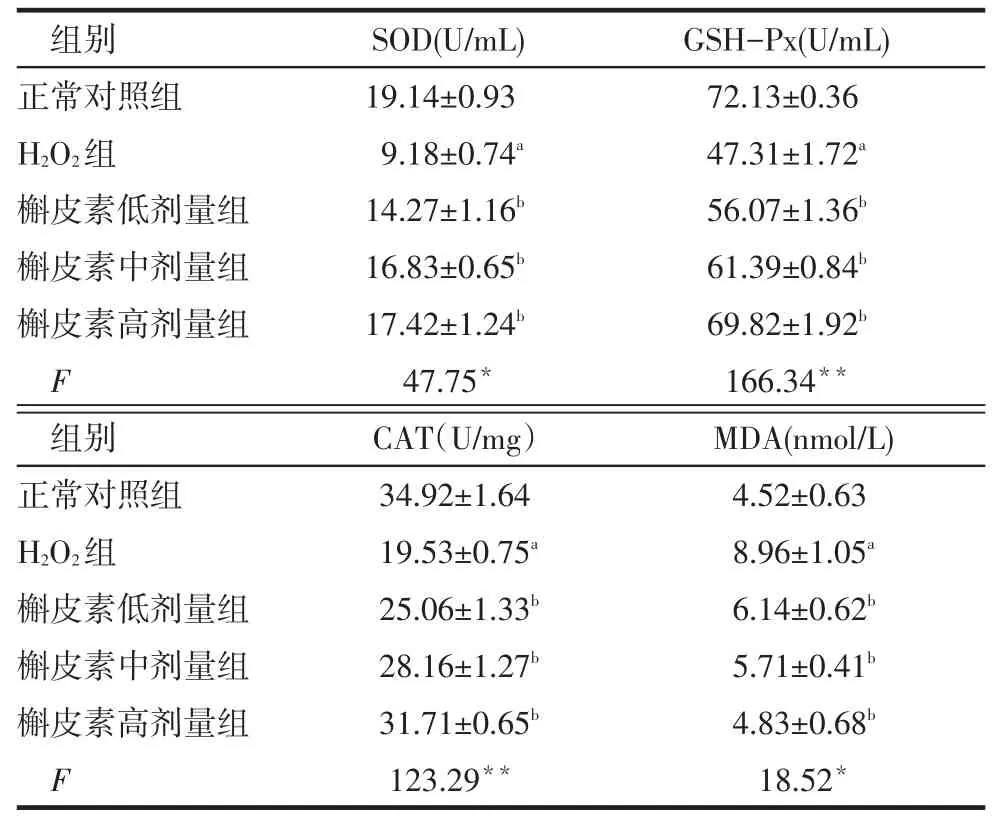
2.4 细胞中SOD、GSH-Px、CAT活性及MDA含量H2O2组较正常对照组SOD、GSH-Px、CAT活性降低,MDA含量升高;不同剂量槲皮素组较H2O2组SOD、GSH-Px、CAT活性增加,MDA含量下降(P<0.05),见表2。

Fig.1Results of apoptosis detected by flow cytometry in five groups of cells图1 各组细胞流式细胞检测凋亡图
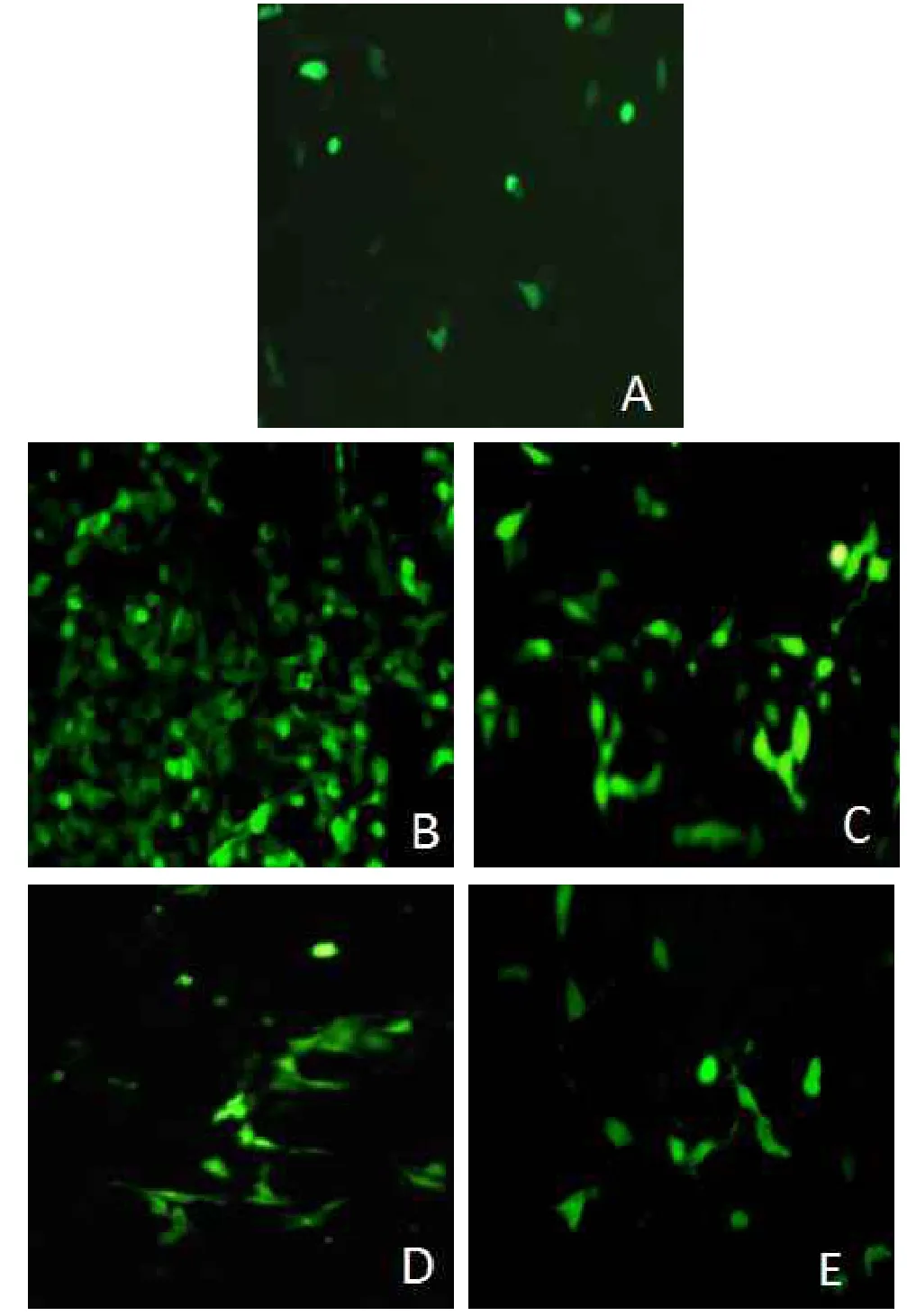
Fig.2ROS level in Chang liver cells observed under fluorescent microscope(×200)图2 荧光显微镜观察肝细胞中的ROS生成(×200)
Tab.2Effects of quercetin on lipid peroxidation and anti-oxidant enzyme activity表2 槲皮素对脂质过氧化及抗氧化酶的影响(n=3,)
Tab.2Effects of quercetin on lipid peroxidation and anti-oxidant enzyme activity表2 槲皮素对脂质过氧化及抗氧化酶的影响(n=3,)
组别正常对照组H2O2组槲皮素低剂量组槲皮素中剂量组槲皮素高剂量组F SOD(U/mL)19.14±0.93 9.18±0.74a 14.27±1.16b 16.83±0.65b 17.42±1.24b 47.75*GSH-Px(U/mL)72.13±0.36 47.31±1.72a 56.07±1.36b 61.39±0.84b 69.82±1.92b 166.34**组别正常对照组H2O2组槲皮素低剂量组槲皮素中剂量组槲皮素高剂量组F CAT(U/mg)34.92±1.64 19.53±0.75a 25.06±1.33b 28.16±1.27b 31.71±0.65b 123.29**MDA(nmol/L)4.52±0.63 8.96±1.05a 6.14±0.62b 5.71±0.41b 4.83±0.68b 18.52*
2.5 Western blot检测Nrf2蛋白表达正常对照组、H2O2组及槲皮素低、中、高剂量组Nrf2的相对含量分别为0.24±0.02、0.35±0.01、0.46±0.04、0.58± 0.03及0.62±0.05(F=63.94,P<0.05),其中槲皮素低、中及高剂量组均高于H2O2组(P<0.05),见图3。
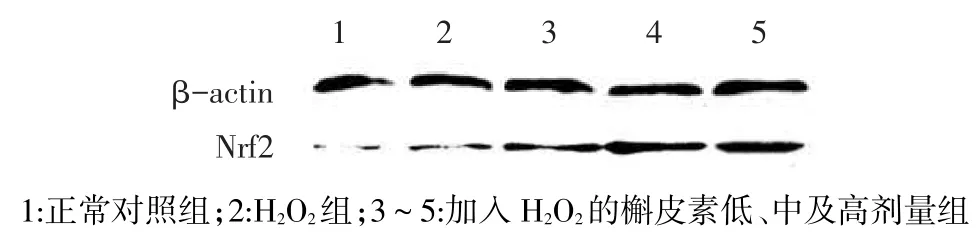
Fig.3Expression of Nrf2 shown by Western-blot图3 免疫印迹法检测细胞中Nrf2蛋白的表达
3 讨论
氧化应激是指各种原因导致机体组织或细胞内氧自由基生成增加和(或)清除能力降低,导致ROS在体内或细胞内蓄积而造成组织、细胞损伤的一种状态。ROS包括过氧化物、H2O2、羟自由基以及需氧反应中产生的各种有害产物[8]。本实验采用H2O2作用于Chang liver细胞,成功复制氧化应激模型,结果显示,不同剂量槲皮素组较H2O2组存活率增加,凋亡率减少,表明槲皮素能明显提高细胞存活率,减少细胞凋亡。
ROS能够使细胞膜上的脂类氧化,产生MDA,从而造成细胞损伤并引发凋亡。研究表明,槲皮素在体外可通过与金属离子结合、清除ROS等自由基及抑制DNA损伤等发挥抗氧化作用[9]。本研究显示,H2O2组较正常对照组MFI增强,MDA上升,不同剂量槲皮素组较H2O2组MFI减弱,MDA降低,提示槲皮素能够降低H2O2对肝细胞造成的损伤。SOD、
GSH-Px及CAT均属于内源性的抗氧化酶,能够直接清除ROS。本研究结果表明,H2O2处理可使正常肝细胞胞内SOD、GSH-Px及CAT活性降低,而槲皮素预处理后可明显增加H2O2处理后细胞内SOD、CAT和GSH-Px活性。Nrf2属于Cap′-n′-Collar(CNC)家族的转录因子[10]。通常情况下,Nrf2与其特异性受体——Kelch样环氧氯丙烷相关蛋白1(Ke⁃apl)偶联结合于胞浆而使Nrf2活性处于相对抑制状态。当氧化应激发生时,Keapl的某些半胱氨酸残基的疏基形成二硫键,从而改变了其构象,使Nrf2与Keapl解耦联,转入细胞核内[11]。转入核内的Nrf2与抗氧化反应元件(ARE)结合,调节下游包括HO-1、γ-GCS、NQ01等多种抗氧化基因的表达[12]。当细胞受到毒物或者氧化物质作用时,Nrf2蛋白发生磷酸化解偶联,进入细胞核内启动细胞内源性抗氧化应激蛋白基因等多种细胞内自我防御基因的表达,从而增强细胞的抗氧化应激能力[13]。另外,各组肝细胞Nrf2蛋白的表达结果显示,氧化应激中Nrf2蛋白的表达上调,表明氧化应激可激活Nrf2-ARE通路,启动内源性保护机制,即通过调控的第Ⅱ相解毒酶及抗氧化酶基因表达而达到抗氧化应激作用。槲皮素各组Nrf2表达高于H2O2组,表明槲皮素本身能够增加Nrf2的表达,与文献[7]结果一致,提示为提高细胞的抗氧化能力,在加入H2O2后可进一步增加Nrf2蛋白的表达。
综上所述,经槲皮素预处理可抑制细胞凋亡,提高细胞存活率,保护体外培养的肝细胞,这种保护作用可能与Nrf2-ARE通路的激活,进而增强体内抗氧化性应激系统、清除氧自由基、抗脂质过氧化、降低细胞凋亡有关。
[1]Cederbaum AI,Lu Y,Wu D.Role of oxidative stress in alcohol-in⁃ duced liver injury[J].Arch Toxicol,2009,83(6):519-548.
[2]Poli G.Pathogenesis of liver fibrosis:role of oxidative stress[J].Mol Aspects Med,2000,21(3):49-98.
[3]Myers CR.The effects of chromium(VI)on the thioredoxin system: Implications for regulation[J].Free Radic Bio Med,2012,52(10): 2091-2107.
[4]Bataille AM,Manautou JE.Nrf2:a potential target for new therapeutics in liver disease[J].Clin Pharmacol Ther,2012,92(3):340-348.
[5]Wach A,Pyrzynska K,Biesaga M.Quercetin content in some food and herbal samples[J].Food Chem,2007,100(2):699-704.
[6]Kukongviriyapan U,Sompamit K,Pannangpetch P,et al.Preventive and therapeutic effects of quercetin on lipopolysaccharide-induced oxidative stress and vascular dysfunction in mice[J].Can J Physiol Pharmacol,2012,90(10):1345-1353.
[7]Hou W,Liu S,Yao P,et al.Potential molecular mechanisms of qner⁃cetin-induced heme oxygenase-1 in rat primary hepatocytes[J]. Chin J Hepatol,2013,21(11):865-868.[侯伟,刘爽,姚平,等.槲皮素诱导大鼠肝细胞I型血红素氧化酶表达的分子机制[J].中华肝脏病杂志,2013,21(11):865-868].
[8]Kisseleva T,Brenner DA.Role of hepatic stellate cells in fibrogene⁃sis and the reversal of fibrosis[J].J Gastraenterol Hepatol,2007,22(1):S73-78.
[9]Li Y,Deng Y,Tang Y,et al.Quercetin protects rat hepatocytes from oxidative damage induced by ethanol and iron by maintaining inter⁃cellular liable iron pool[J].Hum Exp Toxicol,2014,33(5):534-541.
[10]Zhu J,Wang H,Ji X,et al.Differential Nrf2 expression between gli⁃oma stem cells and non-stem-like cells in glioblastoma[J].Oncol Lett,2014,7(3):693-698.
11]Copple IM,Goldring CE,Kitteringham NR,et al.The Nrf2-Keapl defense pathway:role in protection against drug-induced toxicity[J]. Toxicology,2008,246(1):24-33.
[12]Lee JM,Li J,Johnson DA,et al.Nrf2,a multi-organ protector[J]?FASEB J,2005,19(9):1061-1066.
[13]McMahon M,Thomas N,Itoh K,et al.Dimerization of substrateadap⁃tors can facilitate cullin-mediated ubiquitylation of proteins by a“tetllering”mechanism:a two-site interaction model for by a“tetller⁃ing”mechanism:a two-site interaction model for theNrf2-keapl complex[J].J BioI Chem,2006,281(34):24756-24768.
(2015-02-16收稿 2015-04-07修回)
(本文编辑 陆荣展)
Protective effects of quercetin on hepatic cell damage induced by oxidative stress
SHEN Qinhai1,QIN Zhaomin1△,LIU Li1,YUE Shuying1,LYU Jianhua1,LU Yanqin2
1 Shandong Medical College,Jinan 250002,China;2 Shandong Medicinal Biotechnology Centre△
ObjectiveTo explore the protective effects of quercetin on damage induced by oxidative stress and to clari⁃fy its molecular mechanism.MethodsChang liver cell cultures were randomly divided into control groups,H2O2group and 3 doses of quercetin groups.Cell survival rate was detected with MTT.Cell apoptotic rate was measured by FACS(Fluores⁃cence-activated cell sorting).Intracellular reactive oxygen species(ROS)level in Chang liver cells were tested by flow cy⁃tometer.The DCF fluorescence intensity of DCFH-DA-stained intracellular ROS was observed by fluorescence microscope. The levels of malondialdehyde(MDA),superoxide dismutase(SOD),catalase(CAT)and glutathione peroxidase(GSH-Px)were determined in liver cells using commercial available kits.The expression of Nrf2 were detected by Western blot.ResultsCompared with control,cell survival rate and levels of SOD,CAT and GSH-Px decreased significantly in H2O2group(P<0.05),while cell appotosis rate,content of MDA and mean fluorescence intensity(MFI)increased in H2O2group(P<0.05).In comparison with H2O2,expression of Nrf2 protein was higher in all three quercetin treatment groups(P<0.05).ConclusionQuercetin protected Chang liver cells from H2O2-induced oxidative stress,which may be caused by the increased ex⁃pressions of down stream antioxidant genes via activating the Nrf2-ARE signaling pathway.
Quercetin;oxidative stress;superoxide dismutase;catalase;glutathione peroxidase;Chang liver cell;Nrf2/ ARE pathway
R965;R657.3
A
10.11958/j.issn.0253-9896.2015.10.004
山东省卫生厅医药卫生发展计划项目(2011HZ099)
1山东医学高等专科学校(邮编250002);2山东省医药生物技术研究中心
沈钦海(1966),男,医学博士,副教授,主要从事肝病的发病机制的相关研究及治疗
△通讯作者E-mail:sdyzqzm@126.com
