脑缺血再灌注损伤后BMSCs不同示踪方式的比较
2015-11-24王艳闵鹤鸣张苗苗包翠芬闵连秋
王艳,闵鹤鸣,张苗苗,包翠芬,闵连秋△
脑缺血再灌注损伤后BMSCs不同示踪方式的比较
王艳1,闵鹤鸣2,张苗苗3,包翠芬4,闵连秋1△
目的比较脑缺血再灌注损伤后,不同示踪方式观察骨髓间充质干细胞(BMSCs)移植后的效果。方法BMSCs复苏培养后,分别采用5-溴脱氧尿嘧啶核苷(BrdU)、PKH26进行标记,并且与绿色荧光蛋白(GFP)转染细胞,分别对脑缺血再灌注模型大鼠脑组织进行移植。将75只SPF级雄性SD大鼠随机均分为假手术组,模型组,BrdU、PKH26、GFP示踪组。采用线栓改良法制备大鼠左侧大脑中动脉局灶性脑缺血再灌注损伤模型。脑缺血再灌注24 h后,假手术组、模型组分别采用脑立体定位仪经脑实质植入10 μL生理盐水;BrdU、PKH26、GFP示踪组分别植入10 μL的BMSCs/BrdU、BMSCs/PKH26、BMSCs/GFP。采用神经行为学评分、TTC染色、脑组织含水量法进行模型鉴定及疗效判定,采用焦油紫染色进行神经元计数,并在荧光显微镜下计数标记细胞阳性率。结果移植前细胞BrdU、PKH26、GFP标记率无明显差异。移植4周后3示踪组大鼠神经行为学评分、脑梗死体积、脑组织含水量均显著低于模型组,神经元计数显著高于模型组;神经行为学评分、脑梗死体积高于假手术组,脑组织含水量、神经元计数与假手术组差异无统计学意义;3示踪组间上述指标差异均无统计学意义。GFP示踪组的荧光标记细胞阳性率高于BrdU、PKH26示踪组。结论脑缺血再灌注损伤中,GFP示踪方式效果更为持久,优于BrdU和PKH26。
再灌注损伤;间质干细胞移植;绿色荧光蛋白质类;荧光抗体技术;脑缺血再灌注;骨髓间充质干细胞;示踪
缺血性脑血管病的发病率和死亡率均较高,治疗后幸存者中约半数以上会遗留不同程度的偏瘫和失语症状,给个人、家庭和社会带来了沉重负担[1]。研究证实,脑缺血后会导致不同程度的细胞死亡,而目前的治疗方式多以溶栓、抗凝等对症治疗为主,并不能使坏死的神经元再生,不能从根本上解决缺血性脑中风致残、致死的问题。为此,许多学者尝试采用干细胞移植来解决这一问题,为了更好地观察干细胞移植后在体内的生长、分化等情况,研究人员将干细胞标记后进行移植示踪观察[2-3]。目前常用的标记方式多采用荧光染料或细胞转染的方式,但是何种标记方式更有利于对移植细胞的观察,且不影响移植细胞的治疗效果,目前尚不明确。本实验拟采用5-溴脱氧尿嘧啶核苷(5-Bromo-2-deoxy Uridine,BrdU)、PKH26、绿色荧光蛋白(green fluorescent protein,GFP)3种不同的方式标记骨髓间充质干细胞(BMSCs)并移植,比较BMSCs 3种示踪方式的移植效果,为细胞移植技术的开展及脑缺血疾病的治疗提供实验依据。
1 材料与方法
1.1 材料SPF级雄性SD大鼠75只,体质量250~300 g,购于辽宁长生生物技术有限公司(许可证号SCXK[辽]2010-0001);SD大鼠BMSCs(货号RASMX-01001)、BMSCs/GFP(货号RASMX-01101)、BMSCs完全培养基(货号RASMX-90011)、胰酶(货号TEDTA-10001-100)均购自美国Cyagen Biosciences公司;BrdU、PKH26、稀释缓冲液C、TTC(Sigma公司);兔抗大鼠BrdU单克隆抗体(Abcam公司);FITC标记IgG(北京中杉公司);Hoechest33258染色试剂盒(碧云天公司)。
1.2 方法
1.2.1 BMSCs、GFP转染的BMSCs(BMSCs/GFP)的复苏与培养分别将冻存的BMSCs、BMSCs/GFP复苏后,按(2.0~4.0)× 104/cm2的密度接种到25 mL的培养瓶中,加入完全培养基,置于37℃、5%CO2、80%相对湿度的培养箱中培养。隔日换液直到细胞达80%~90%的汇合度,经胰酶消化后进行传代[4]。
1.2.2 BMSCs的BrdU标记与移植(1)BMSCs的BrdU标记。待培养瓶内的P4代BMSCs达80%~90%的汇合度时,取部分细胞用胰酶消化后将其接种于6孔培养板(内置经灭菌处理后的盖玻片),加入完全培养基,置于37℃、5%CO2、80%相对湿度的培养箱中培养,待细胞达80%的汇合度时,加入2 μmol/L BrdU,置培养箱中孵育72 h[5],待细胞达80%~90%的汇合度时,弃去培养液,PBS洗涤3次。采用甲醇/醋酸固定10 min左右。略干燥后,0.3%H2O2-甲醇液浸泡30 min左右以灭活内源性过氧化物酶。用5%正常血清封闭,加入1∶100稀释的兔抗大鼠BrdU单克隆抗体(阴性对照加同源血清替代单抗)4℃孵育过夜。次日取出漂洗后,加入FITC标记的羊抗兔IgG 37℃孵育30 min,PBS漂洗。采用Hoechest33258复染核5~10 min,PBS漂洗。荧光显微镜下随机计数10个高倍视野中BrdU阳性细胞数(呈绿色荧光),计算阳性细胞数占细胞总数的百分比(即细胞BrdU标记率)。(2)BMSCs/BrdU的移植。待培养瓶内的P4代BMSCs达80%的汇合度时,向培养瓶内加入5 μmol/L BrdU,置培养箱中孵育72 h,胰酶消化并用完全培养基重悬后用于细胞移植(移植细胞浓度约为5.0×106/mL)。
1.2.3 BMSCs的PKH26标记与移植待培养瓶内的P4代BMSCs达80%~90%的汇合度时,胰酶消化制成含有2×107BMSCs的细胞悬液,用无血清的培养基洗涤离心后,将细胞团重悬于1 mL的稀释缓冲液C中,后将细胞悬液混于含有4×10-6mol/L PKH26染液的1 mL稀释缓冲液C中,室温条件下孵育5 min,加入2 mL胎牛血清终止反应,完全培养基清洗细胞3次以去除未结合染料,最后加入4 mL完全培养基重悬细胞至移植所需浓度。将少量PKH26标记过的BMSCs接种于6孔培养板(内置经灭菌处理后的盖玻片)中,加入完全培养基,置于37℃、5%CO2、80%相对湿度的培养箱中培养[6]。待细胞达80%~90%的汇合度时,采用Hoechest 33258复染核5~10 min,PBS漂洗。荧光显微镜下随机计数10个高倍视野中PKH26阳性细胞数(呈红色荧光),计算阳性细胞数占细胞总数的百分比(即细胞PKH26标记率)。而其余PKH26标记过的BMSCs用于细胞移植(移植细胞浓度约为5.0×106/mL)。
1.2.4 BMSCs/GFP的标记与移植待培养瓶内的P4代BMSCs/GFP达80%~90%的汇合度时,胰酶消化后用完全培养基重悬制成BMSCs/GFP悬液,小部分的BMSCs/GFP悬液接种于6孔培养板(内置经灭菌处理后的盖玻片),加入完全培养基,置于37℃、5%CO2、80%相对湿度的培养箱中培养,待细胞达80%~90%的汇合度时,弃去培养液,采用Hoechest33258复染核5~10 min,PBS漂洗。荧光显微镜下随机计数10个高倍视野中GFP阳性细胞数(呈绿色荧光),计算阳性细胞数占细胞总数的百分比(即细胞GFP标记率)。大部分的BMSCs/GFP悬液用于移植(移植细胞浓度约为5.0×106/mL)。
1.2.5 实验分组及治疗方法采用随机数字表法将大鼠分为假手术组、模型组、BrdU示踪组、PKH26示踪组、GFP示踪组,每组15只。采用Longa等[7]的线栓改良法制备大鼠左侧大脑中动脉阻断局灶性脑缺血再灌注损伤模型。线栓采用头端光滑烫圆直径为0.265 mm的鱼线,由左侧颈总动脉分叉处缓慢向颈内动脉颅内方向插入约(18.5±0.5)mm,使线头通过大脑中动脉起始处以阻断其血流;假手术组鱼线插入深度<15 mm。阻塞2 h后,轻轻拔出鱼线即为再灌注。脑缺血再灌注24 h后,假手术组、模型组分别采用脑立体定位仪经脑实质植入10 μL生理盐水[8];BrdU示踪组、PKH26示踪组、GFP示踪组分别采用脑立体定位仪经脑实质植入10 μL的BMSCs/BrdU、BMSCs/PKH26、BMSCs/GFP(生理盐水和3种示踪细胞的植入部位均为旁开2.0 mm,前囟后4.3 mm,深度2.6 mm;移植细胞浓度约为5.0×106/mL)[9]。
1.2.6 神经行为学评分分别于脑缺血再灌注后24 h、1周、2周、4周时,采用改良神经功能缺损评分(modified neurological severity scores,mNSS)[1]对各组动物进行神经行为学评分,
进行模型鉴定及疗效判定。神经功能分级范围为0~18(正常评分为0,最大缺陷评分为18,分数越高,意味着缺损越重)[10-11]。对于实验过程中剔除的大鼠按照严格的实验条件进行补充。
1.2.7 脑组织含水量检测于脑缺血再灌注4周时,每组各取5只大鼠,快速断头取出左侧大脑组织,采用干湿重法,称质量后于恒温干燥箱(60℃)干燥至恒重(约6 h),再称质量。脑组织含水量(%)=(湿质量-干质量)/湿质量×100%。
1.2.8 TTC染色计算脑梗死体积于脑缺血再灌注4周后,每组各取5只大鼠,分别对各组进行TTC染色,以观察各组的治疗情况。10%水合氯醛(3 mL/kg)腹腔麻醉,快速断头取脑,生理盐水冲洗后置入-20℃冰箱中冷冻10~30 min后取出,在冰盘上迅速去除小脑和低位脑干、嗅球,大脑冠状切片(每个脑组织平均切成6片),将脑片置于新鲜配制的2% TTC染液缸中,37℃避光孵育30 min,间隔5 min轻轻摇晃1次,使其均匀染色(梗死区脑组织呈白色,正常脑组织呈红色)。生理盐水冲洗,10%福尔马林固定,数码相机照相,利用CIAS-1000型图像分析系统测量并计算大脑组织梗死区体积占同侧大脑半球体积的百分比。
1.2.9 神经元计数大鼠脑缺血再灌注4周后,每组各取5只大鼠,先后行生理盐水、4%多聚甲醛灌流后快速断头取脑,在前囟后2.6~4.6 mm间冠状切取脑组织,后固定于10%福尔马林中。经20%蔗糖去除水份后,进行冰冻切片,焦油紫染色,经梯度乙醇脱水,二甲苯透明后,每只大鼠随机取3个不同视野,每组共计15个视野,荧光显微镜下随机计数15个高倍视野中正常神经元数量。
1.2.10 荧光标记细胞阳性率取示踪组脑组织,行冰冻切片,BrdU示踪组余下操作同1.2.2。PKH26示踪组、GFP示踪组行冰冻切片后,采用Hoechest33258复染核5~10 min,PBS漂洗。荧光显微镜下随机计数15个高倍视野中BrdU、PKH26、GFP标记细胞阳性率。
1.3 统计学方法数据分析应用SPSS 17.0统计软件,计量资料均以均值±标准差表示,多组间比较采用单因素方差分析或重复测量设计的方差分析,组间多重比较采用LSD(方差齐)或Tamhane′s T2(方差不齐)法比较。以P<0.05为差异有统计学意义。
2 结果
2.1 细胞复苏培养后的形态观察相差显微镜下可见BMSCs及BMSCs/GFP细胞经复苏后呈贴壁生长,生长速度较快,细胞排列紧密,细胞形态、大小均一;且BMSCs/GFP细胞于荧光显微镜下可见细胞内有明显的绿色荧光,见图1。
2.2 细胞标记率比较细胞BrdU、PKH26、GFP标记率分别为(92.7±4.9)%、(93.4±4.6)%、(94.9± 3.3)%,3种标记率差异无统计学意义(F=0.686,P>0.05),见图2。
2.3 各组大鼠神经行为学评分结果假手术组大鼠未见神经功能缺损症状,其余各组于脑缺血再灌注24 h后均出现明显的神经功能缺损症状,随着时间的延长,神经功能缺损症状逐渐减轻。3示踪组于脑缺血再灌注后1周、2周、4周时mNSS均低于模型组(均P<0.05),24 h时与模型组差异无统计学意义;脑缺血再灌注后不同时点3示踪组mNSS间差异均无统计学意义。组间和处理时间之间存在交互效应。见表1。

Fjg.1Morphology of BMSCs andBMSCs/GFP图1 BMSCs、BMSCs/GFP的形态观察
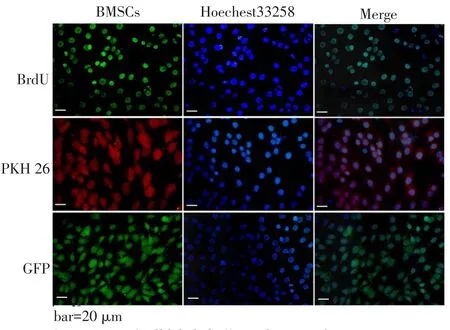
Fig.2Comparison of cell labeled efficacy between three tracing groups图2 3示踪组细胞标记率的比较
Tab.1Comparison of neural behavioral score between all groups at different time points表1 各组不同时点mNSS的比较(n=15,分,)

Tab.1Comparison of neural behavioral score between all groups at different time points表1 各组不同时点mNSS的比较(n=15,分,)
*P<0.05;F组间=455.324,F时间=208.551,F交互=17.658,均P<0.05;a与假手术组比较,b与模型组比较,P<0.05
组别假手术组模型组B r d U示踪组P K H 2 6示踪组G F P示踪组F 2 4 h 0 1 3 . 3 3 ± 2 . 4 4 a 1 4 . 0 0 ± 1 . 9 6 a 1 2 . 2 7 ± 1 . 9 8 a 1 1 . 2 0 ± 1 . 7 4 a 1 4 9 . 4 0 2*1周0 1 0 . 3 3 ± 1 . 8 0 a 7 . 3 3 ± 0 . 9 8 a b 7 . 3 3 ± 1 . 2 3 a b 7 . 4 0 ± 1 . 3 5 a b 1 4 7 . 0 1 3*2周0 9 . 4 7 ± 1 . 3 6 a 5 . 9 3 ± 1 . 3 4 a b 6 . 0 0 ± 1 . 2 0 a b 6 . 0 0 ± 1 . 1 3 a b 1 3 8 . 1 6 8*4周0 8 . 8 0 ± 1 . 7 4 a 5 . 0 0 ± 1 . 5 1 a b 5 . 3 3 ± 1 . 3 5 a b 5 . 7 3 ± 1 . 4 9 a b 8 0 . 5 2 9*F -1 7 . 0 9 1*1 1 1 . 9 8 0*6 7 . 8 7 1*4 5 . 6 0 0*
2.4 各组大鼠脑组织含水量比较各组大鼠脑组织含水量差异有统计学意义(n=5,F=16.604,P<0.05)。BrdU示踪组(76.89±1.65)%、PKH26示踪组(77.20±0.68)%和GFP示踪组(77.34±1.80)%均低于模型组(83.93±2.44)%,与假手术组(77.56±1.07)%差异无统计学意义;3示踪组间差异均无统计学意义。
2.5 各组大鼠脑梗死体积比较假手术组大鼠未见梗死灶,呈明显的红色;模型组可见明显的苍白色梗死灶,3示踪组仅见极少量缺血区域,见图3。各组脑梗死体积差异有统计学意义(n=5,F=410.160,P<0.05),BrdU示踪组(3.06±0.57)%、PKH26示踪组(3.53±0.56)%、GFP示踪组(3.39±0.45)%均高于假手术组(0),明显低于模型组(33.45±3.31)%;3示踪组间差异均无统计学意义。
2.6 各组大鼠神经元计数比较假手术组皮质可见正常的脑组织形态结构,模型组正常神经元数量显著减少,可见大量坏死神经元,3示踪组可见少量的坏死神经元,见图4。各组正常神经元数量差异有统计学意义(n=15,F=62.810,P<0.05),BrdU示踪组(72.73±8.47)个、PKH26示踪组(74.87±6.97)个、GFP示踪组(76.40±7.67)个均高于模型组(44.20±6.96)个,与假手术组(78.00±3.30)个差异无统计学意义;3示踪组间差异均无统计学意义。
2.7 各组大鼠荧光标记细胞阳性率比较假手术组和模型组荧光显微镜下未见荧光标记细胞,3示踪组均可见移植的荧光标记细胞,见图5。GFP示踪组荧光标记细胞阳性率(29.60±6.53)%高于BrdU示踪组(21.08±6.68)%和PKH26示踪组(21.64±3.82)%,差异有统计学意义(F=136.829,P<0.05),BrdU示踪组与PKH26示踪组间差异无统计学意义。
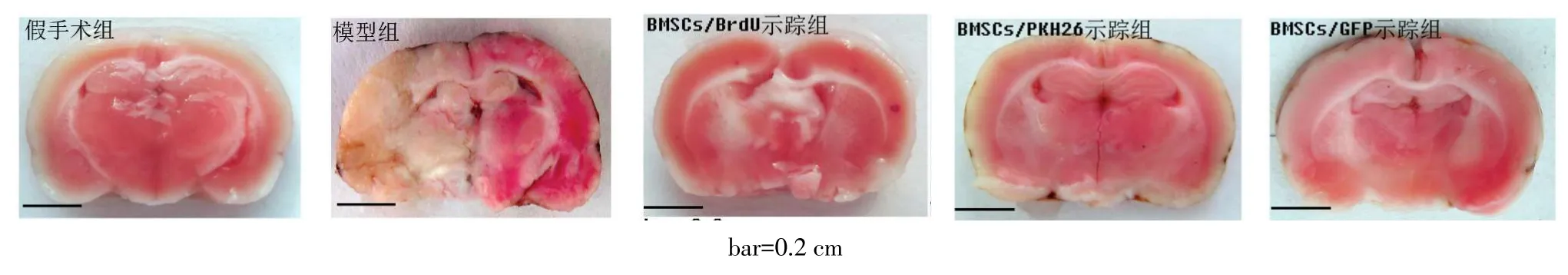
Fig.3Comparison of brain infarct volume between all five groups图3 各组脑梗死体积比较
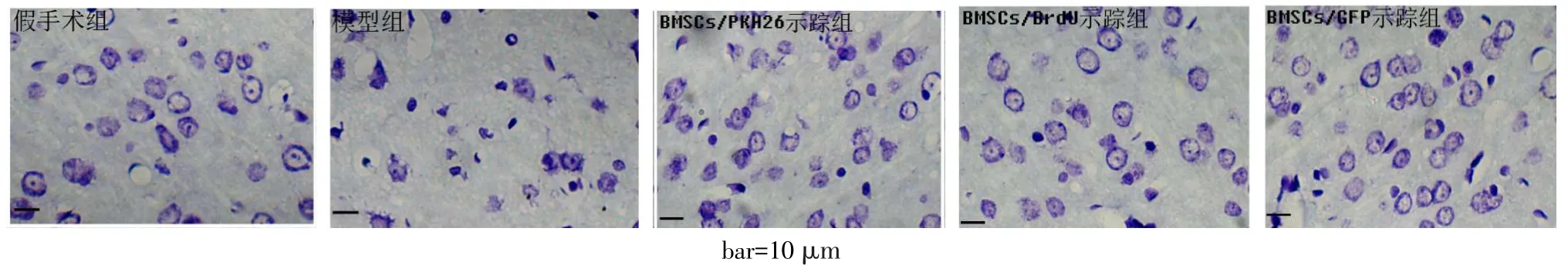
Fig.4Comparison of neuron counts between all five groups图4 各组神经元计数比较
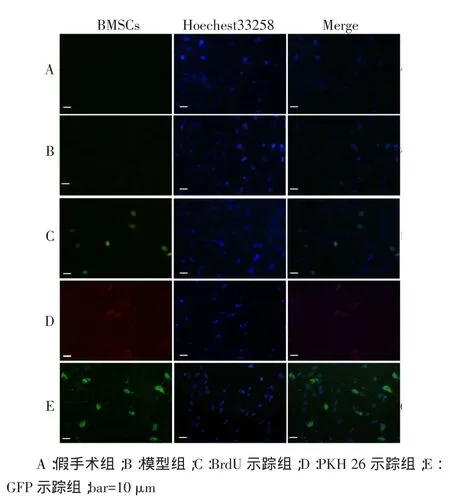
Fig.5Comparison of rate of cells labeled by fluorescence between all five groups图5 各组荧光标记细胞阳性率的比较
3 讨论
目前研究显示,对于干细胞的示踪方式主要有同位素、抗原标记法(如BrdU标记)、荧光染料(如PKH26)、荧光蛋白(如GFP标记)示踪等方法。其中因同位素的放射性污染问题,目前已较为少用。
BrdU属于胸腺嘧啶核苷的类似物,当细胞处于DNA合成期,BrdU就会掺入到新合成的DNA中,利用这个原理可以对细胞进行标记,经免疫组织化学染色可观察到BrdU在细胞核内的褐色沉淀。
PKH26是一种具有亲脂性的红色荧光染料,能够和细胞膜的脂质双层区域进行稳定的结合。GFP转染是利用腺病毒载体将GFP蛋白导入BMSCs。GFP性质稳定,不需任何因子的协助就能被激发产生荧光,对细胞和机体毒性小。
本实验采用3种不同方式对移植细胞进行标记,移植前检测了BrdU、PKH26、GFP 3种类型细胞的标记率,结果显示三者之间差异无统计学意义;移植后监测了大鼠神经功能缺损情况,发现于缺血再灌注模型24 h后,除假手术组外的大鼠均出现明显的神经功能缺损症状,提示模型制备成功。随着时间的延长,各组大鼠神经功能缺损症状均有所减轻,至移植4周后3个示踪组大鼠神经功能评分、脑梗死体积、脑含水量均显著低于模型组,正常神经元计数显著高于模型组,且3组之间差异无统计学意义,提示3组不同标记方式的细胞移植后对治疗效果无显著影响。但荧光显微镜下观察到GFP示踪组损伤区域的移植细胞显著高于BrdU、PKH26示踪组,提示GFP转染后细胞移植的标记效果更为稳定持久,且荧光亮度基本不衰减,是最为有效的细胞示踪方式。
本实验中BrdU的检测细胞数量低于GFP转染,笔者推测有如下原因:(1)可能是由于BrdU片段干扰DNA双螺旋结构的稳定性,引起细胞死亡[12-13],从而影响Hoechest等染色,导致染色弥散,准确性降低。(2)前期有研究证实BrdU标记后会随着细胞的增殖和分裂而丢失,从而导致标记强度的减弱。(3)若标记细胞死亡后,BrdU会从死亡细胞释放出来,易被附近的细胞所摄取,使该细胞内出现BrdU阳性表达,即假阳性标记[5]。上述原因可能是导致BrdU标记不能准确反映真实的细胞标记率的因素。PKH26可以在不影响细胞增殖和分化的情况下保持在细胞上,但在经过进一步的染色处理后,如原位杂交和免疫染色,会使其标记荧光消退,降低对标记细胞示踪的示踪效果,从而影响细胞标记率的检测[14-15]。Li等[6]研究证明移植入体内的PKH26标记的少量细胞受病变处微环境的影响而发生裂解,其碎片可以将PKH26染料转移到宿主体内的其他细胞,从而出现假阳性标记,导致PKH26标记不能准确反映真实的细胞标记率。这些可能是本实验中导致BrdU和PKH26移植细胞数量少于GFP转染细胞或者是细胞标记位置改变的主要原因。
[1]Prabhakaran S,Ruff I,Bernstein RA.Acute stroke intervention:a systematic review[J].JAMA,2015,313(14):1451-1462.doi:10.1001/ jama.2015.3058.
[2]Kuroda S,Houkin K.Translational challenge for bone marrow stroma cell therapy after stroke[J].Front Neurol Neurosci,2013,32:62-68.doi:10.1159/000346414.
[3]Liu N,Deguchi K,Yamashita T,et al.Intracerebral transplantation of bone marrow stromal cells ameliorates tissue plasminogen activator-induced brain damage after cerebral ischemia in mice detected by in vivo and ex vivo optical imaging[J].J Neurosci Res,2012,90(11):2086-2093.doi:10.1002/jnr.23104.
[4]Kuroda S.Bone marrow stromal cell transplantation for ischemic stroke--its multi-functional feature[J].Acta Neurobiol Exp(Wars),2013,73(1):57-65.
[5]Coyne TM,Marcus AJ,Woodbury D,et al.Marrow stromal cells transplanted to the adult brain are rejected by an inflammatory response and transfer donor labels to host neurons and glia[J].Stem Cells,2006,24(11):2483-2492.
[6]Li P,Zhang R,Sun H,et al.PKH26 can transfer to host cells in vitro and vivo[J].Stem Cells Dev,2013,22(2):340-344.doi:10.1089/ scd.2012.0357.
[7]Longa EZ,Weinstein PR,Carlson S.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[8]Yu Y,Liu XZ,Bao CF,et al.Effects of ginsenoside Rg1 on PARP-1 and TNFR1 expression in rat model of focal cerebral ischemia[J]. Tianjin Med J,2015,43(3):245-248.[于洋,刘学政,包翠芬,等.人参皂苷Rg1对局灶性脑缺血大鼠PARP-1和TNFR1表达的影响[J].天津医药,2015,43(3):245-248].doi:10.11958/j.issn.0253-9896.2015.03.006.
[9]Wang Y,Fu W,Zhang S,et al.CXCR-7 receptor promotes SDF-1α-induced migration of bone marrow mesenchymal stem cells in the transientcerebral ischemia/reperfusion rat hippocampus[J].Brain Res,2014,1575:78-86.doi:10.1016/j.brainres.2014.05.035.
[10]Lee YS,Chio CC,Chang CP,et al.Long course hyperbaric oxygen stimulates neurogenesis and attenuates inflammation after ischemic stroke[J].Mediators Inflamm,2013,2013:512978.doi:10.1155/2013/ 512978.
[11]Chen J,Sanberg PR,Li Y,et al.Intravenous administration of human umbilical cord blood reduces behavioral deficits after stroke in rats[J].Stroke,2001,32(11):2682-2688.
[12]Almeida JC,Sauaia H,Viana JC.5-Bromo-2′-deoxyuridine induces visible morphological alteration in the DNA puffs of the anterior salivary gland region of bradysia hygida(Diptera,Sciaridae)[J].Braz J Medical Biol Res,2010,43(12):1143-1152.
[13]Schneider L,d′Adda di Fagagna F.Neural stem cells exposed to BrdU lose their global DNA methylation and undergo astrocytic differentiation[J].Nucleic Acids Res,2012,40(12):5332-5342.
[14]Goncalves MA,de Vries AA,Holkers M,et al.Human mesenchymal stem cells ectopically expressing full-length dystrophin can complement Duchenne muscular dystroph myotubes by cell fusion[J].Hum Mol Gene,2006,15(2):213-221.
[15]Chen J,Wang C,Lu S,et al.In vivo chondrogenesis of adult bone marrow derived autologous mesenchymal stem cells[J].Cell Tissue Res,2005,319(3):429-438.
(2015-06-05收稿 2015-09-01修回)
(本文编辑 陈丽洁)
Comparison of different ways to trace BMSCs after cerebral ischemia-reperfusion injury
WANG Yan1,MIN Heming2,ZHANG Miaomiao3,BAO Cuifen4,MIN Lianqiu1△
1 Department of Neurology,First Affiliated Hospital of Jinzhou City,Jinzhou,Liaoning 121001,China;2 Department of Cell Biology,3 Department of Anatomy,4 Key lab of Molecular Cell Biology and New Drug Development,Liaoning Medical University△
ObjectiveTo compare different ways to trace bone marrow mesenchymal stem cells(BMSCs)after being transplanted in cerebral ischemia-reperfusion injury.MethodsMale SD rats of SPF grade were randomly divided into sham group,model group(ischemia-reperfusion,IR),BrdU tracing group,PKH26 tracing group and GFP tracing group.Focal cerebral ischemia-reperfusion model was established by blocking middle cerebral artery.24 hours after cerebral ischemia-reperfusion injury,10 μL BMSCs that were labeled respectively by BrdU,PKH26,GFP were added respectively into BrdU,PKH26 and GFP tracing group while equal volum of normal saline was added into sham group and model group.Model and transplanting cells efficacy was determined by neural behavioral score,TTC staining and brain water content;Neurons were counted using tar violet staining;The number of transplant cells in the transplanting site was assessed by fluorescence microscopy.ResultsBefore transplanting,there was no significant difference among BrdU,PKH26 and GFP group in cell labeled efficacy.By contrast,neural behavioral score,brain infarct volume and brain tissue water content were significantly lower in all three tracing groups than that in model group 4 weeks after transplantation while neuron counts were markedly higher.There was no significant difference of above parameters among the three tracing groups.However,the number of traced transplanting cells in damaging area in GFP group is significantly higher than that in BrdU group and PKH26 group. ConclusionIn cerebral ischemia-reperfusion injury,the tracing effect of GFP last longer,therefore it is significantly more effective than BrdU and PKH26.
reperfusion injury;mesenchymal stem cell transplantation;green fluorescent proteins;fluorescent antibody technique;cerebral ischemia-reperfusion;bone marrow mesenchymal stem cells;trace
R743.31
A
10.11958/j.issn.0253-9896.2015.12.009
国家自然科学基金项目(81202783,31170930)
1辽宁医学院附属第一医院神经内科(邮编121001),2细胞生物学教研室,3解剖学教研室,4省高校分子生物与新药开发重点实验室
王艳(1988),女,硕士研究生,主要从事脑血管疾病防治研究
△通讯作者E-mail:mianyizuhua@aliyun.com
