pH和Cl-对Cu-Cr-Zr合金电化学腐蚀的影响
2015-11-22陈小娜张修庆程小敏丁昱寰
陈小娜,张修庆,程小敏,陈 舸,丁昱寰
(华东理工大学 机械与动力工程学院,上海 200237)
pH和Cl-对Cu-Cr-Zr合金电化学腐蚀的影响
陈小娜,张修庆,程小敏,陈 舸,丁昱寰
(华东理工大学 机械与动力工程学院,上海 200237)
采用电化学方法研究了Cu-Cr-Zr合金在不同pH条件下含0.6 mol/L的NaCl和纯水溶液中的耐蚀性,采用扫描电子显微镜(SEM)、能谱(EDS)表征了浸泡试验72 h后试样的表面形貌。将其在不同腐蚀介质中的耐电化学腐蚀性作对比,结果表明,Cl-的加入使合金在同等pH条件下的耐蚀性下降;碱性环境降低了Cl-对合金的腐蚀;在强酸溶液中合金会发生全面均匀的腐蚀,在强碱溶液中合金发生局部腐蚀。
Cu-Cr-Zr合金;NaCl溶液;电化学;腐蚀
铜及铜合金由于具有足够的机械性能,良好的耐蚀性、导电导热性、无磁性和对水中微生物及藻类的防污性等性能,再加上便于铸造,易于塑性加工和良好的可焊性等工艺性能,已成为现代工业的重要材料[1-4]。据报道铜合金的腐蚀速率易受pH的影响,在不同pH环境中的腐蚀速率差异很大。M. Metikos-Hukovic[5]等研究了铜合金在在不同pH条件下的电化学腐蚀性能,结果表明,随着pH的增加,表面绝缘层对基体的保护加强。M.Ismail等研究了铜合金在酸性氯化物环境中的电化学腐蚀性能,结果表明,在酸性环境下,当Cl-浓度增加到0.6 mol/L时,铜合金的耐腐蚀性能下降。对Cu-Cr-Zr合金在有无Cl-和不同pH下的耐电化学腐蚀性能没有全面的研究。
本工作研究了在有无Cl-和不同pH条件下,Cu-Cr-Zr合金的电化学腐蚀性能,并得出了相关结论,对于Cu-Cr-Zr合金在不同pH和有无Cl-情况下电化学腐蚀性能的研究有一定的借鉴意义。
1 试验
1.1 试验材料
试验材料为Cu-Cr-Zr合金,其化学成分符合 GB/T 5231-2012《加工铜及铜合金牌号和化学成分》。采用线切割工艺切割36个尺寸为10 mm×10 mm×2 mm的Cu-Cr-Zr合金试样,在试件一面焊接长度约15 cm的铜导线,保留工作电极面积为10 mm×10 mm,其余非工作面用环氧树脂封闭。试样用金相砂纸逐级打磨至6号表面至镜面,随后依次用去离子水、酒精、去离子水清洗,吹干后,防腐蚀干燥箱干燥2 h以上备用。
1.2 试验溶液
试验溶液为0.6 mol/L NaCl溶液和去离子水两种,两种溶液分别通过添加H2SO4和NaOH调节pH为1,3,5,7,10,12。
1.3 试验过程
被检试件分为3组,每组12个,分别用来测试Cu-Cr-Zr合金的E-t曲线、Tafel曲线和浸泡试验后的表面形貌。每种腐蚀液测得3组数据,重复试验,需对试件重新进行表面处理,配制新溶液。
电化学试验 RST5200系列电化学工作站上完成。采用三电极体系,辅助电极为铂电极,参比电极为饱和甘汞电极(SCE),工作电极为试样。文中电位若无特指,均相对于SCE。启动电化学工作站,30 min后待系统稳定后测得开路电位OCP(Open Circuit Potential),采样间隔1 s,电压量程0.5 V,测得8000 s的开路电位E-t曲线。Tafel曲线测试的扫描范围为-150 ~150 mV(相对于开路电位),扫描速率为2 mV/s。
将Cu-Cr-Zr合金制作的试样分别封装在盛有150 mL,pH为1,3,5,7,10,12的NaCl和水溶液中浸泡72 h进行浸泡试验,烧杯口用洁净的保鲜膜密封,以防止外界空气环境的影响。浸泡72 h后,取出合金试件,蒸馏水冲洗,电吹风干燥。采用日本JEOL生产的JSM-6360LV型扫描电镜(SEM)及美国EDAX生产的FalconSEM型能谱分析仪(EDS)对腐蚀形貌进行分析。
2 结果与讨论
2.1 开路电位的E-t曲线
图1为合金试样在的酸性溶液中E-t曲线。从图1(a)可见,试样在pH=1的溶液中在0~1 000 s内电位急剧下降,说明材料表面的保护膜遭到破坏腐蚀加剧。在pH=3的腐蚀液中电位随时间的变化很小、电位稳定,材料表面发生了均匀腐蚀。在pH=5时,电位持续下降且电位在110 s和3 300 s有突降,即材料表面发生了不均匀的孔蚀。Cu-Cr-Zr合金在不含氯时,pH=1的开路电位最低为-0.068 V,pH=5的开路电位最高为0.136 V。即在不含氯的酸性环境中,随着pH的升高开路电位正移,合金材料的表面稳定性增强,耐腐蚀性增强。由图1(b)可见, 在含氯溶液中,试样的腐蚀电位负移,耐腐蚀性降低且腐蚀速率更不稳定。

(a) 纯水

(b) 含0.6 mol/L NaCl图1 合金在含/不含NaCl的酸性溶液中的E-t曲线Fig. 1 Plots of E-t for Cu-Cr-Zr alloy in acid solutions without NaCl (a) and with NaCl (b)
电位的变化反映材料的表面稳定性及腐蚀速率的差异,Cu-Cr-Zr合金在pH=3的含氯腐蚀液和pH=1的水溶液中耐腐蚀性最差且腐蚀速率不稳定。这是因为腐蚀Cl-比硫酸根离子具有更小的体积和活性,易于扩散到基体表面对材料进行侵蚀,随着Cl-的增加腐蚀电位负移,腐蚀更易发生。
图2为合金试样在中性和碱性溶液中的E-t曲线。由图2(a)可见, 在纯水溶液中,pH=12时试样的开路电位最低为-0.100 V,pH=10时试样的开路电位最高为0.028 V。电位随时间的变化反映腐蚀发生的难易程度,随着溶液碱性增强,腐蚀电位先升高后降低,Cu-Cr-Zr合金的耐蚀性由强变弱。由图2(b)可见,Cu-Cr-Zr合金在含Cl-的中性和碱性环境中,开路电位随pH增加而正移,耐腐蚀性增强。Cl-的加入使电位的波动比图2(a)明显,腐蚀电位负移量大于50 mV,耐腐蚀性降低且腐蚀速率更不稳定。

(a) 纯水

(b) 含0.6 mol/L NaCl图2 合金试样在含/不含NaCl的中性和碱性溶液中的E-t曲线Fig. 2 Plots of E-t for Cu-Cr-Zr alloy in neutral and alkaline solutions without NaCl (a) and with NaCl (b)
在不含NaCl的情况下,溶液pH=5时,自腐蚀电位的最高,为0.136 V;在含有NaCl的情况下,pH=12时,自腐蚀电位的最高,为-0.151 V。此外在同等pH情况下,含氯腐蚀液的自腐蚀电位均低于不含氯的自腐蚀电位至少0.1 V。表明活性腐蚀离子Cl-的加入使合金表面的活性增强,稳定性变差,耐腐蚀性降低。
2.2 Tafel曲线
图3为试样在含/不含NaCl酸性溶液中的Tafel曲线。表1为其相关电化学参数拟合。从图3(a)可见,Tafel曲线的阳极极化曲线只有阳极活化溶解区。Cu-Cr-Zr合金工作电极在pH=1的纯水溶液中自腐蚀电位为-0.070 4 V,明显高于其在pH=3和pH=5时。且从图3(b)可见,试样在pH为1,3,5 NaCl溶液中的自腐蚀电位明显低于其在不含NaCl的溶液中的。自腐蚀电位的降低说明Cl-的加入使材料表界面的稳定性降低,可以得出,在酸性溶液中,Cl-的加入使试样腐蚀发生的倾向性增加。
图4为试样在含/不含NaCl的中性和碱性溶液中的Tafel曲线,表2为其相关电化学参数拟合。从图4(a)可见,在不含NaCl的碱性环境中,试样的阳极极化曲线包括阳极溶解区和钝化区,出现钝化现象,即曲线没有明显的钝化过渡区,而是直接进入钝化区,这是因为金属表面生成了钝化膜阻碍了腐 蚀环境与基体金属的接触致使腐蚀速度下降,只有电位超过一定数值时钝化膜才会分解,腐蚀加剧。钝化电位在pH=12时为-0.12 V,pH=10时为0.05 V,表明强碱性环境中,试样在更低的电位条件下就可以生成钝化膜。维钝电流密度对数值在pH=12时是-5.86,pH=10时是-5.93,维钝电流密度的提高说明钝化膜的溶解速度随pH升高而加快。而pH=7时的阳极极化曲线只有阳极溶解段腐蚀严重。

(a) 纯水

(b) 含0.6 mol/L NaCl图3 合金在含/不含NaCl的酸性介质中的Tafel图Fig. 3 Tafel curves of Cu-Cr-Zr alloy in acid solutions without NaCl (a) and with NaCl (b)
图4(a)还可以看出,在不含NaCl的情况下,自腐蚀电位pH=12时为-0.137 1 V,明显低于pH=7和pH=10时。并且从图4(b)还可以看出试样在pH为7,10,12 NaCl溶液自腐蚀电位明显低于不含NaCl的溶液。即在含NaCl的碱性环境中,随着pH的增加,试样自腐蚀电位正移,并且试样的钝化现象明显,表明弱碱性环境对Cu-Cr-Zr合 金的腐蚀起到了一定的抑制作用,阻碍Cl-对材料表面的侵蚀,但同时碱性的增强也会使钝化膜的溶解速度加快。

表1 Cu-Cr-Zr合金在酸性介质中的电化学测试结果

(a) 纯水
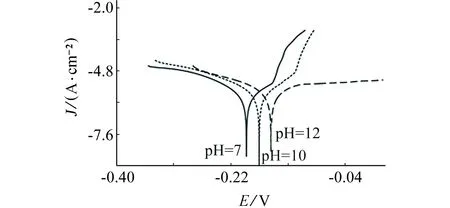
(b) 含0.6 mol/L NaCl图4 合金在含/不含NaCl的中性和碱性介质中的Tafel曲线Fig. 4 Tafel curves of Cu-Cr-Zr alloy in neutral and alkaline solutions without NaCl (a) and with NaCl (b)
由极化曲线可见,腐蚀电流密度与开路电位之间有很好的相关性。腐蚀电位随着pH增大有所正移,在pH=5时达到最大;pH>7,腐蚀电位负移。表明在一定的pH范围内,碱性环境对Cu-Cr-Zr合金的腐蚀有一定的促进作用。在碱性溶液中腐蚀产物可能含有铜的氧化物以及氢氧化物,这些物质不致密,不能有效地阻碍Cl-向金属表面的扩散,致使OH-与Cl-在材料表面发生竞争吸附[6],Cl-在与OH-的竞争中取得优势,Cl-破坏了OH-对电极表面的保护,使得铜合金的腐蚀进一步加剧。
图5为试样在试验溶液中自腐蚀电位随pH的变化曲线。由图5可见,试样在含NaCl溶液中的自腐蚀电位均低于其在同等pH值的水溶液中,即氯离子的加入使腐蚀更易发生。这是因为Cl-的半径很小、穿透力很强,很容易渗透到基体表面引起金属腐蚀并生成铜的易溶的氯化物。
不含NaCl的酸性环境下Cu-Cr-Zr合金的腐蚀速率取决于可溶物的活性溶解,在不含NaCl的中 性和碱性环境中,由于表面氧的存在使合金发生钝化转变,钝化的结果是使腐蚀电位正移,耐腐蚀性增强。在含NaCl的情况下,铜合金材料表面在海水中能够形成氧化亚铜保护膜,腐蚀产物往往沉积在这层薄膜上并对基体起保护作用[7],Cl-会影响表面膜的形成过程和阳极的溶解过程。高的pH情况下,Cu2O、Cu(OH)膜阻碍了Cl-进一步扩散,合金电位出现很大的波动和高的腐蚀阻抗。低的pH情况下,由于铜的活性溶解,腐蚀阻力降低。

表2 Cu-Cr-Zr合金在碱性介质中的测试结果

图5 自腐蚀电位随pH的变化图Fig. 5 Effect of pH on OCP
2.3 腐蚀形貌

(a) pH=1 without NaCl (b) pH=12 without NaCl

(c) pH=1 with NaCl (d) pH=12 with NaCl图6 合金在不同腐蚀液中的SEM和EDSFig. 6 SEM and EDS analyses of the corrosion products for Cu-Cr-Zr in different solutions
图6为Cu-Cr-Zr合金在pH=1和pH=12的腐蚀液中的SEM和EDS结果。由图6(a)见,合金在pH=1的腐蚀介质中发生了均匀腐蚀,腐蚀产物覆盖了整个合金表面。从图6(b)可以看出合金在pH=12的腐蚀介质中发生了不均匀腐蚀,表面有离散的小腐蚀坑。相比之下Cu-Cr-Zr合金在含NaCl的腐蚀介质中发生的腐蚀更严重。从图6(c)可以看出Cu-Cr-Zr合金在在pH=1的NaCl溶液中的腐蚀表面包含相对较高的Cl-和较少的氧,说明合金的腐蚀产物主要是铜的氯化物。另一方面,Cu-Cr-Zr合金在pH=12的NaCl溶液中的腐蚀表面包含更多氧,说明腐蚀产物主要是铜的氧化物。
3 结论
(1) Cu-Cr-Zr合金在不同介质中腐蚀情况存在差异:在强酸溶液中会发生全面均匀的腐蚀溶解,在强碱溶液中发生不均匀的局部腐蚀,且随着pH的增大,由全面均匀腐蚀过渡到局部腐蚀。
(2) Cl-对Cu-Cr-Zr合金的腐蚀有促进作用。由于Cl-的加入使合金在同等pH条件下,合金的耐腐蚀性下降。
(3) 碱性环境对Cl-的腐蚀起到抑制作用。碱性环境下OH-与Cl-发生了竞相吸附导致铜合金耐腐蚀性有所提高。
(4) 在不含Cl-的酸性环境中,随着酸性的增强Cu-Cr-Zr合金自腐蚀电位负移,耐腐蚀性降低;在不含Cl-的碱性环境中,随着碱性的增强合金耐腐蚀性变化不规律。在含Cl-的碱性环境中,随着pH的增大合金自腐蚀电位正移,耐腐蚀性增强,在含Cl-的酸性环境中,随着酸性增强,合金耐腐蚀性变化不规律。
[1] 许宜民. 纳米晶铜块体材料的本征电化学腐蚀行为研究[D]. 杭州:浙江大学博士学位论文,2011.
[2] 丁朝模. 有色金属进展(重有色金属)第四卷[M]. 长沙:中南工业大学出版社,1995.
[3] METIKOS H M,BABIC R,PAIC I. Copper corrosion at various pH values with and without the inhibitor[J]. J App Electrochem,2000(30):617-624.
[4] FENG Y,SIOW K S,TEO W K,et al. Corrosion mechanisms and products of copper in aqueous solutions at various pH values[J]. Corrosion,1997(53):389-398.
[5] KHALED M I,AHLAM M F,WAHEED A B. Electrochemical behavior of copper-nickel alloys in acidic chloride solutions[J]. Corrosion Science,2006,48:1912-1925.
[6] 余菲,陈圆,王钢. pH、离子浓度、温度对20A碳钢在NaCl溶液中电化学腐蚀行为的影响[J]. 清洗世界,2012,28(9):22-26.
[7] 朱祖芳. 有色金属的耐蚀性及其应用[M]. 北京:化学工业出版社,1995:132-151.
Effect of pH and Cl-on Electrochemical Corrosion of Cu-Cr-Zr Alloy
CHEN Xiao-na, ZHANG Xiu-qing, CHENG Xiao-min, CHEN Ge, DING Yu-huan
(School of Mechanical & Power Engineering, East China University of Science & Technology, Shanghai 200237, China)
Eelectrochemical methods were applied to study the corrosion resistance of Cu-Cr-Zr alloy under the condition of 0.6 mol/L NaCl solution and pure water solutions with different pH. The structure and morphology of samples after 72 hours immersion tests were characterized by SEM and EDS. Corrosion resistance of samples in different solutions were compared. The results showed that the corrosion resistance of Cu-Cr-Zr alloy was decreased by chloride ions. The electrochemical corrosion of Cu-Cr-Zr alloy in the chlorine solution decreased in the alkaline environment, uniform corrosion occurred in strong acid solution, and localized corrosion occurred in strong alkaline solution.
Cu-Cr-Zr alloy; NaCl solution; electrochemistry; corrosion
2014-03-05
上海市自然科学基金(12ZR1407400)
张修庆(1974-),副教授,博士,从事材料磨损,腐蚀和防护研究,18817515677,chenxiaona2011@126.com
TG174
A
1005-748X(2015)01-0049-05
