葡萄籽原花青素通过细胞外信号调节激酶1/2途径对放射性脑损伤大鼠海马区生长相关蛋白-43活性的影响①
2015-11-22肖颖刘永亮
肖颖,刘永亮
葡萄籽原花青素通过细胞外信号调节激酶1/2途径对放射性脑损伤大鼠海马区生长相关蛋白-43活性的影响①
肖颖1,刘永亮2
目的观察葡萄籽原花青素(GSPE)对放射性脑损伤大鼠的防治作用,并分析可能的保护机制。方法72只3月龄雄性Sprague-Daw ley大鼠随机分为对照组(n=18)、模型组(n=18)、低剂量GSPE组(n=18)和高剂量GSPE组(n=18)。用直线加速器进行脑部照射22Gy制作放射性脑损伤模型。采用穿梭箱实验检测大鼠学习能力;HE染色观察海马区神经细胞组织形态变化;RT-PCR法检测生长相关蛋白-43(GAP-43)mRNA表达,Western blotting检测磷酸化的细胞外信号调节激酶1/2(ERK1/2)表达。结果与模型组比较,各GSPE组动物穿梭箱主动回避反应率显著升高(P<0.001),被动回避潜伏期显著缩短(P<0.001);海马区神经细胞结构损伤减轻;GAP-43mRNA和磷酸化ERK1/2表达水平增高(P<0.001)。且高剂量GSPE组显著优于低剂量GSPE组(P<0.001)。模型组中GAP-43mRNA表达水平与磷酸化ERK1/2水平呈正相关(r=0.764,P<0.001);低剂量GSPE组和高剂量GSPE组中GAP-43mRNA表达水平与磷酸化ERK1/2水平呈正相关(r=0.814,0.822,P<0.001)。结论GSPE通过ERK1/2途径提高大鼠海马区GAP-43表达,发挥防治放射性脑损伤作用。
放射性脑损伤;学习;生长相关蛋白-43;细胞外信号调节激酶1/2;大鼠
[本文著录格式]肖颖,刘永亮.葡萄籽原花青素通过细胞外信号调节激酶1/2途径对放射性脑损伤大鼠海马区生长相关蛋白-43活性的影响[J].中国康复理论与实践,2015,21(12):1397-1401.
CITED AS:Xiao Y,Liu YL.Effectof grape seed proanthocyanidin on grow th associated protein-43 through extracellular signal regulated kinase 1/2 pathway in ratswith brain radiation injury[J].Zhongguo Kangfu Lilun Yu Shijian,2015,21(12):1397-1401.
1 材料和方法
1.1试剂和仪器
GSPE:天津市尖峰天然产物研究开发有限公司,用蒸馏水溶解成所需浓度。ZH-CSC型穿梭实验视频分析系统(Shuttle Box System):安徽正华生物仪器设备有限公司。西门子PRMUSM型直线加速器:德国。
1.2动物分组
72只3月龄雄性Sprague-Daw ley大鼠,体质量(220±20)g,购自北京维通利华公司,合格证号SCXK(京)2003-003。随机分成对照组(n=18)、模型组(n= 18)、高剂量GSPE组(n=18)和低剂量GSPE组(n=18)。各组又分别分为照射后7 d、14 d、28 d 3个亚组。
1.3方法
对照组只进行常规麻醉,不进行照射。
模型组常规麻醉,参考文献[7]制作放射性脑损伤模型。用特制的固定盒固定大鼠,采用加速器产生的6MeV电子线对大鼠进行单次全脑照射,源皮距为100 cm,吸收剂量率250 Mu/m in,吸收剂量为22 Gy;照射时仅头部暴露于射线下,同时使用挡铅保护眼睛、耳朵、颈部、身体。使用1.0 cm厚的组织补偿胶体(Bolx)覆盖头皮,使剂量分布均匀。
高剂量GSPE组和低剂量GSPE组动物照射方法同模型组,于照射前2周开始每天灌胃给药1次,持续至观察时点。给药剂量参考文献[8]:高剂量GSPE组200mg/kg,低剂量GSPE组100mg/kg。
1.4学习能力评测
将各组大鼠按时间点分别放入穿梭箱,适应5 m in消除探究反射后给予铃声刺激5 s,继之给予电击20 s,间隔10 s后进入下一轮训练。训练中,如果在铃声刺激5 s内大鼠逃向安全区,则为主动回避反应,系统自动停止当次训练;如果在铃声刺激5 s内大鼠未逃向安全区,则给予1.5mA交流电20 s,如果在电击后逃向安全区,则为被动回避反应阳性,否则为主动、被动回避反应阴性。每只大鼠电击30次,记录被动回避潜伏期(passiveavoidance latency,PAL)、主动回避反应次数等参数。主动回避反应次数占总训练次数的百分比即为主动回避反应率(active avoidance reaction rate,AARR);AARR越高,PAL越短,表明动物学习能力越强。
1.5脑组织海马区形态结构观察
各组各时间点取3只大鼠,4%多聚甲醛灌注固定后,取脑,截取视交叉平面至大脑横裂脑组织。石蜡包埋、冠状切片,片厚5μm,HE染色。光学显微镜下观察。
1.6RT-PCR法检测GAP-43mRNA表达
各组各时间点取3只大鼠,致死后迅速取双侧海马区组织,称量0.6 g,加入RNAiso Plus溶液1m l匀浆,室温静置5m in后12000 r/m in 4℃离心5min,取上清移至新的1.5m l离心管内,加入1/5RNAiso Plus溶液体积的氯仿,震荡混匀后室温静置5m in,12000r/min 4℃离心15m in,将上清液转移至新离心管中,加入0.5~1倍RNAiso Plus溶液体积的异丙醇,室温静置10 min,12000 r/m in 4℃离心10 m in,弃掉上清液,用与RNAiso Plus溶液等量的75%乙醇清晰沉淀,7500 r/min 4℃离心5m in,弃上清保留沉淀,干燥(不可加热),溶解于30μlDEPC处理水中,测量光密 度(OD)260/280, 根 据 OD260计 算 RNA浓度,-80℃保存。
检测步骤:GAP-43引物(F:CCCAAGCTTCCATGCTGTGCTGTATGAG;R:GGGTACCCTCAGGCATGTTCTTGGTC;上海生工生物技术有限公司合成)。进行Real TimeOne Step RT-PCR反应。Satge 1,2(反转录反应):Reps:1,42℃5m in,95℃10 s;Stage 3 (PCR反应):Reps:40,95℃5 s,60℃31 s;Stage 4(融解曲线分析):Dissociation Protocol。
1.7Western blotting检测磷酸化ERK1/2表达
取材方法同上。蛋白样品40μg与等体积上样缓冲液混合,煮沸10m in后进行100 g/L十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)、转膜;加封闭液,室温下震荡2~3 h后,加入磷酸化ERK1/2单克隆抗体(北京中山生物公司,1∶2000),4℃孵育过夜,用TBST洗膜,加标记的二抗,37℃孵育1 h后,再次TBST洗膜;ECL显色,用图像分析仪测定光密度。
1.8统计学分析
应用SPSS 17.0统计分析软件对数据进行数据处理。组间分析采用析因设计资料的方差分析,组内分析采用SNK-q分析。数据以(±s)表示,显著性水平α=0.05。
2 结果
2.1穿梭实验检测
与对照组相比,模型组动物的AARR显著减小,PAL显著延长(P<0.001),且至照射后28 d时,AARR 和PAL恢复迹象不明显。与模型组相比,GSPE组动物的AARR显著增大,PAL显著缩短(P<0.001),且28 d时AARR和PAL恢复迹象明显。见表1、表2。
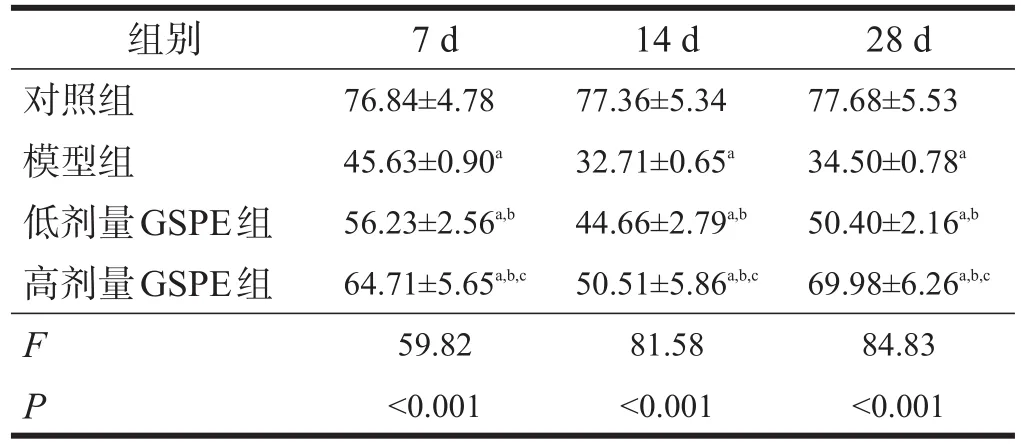
表1 各组大鼠AARR比较(%)

表2 各组大鼠PAL比较(s)
2.2神经细胞形态结构的改变
对照组神经细胞形态结构正常,神经元胞体较大,胞核大而圆,核仁清晰。模型组可见神经细胞变性水肿,细胞轮廓模糊,亦可见部分死亡神经细胞,表现胞体收缩呈多角形或不规则。GSPE组神经细胞形态结构减轻,在高剂量组变化尤为明显。见图1。
2.3RT-PCR
采用2-△△Ct计算法来显示实时定量PCR实验中基因表达的相对浓度。与对照组比较,模型组7 d、14 d GAP-43mRNA表达水平显著增高,28 d有所降低,但仍显著高于对照组(P<0.001);与模型组比较,GSPE组中各时间点GAP-43mRNA表达水平进一步显著增高,高表达状态持续至28 d,在高剂量GSPE组变化尤为明显(P<0.001)。见表3。

图1 各组大鼠海马区神经元形态结构变化(光镜,400×)
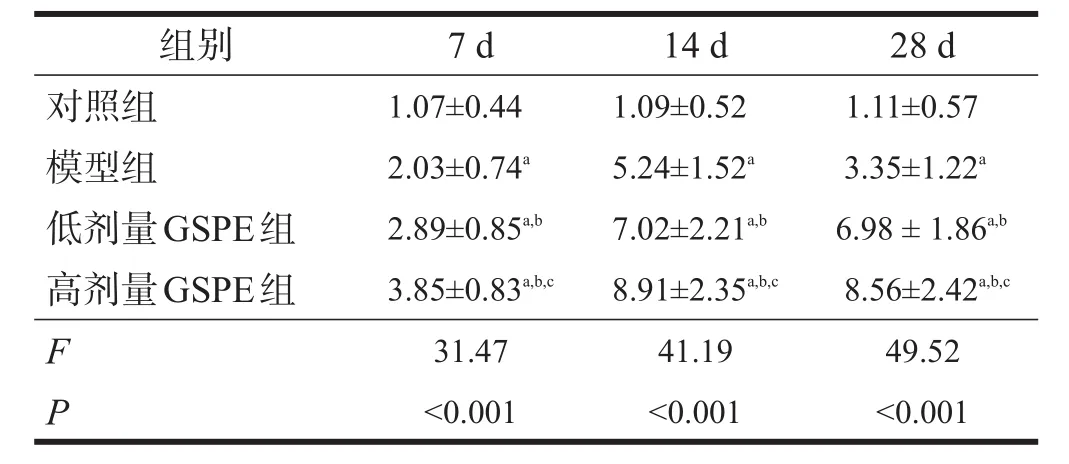
表3 各组大鼠海马区GAP-43mRNA表达水平比较
2.4Western blotting
以β-actin校准后的蛋白条带IOD值反映其蛋白水平。见图2。与对照组比较,模型组7 d、14 d时间点磷酸化ERK1/2表达水平显著增高,28 d有所降低,但仍高于对照组(P<0.001);与模型组比较,GSPE组中各时间点磷酸化ERK1/2表达水平进一步显著增高,高表达状态持续至28 d,在高剂量组变化尤为明显(P<0.05)。见表4。
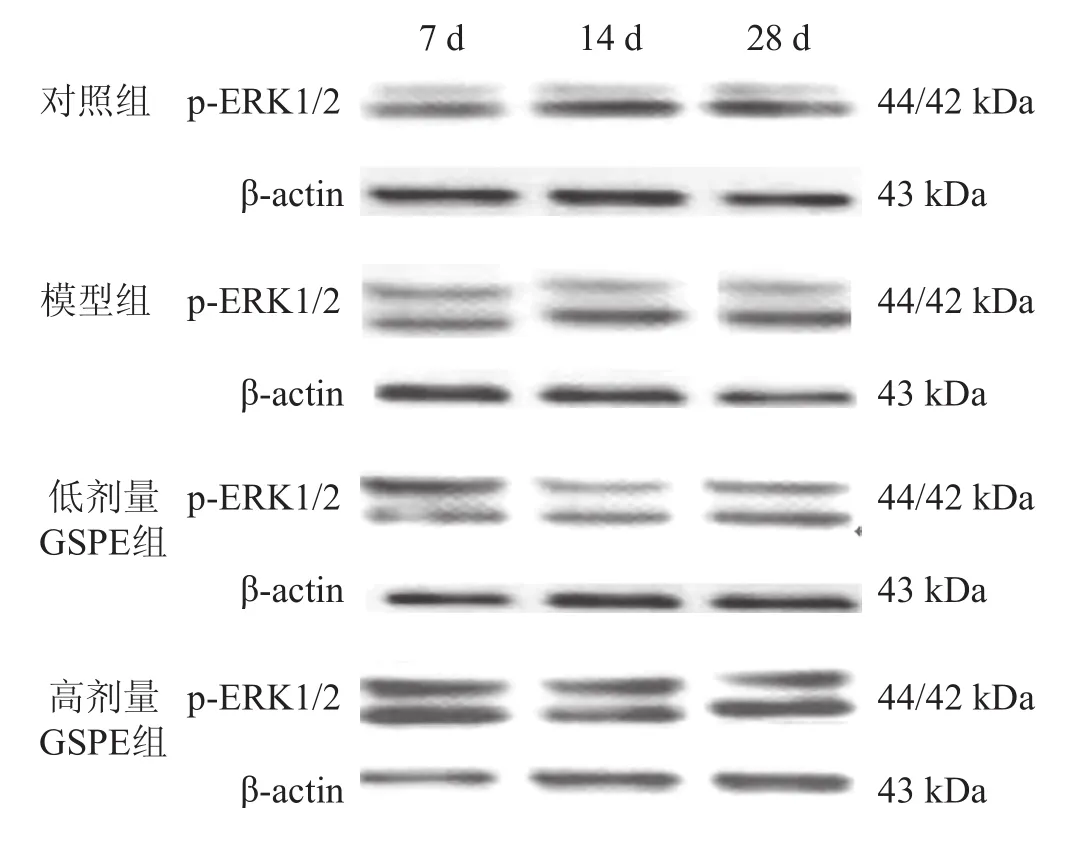
图2 Western blotting检测各组大鼠海马区磷酸化ERK 1/2蛋白表达
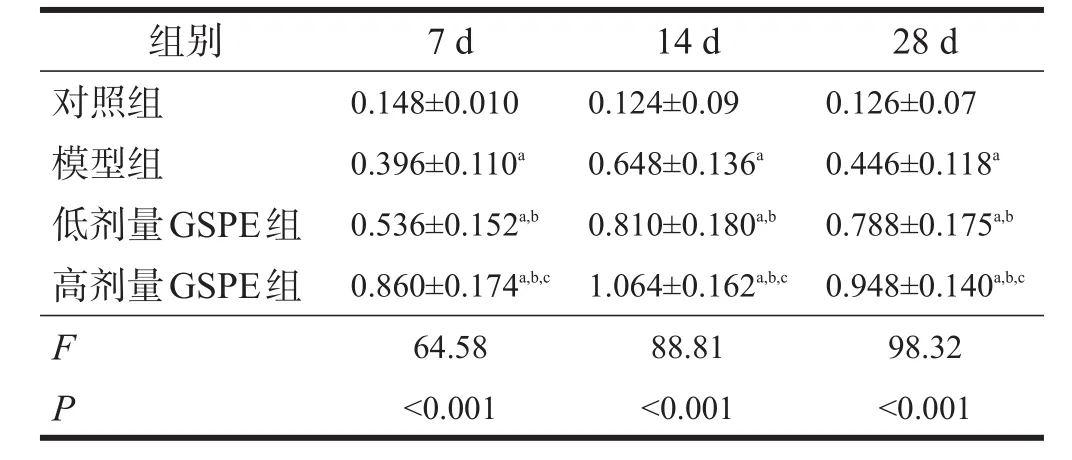
表4 各组大鼠海马区磷酸化ERK 1/2蛋白表达水平比较
2.5相关分析
模型组中GAP-43 mRNA表达水平与磷酸化ERK1/2水平呈正相关(r=0.764,P<0.001)。低剂量GSPE组和高剂量GSPE组中GAP-43mRNA表达水平与磷酸化ERK1/2水平呈正相关(r=0.814,0.822,P< 0.001)。
3 讨论
GSPE是一种理想的天然抗氧化剂和自由基清除剂,具有抗肿瘤、抗辐射、抗衰老等多种药理作用,对癌症、心血管疾病等具有一定的治疗作用,且作用机制多与其强大的抗氧化和自由基清除能力相关[9]。张国瑜等发现GSPE能够促进肺癌细胞中半胱天冬酶-9、半胱天冬酶-3蛋白的表达,提示其可能通过线粒体通路促进癌细胞的凋亡,从而抑制其增殖[10]。
GSPE还具有一定的脑保护作用。目前GSPE脑保护作用的报道主要来自脑缺血、缺氧损伤。王红阳等研究证实GSPE有提高阻塞性睡眠呼吸暂停模式下低氧大鼠脑组织耐受缺氧的作用,减轻大鼠脑组织结构损伤和学习、记忆障碍[11]。刘文倩的研究显示GSPE可抑制脑缺血模型大鼠脑内5-羟色胺的含量,而改善动物学习行为[12]。亦有研究报道GSPE可抑制诱导型一氧化氮合酶(iNOS)的表达、抑制p8MAPK的激活及NF-кB向胞内移位而降低脑内的炎症反应,发挥较强的脑保护作用[13]。本研究结果显示,GSPE组大鼠学习记忆能力显著改善,脑组织形态结构损伤减轻,说明GSPE对放射性脑损伤有较好的防治作用。
GAP-43是轴突生长因子的代表。脑损伤刺激后,未受损神经细胞大量合成GAP-43,可通过与胞内信息分子G蛋白等相互作用,提高兴奋性氨基酸受体的反应性,释放钙调素,促使轴突侧枝出芽和形成,允许神经元轴突继续延伸,调控神经元细胞骨架的重新装配,有利于神经通路的整合[14]。研究显示,参芎化瘀胶囊可促使脑损伤后神经再生和神经功能恢复,其机制均与上调脑内GAP-43表达有关[15]。本研究结果显示,GAP-43在GSPE组呈剂量依赖式增高,且高表达状态时间延长,加之GSPE组动物学习记忆能力检测指标的变化,提示GSPE对放射性脑损伤的防治作用与提高海马区GAP-43活性有关。
ERK1/2是迄今MAPKs家族中研究最为深入的成员。ERK1/2激活可通过基因表达、蛋白合成等影响神经细胞增殖分化、突触可塑性、轴突生长等,参与多种神经系统疾病发生发展[16]。如Zhong等发现外源性手段增加脑内神经生长因子均可扩大或强化神经细胞增殖和分化能力,以补充或替代损伤的神经细胞;而当条件性敲除ERK1/2通路基因,则不能诱导神经轴突生长[17]。
本研究结果显示,磷酸化ERK1/2和GAP-43在GSPE组均呈剂量依赖式增高,且二者高表达时间都出现延长趋势;相关分析显示磷酸化ERK1/2和GAP-43在模型组和GSPE组均呈显著正相关,说明GSPE通过调节ERK1/2信号途径提高海马区GAP-43活性。GSPE的基本作用是清除自由基和抗氧化,在此基础上其神经保护机制包括改脑内能量代谢、改善微环境和微循环、抑制炎症反应、抑制神经细胞凋亡等[18]。
本实验结果表明,GSPE通过ERK1/2途径提高放射性脑损伤大鼠海马区GAP-43活性,减轻放射性脑损伤大鼠学习能力障碍,为GSPE抗肿瘤及抗辐射的应用中提供了一定的理论依据。
[1]Greene-Shloessr D,Moore E,Robbins ME.Molecular pathways:radiation-induced cognitive impairment[J].Clin Cancer Res,2013,19(9):2294-2300.
[2]Takei H,Buckleair LW,Rivera A,et al.Brain tissuemicroarrays in neurodegenerative disease:validation of methodology and immunohistochemical study of grow th-associated protein-43 and calretinin[J].JPathol,2007,57(12):775-783.
[3]唐敬龙,高维娟,钱涛,等.补阳还五汤对血管性痴呆大鼠海马CA1区LTP及ERK2与CaMKIIβmRNA表达的影响[J].中风与神经疾病杂志,2013,10(1):11-14.
[4]BagchiD,Garg A,Krohn RL,etal.Protection effects of grape seedproanthocyanidinsandselectedantioxidant against TPA-induced hepatic and brain lifuid peroxidation and DNA fragmentationandperitonealmacrophageactivationin m ice[J].Gen Pharam col,1998,30(5):771-776.
[5]周坦洋,罗芙蓉,白彬.葡萄籽原花青素生物药理活性的研究进展[J].哈尔滨医科大学学报,2012,46(1):94-96.
[6]李玉白,黄红焰.花青素协同葡萄糖醛酸对辐射大鼠肝功能的影响[J].中国医科大学学报,2013,42(11):1025-1031.
[7]范兴文,贯士阔,吴开良.脑部照射对大鼠情绪和记忆的影响[J].中国癌症,2014,24(11):841-849.
[8]王艳红,杨孝来,王莉,等.葡萄籽原花青素对复发性结肠炎大鼠血清抗氧化能力及NO含量的影响[J].中国临床药理学与治疗学,2010,15(1):47-52.
[9]段国平,刘晓利,赵丕文.葡萄籽原花青素的药理学研究进展[J].环球中医药,2014,7(4):313-316.
[10]张国瑜,张双林.原花青素诱导人肺癌细胞A549凋亡作用研究[J].实用肿瘤杂志,2012,27(1):45-48.
[11]王红阳,赵雅宁,刘文倩,等.葡萄籽原花青素对睡眠呼吸暂停低氧大鼠海马区超微结构及认知功能的影响[J].中国康复理论与实践,2014,20(3):236-239.
[12]刘文倩,赵雅宁,李建民.葡萄籽原花青素对慢性间歇性低氧大鼠空间工作记忆和5-羟色胺的影响[J].医药导报,2015,34 (1):11-15.
[13]赵雅宁,刘文倩,王红阳,等.葡萄籽原花青素对睡眠呼吸暂停模式低氧大鼠海马区磷酸化p38MAPK和IL-1β表达的影响[J].中风与神经疾病杂志,2013,30(11):989-992.
[14]Rossini PM,Dal Forno G.Neuronal post-stroke plasticity in the adult[J].Restor NeurolNeurosci,2004,22(11):193-206.
[15]黄海玲,李建民,赵雅宁.参芎化瘀胶囊对大鼠全脑缺血再灌注损伤及其海马CA1区生长相关蛋白43表达的影响[J].中国中西医结合杂志,2014,34(2):185-190.
[16]Atoh Y,Endo S,Ikeda T,et al.Extracellular signal-regulated kinase 2(ERK2)knockdown m ice show defttits in long-term memory:ERK2 has a specific function in learning andmemory[J].JNeurosci,2007,27(40):10765-10776.
[17]Zhong J,Li X,M cNamee C,etal.Raf kinase signaling functions in sensory neuron differentiation and axon grow th in vivo[J].NatNeurosci,2007,10(5):598-607.
[18]吴秀香.葡萄籽原花青素对小鼠脑缺血再灌注损伤的保护作用及机制研究[D].沈阳:中国医科大学,2006.
Effect of Grape Seed Proanthocyanidin on Grow th Associated Protein-43 through Extracellular SignalRegulated Kinase1/2 Pathway in Ratswith Brain Radiation Injury
XIAO Ying1,LIU Yong-liang2
1.Tangshan Worker Hospital,Tangshan,Hebei 063000,China;2.Tangshan People's Hospital,Tangshan,Hebei 063000,China
Objective To observe the effectof grape seed proanthocyanidin extract(GSPE)on grow th associated protein-43(GAP-43) through extracellular signal regulated kinase 1/2(ERK1/2)pathway in rats with brain radiation injury.Methods 72 3-month male Sprague-Daw ley ratswere divided into controlgroup(n=18),modelgroup(n=18),high dose GSPE group(n=18)and low dose GSPE group (n=18).The brain radiation injury modelswere established by linear accelerator irradiation with 22 Gy.The learning ability was assessed with shuttle box.Themorphological changesof neurons in hippocampuswereobservedwith HE staining;theexpression of GAP-43was detected by RT-PCR;and the expression of phosphorylated ERK1/2 was detected by Western blotting.Results Compared with the model group,the active avoidance reaction rate in the shuttle box test increased and the passive avoidance latency shortened in GSPE groups(P< 0.001);the nerve cellmorphological injury reduced and the expression of GAP-43 mRNA and phosphorylated ERK1/2 increased in the GSPE groups(P<0.001),especially in the high dose GSPE group(P<0.001).The GAP-43mRNA levelpositively correlated with phosphorylated ERK1/2 level in themodelgroup(r=0.764,P<0.001),the low dose GSPEgroup(r=0.814,P<0.001)and thehigh dose GSPEgroup(r= 0.822,P<0.001).Conclusion GSPE could promote the expression of GAP-43 through ERK1/2 pathway in rats,and prevent the brain from radiation injury.
brain radiation injury;learning;grow th associated protein-43;extracellular signal regulated kinase1/2;rats
10.3969/j.issn.1006-9771.2015.12.007
R651.1
A
1006-9771(2015)12-1397-05
河北省科技厅资助项目(No.1327776D)。
1.唐山市工人医院,河北唐山市063000;2.唐山市人民医院,河北唐山市063000。作者简介:肖颖(1974-),女,汉族,河北唐山市人,副主任医师,主要研究方向:脑转移癌的治疗。通讯作者:刘永亮,男,硕士,主任医师。E-mail:zyning789@126.com。
放射性脑损伤(brain radiation injury)是颅面颈区肿瘤放射治疗后的常见并发症。临床报道,接受全脑照射并存活患者出现认知功能障碍的概率高达50%~90%,且认知障碍的程度往往与照射的剂量有关[1],严重影响患者的生存质量。放射性认知损伤与电离辐射引发的神经发生障碍密切相关,促进突触新生和重建药物的研究和开发成为防治电离辐射脑损伤医学研究的热点。
生长相关蛋白-43(grow th associated protein-43, GAP-43)是一种神经生长相关蛋白,是目前国际公认的神经元再生突触重塑的首选分子学标志。脑损伤状态下,GAP-43在中枢神经系统特异性表达,位于新生和损伤后再生神经元的胞浆和轴突,在引导轴突生长和调节轴突形成新的联系上起关键作用[2]。
胞外信号调节激酶1/2(extracellular signal regulated kinase 1/2,ERK1/2)是有丝分裂原活化蛋白激酶(m itogen-activated protein kinases,MAPKs)家族重要组成部分,活化后经多级激酶的级联反应把细胞外刺激信号向细胞内传递,与神经可塑性密切相关[3]。
葡萄籽原花青素(grape seed proanthocyanidin extract,GSPE)是一种从葡萄籽中提取出的生物类黄酮物质。此类物质具有多电子的羟基,均以双键共轭,使得电子在分子中得以稳定;采用化学发光法和细胞色素C还原法检测GSPE清除超氧阴离子和羟基自由基的能力,结果显示与维生素E清除超氧阴离子和羟基自由基的能力比较,50mg/L的GSPE清除超氧阴离子和羟基自由基的能力分别达84%和98%,较维生素C分别高43.9%和57.5%[4]。目前GSPE已逐渐应用到高血压、动脉粥样硬化及脑血管疾病等防治中,并取得较好的治疗效果[5-6]。
本研究建立放射性脑损伤模型,观察GAP-43及ERK1/2活性变化,初步探讨GSPE防治放射性脑损伤认知障碍的作用机制。
2015-08-19
2015-10-15)
