AMPA受体参与大鼠胸髓前角发育早期突触传递的生理学特点①
2015-11-22张雯秀段红梅谢雅彬李曼丽杨朝阳李晓光
张雯秀,段红梅,谢雅彬,李曼丽,杨朝阳,李晓光
·基础研究·
AMPA受体参与大鼠胸髓前角发育早期突触传递的生理学特点①
张雯秀1,段红梅2,谢雅彬1,李曼丽2,杨朝阳1,李晓光1
目的探讨α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(AMPA)受体参与大鼠脊髓发育早期突触传递的生理学特点。方法选取胎龄17 d(E17,n=12)和20 d(E20,n=12)的Wistar大鼠以及新生7 d(P7,n=12)的Wistar大鼠共计36只。胸髓钙调蛋白依赖性蛋白激酶Ⅱ(CaMKⅡ)免疫荧光染色观察AMPA受体的分布,电生理平面微电极阵列记录技术(MED-64系统)检测AMPA受体参与突触传递的场兴奋性突触后电位(fEPSP)的变化。结果E17大鼠脊髓灰质开始出现少量CaMKⅡ阳性神经元,E20、P7大鼠脊髓周围CaMKⅡ阳性神经元逐渐向内迁移,神经元的数量不断增多。电生理结果显示,E17、E20、P7大鼠诱发的fEPSP数量依次增多,并能够被6-氰基-7-硝基喹喔啉-2,3-二酮(CNQX)阻断,脊髓灰质内突触联系的空间网络范围显著减小(P<0.001)。结论AMPA受体参与大鼠脊髓早期发育,并作为脊髓前角神经网络中功能性突触联系的主要兴奋型受体。
α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体;脊髓发育;场兴奋性突触后电位;突触联系;大鼠
[本文著录格式] 张雯秀,段红梅,谢雅彬,等.AMPA受体参与大鼠胸髓前角发育早期突触传递的生理学特点[J].中国康复理论与实践,2015,21(12):1385-1390.
CITED AS:ZhangWX,Duan HM,Xie YB,etal.Physiological characteristics of synaptic transm ission of anteriorhorn early development in thoracic spinal cordmediated by AMPA receptors in rats[J].Zhongguo Kangfu Lilun Yu Shijian,2015,21(12):1385-1390.
脊髓在发育过程中,中央管的室管膜细胞逐渐增殖、迁移,并分化形成不同类型的神经元。神经元按照释放递质的不同分为胆碱能神经元、氨基酸能神经元、肽能神经元及胺能神经元。α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(α-am ino-3-hydroxy-5-methyl-4-isoxazolepropionic acid,AMPA)受体是中枢神经系统主要的兴奋性突触后谷氨酸能神经元受体,与N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体同属离子型谷氨酸受体家族,由4个亚基(GluA1~GluA4)组成,具有功能性配体门控离子型通道[1-3]。
1 材料与方法
1.1材料
1.1.1实验动物及分组
Wistar健康雌性大鼠18只,SPF级,体质量220~250 g;雄性大鼠9只,体质量300~350 g。均由首都医科大学动物实验中心提供。
在动物部(温度24~26℃,湿度50%)饲养1周后,按照雌∶雄=2∶1的比例进行合笼,动物自由取食、饮水,于合笼第2天开始观察,若观察到有阴栓视为怀孕(E0),将怀孕后的雌鼠单笼饲养并标记分组,仔鼠出生当日视为P0。依次分为E17组(n=12)、E20组(n= 12)、P7组(n=12)。
1.1.2主要试剂和仪器
小鼠抗微管相关蛋白2(m icrotubule associated protein 2,MAP2)单克隆抗体、兔抗CaMKⅡ多克隆抗体、6-氰基-7-硝基喹喔啉-2,3-二酮(6-cyano-7-nitroquinoxaline-2,3-dione,CNQX):SIGMA公司。A lexa 594山羊抗兔和Alexa 488山羊抗小鼠荧光二抗:INVITROGEN公司。Hoechst33342:SIGMA公司。
P515A探针MED64 Probe:日本ALPHA MED SCIENTIFIC。SHA-22L盖网及锚:HARVARD, USA。CM 1850恒冷切片机:德国LEICA。DTK-1000振动切片机:日本DSK。DP73 CCD显微照相机:OLYMPUS。BX51荧光显微镜:OLYMPUS。
1.2方法
1.2.1灌流切片
孕鼠6%水合氯醛0.6m l/100 g腹腔麻醉,0.9%氯化钠300m l快速心脏灌注10m in后再慢速灌注约30 m in,换4%多聚甲醛500m l心脏慢速灌注约40m in,剖腹取出E17、E20胎鼠,并将脊髓完整取出,置于4%多聚甲醛(pH 7.2)中固定8 d后换30%蔗糖脱水,直到脊髓完全沉底;P7仔鼠同样用6%水合氯醛腹腔麻醉,经心脏灌注后取出脊髓,固定过夜换30%蔗糖脱水直至完全沉底,取胸髓节段。-25℃恒冷切片机连续冠状切片,厚20μm,贴片并于-20℃冰箱保存。
1.2.2免疫荧光染色
切片从-20℃冰箱取出晾干并复温至室温。分别用蒸馏水及PBST各漂洗5m in,3次,用10%正常山羊血清NGS室温封闭30m in,加入小鼠抗MAP2和兔抗CaMKⅡ一抗混合液(均为1∶200),4℃冰箱孵育60 h。PBST漂洗5m in,3次,加入A lexa 594标记山羊抗兔和A lexa 488标记山羊抗小鼠荧光二抗混合液(均为1∶100),室温孵育8 h。PBST漂洗5 m in,3次,Hoechst33342(1∶2000)复染核,室温5 min,PBST漂洗5m in,蒸馏水漂洗5m in,2次,防淬灭封片剂封片,荧光显微镜镜检并拍照保存。
1.2.3电生理记录
1.2.3.1脊髓薄片制备
孕鼠用6%水合氯醛0.6m l/100 g腹腔麻醉,分别取出胎鼠。出生后大鼠用6%水合氯醛0.6m l/100 g腹腔麻醉。依次分离皮肤、肌肉及椎板并将脊髓完全暴露,将完全剥离的脊髓置于冰水混合的人工脑脊液(artificial cerebrospinal fluid,ACSF)中静置30 s后,光学显微镜下分离出胸段脊髓并剥去硬脊膜。将修整好的脊髓固定在振动切片机浴槽的底板上,切取厚350~400μm的冠状胸段脊髓片,将脊髓片置于通有95% O2和5%CO2混合气的孵育液中,孵育1.5~2 h。
1.2.3.2MED-64平面微电极阵列记录
探针MED64 Probe使用前用0.1%聚氮丙啶(polyethylenim ine,PEI)硫化物硼酸盐过夜处理,并在实验前用蒸馏水反复冲洗5次。脊髓经过1.5~2 h孵育后,选取一张结构清晰完整的脊髓片移入到MED64 Probe中,在倒置显微镜(Olympus,SZ51)下找到脊髓前角区域,调整位置直到64个电极点全部覆盖在脊髓前角区域,用盖网及锚固定脊髓片,使用蠕动泵(M inipuls3,Gilson)持续灌流通有混合气(95%O2和5%CO2)的ACSF,流速为2~5m l/m in。持续灌流20m in并检测灌流噪声,待灌流噪声稳定在±5μV时开始记录。刺激强度依次从30~199μA进行选取,选择能够引起40%~60%最大反应强度的电流强度进行记录,刺激频率为0.1 Hz。开始记录20m in后以AMPA受体阻断剂6-氰基-7-硝基喹喔啉-2,3-二酮(6-cyano-7-nitroquinoxaline-2,3-dione,CNQX)10μmol/L灌流,待兴奋性突触后电位(excitatory postsynaptic potential,EPSP)振幅明显下降后进行洗脱。用CCD显微照相机采集脊髓片MED-64 Probe图像。
1.3统计学分析
采用SPSS 17.0软件进行统计学分析。场兴奋性突触后电位(field excitatory postsynaptic potentials,fEPSP)数量根据MED-64通道中能够记录到fEPSP的通道数量计算。fEPSP振幅选取10ms为时间窗,以基线0 μV为起始到fEPSP波谷的距离记为反应振幅。电生理统计的下降率按(基线-给药)/基线×100%计算。所有计量资料采用(±s)表示。组间比较采用单因素方差分析,显著性水平α=0.05。
2 结果
2.1免疫荧光染色
E17大鼠MAP2与CaMKⅡ双阳性细胞数较少,神经元呈圆形或椭圆形,没有明显的树突及轴突形态(图1A、图1a)。E20和P7大鼠脊髓灰质内阳性细胞数明显增多,灰质所占比例减小,神经元形态逐渐发育完善,形成具有树突及轴突的多角形神经元(图1B、图1b和图1C、图1c)。
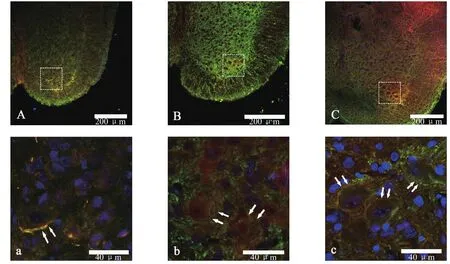
图1 三组大鼠脊髓前角MAP2(绿)与CaMKⅡ(红)免疫荧光染色
2.2fEPSP
E17、E20和P7大鼠给予最佳刺激,在刺激点周围可以观察到两种波形不同的电位反应(图2)。fEPSP数量统计结果显示,从E17到P7,诱发的fEPSP数量逐渐增多(P<0.001)。见图3。fEPSP振幅显著减小(P< 0.001)。见图4。
CNQX灌流脊髓切片后,可以观察到fEPSP的振幅显著降低,洗脱后基本恢复。见图5。
对比给药前,三组给药后fEPSP的振幅分别显著减小(68.04±3.34)%、(88.72±2.90)%、(81.93±3.86)% (P<0.001)。见图6。
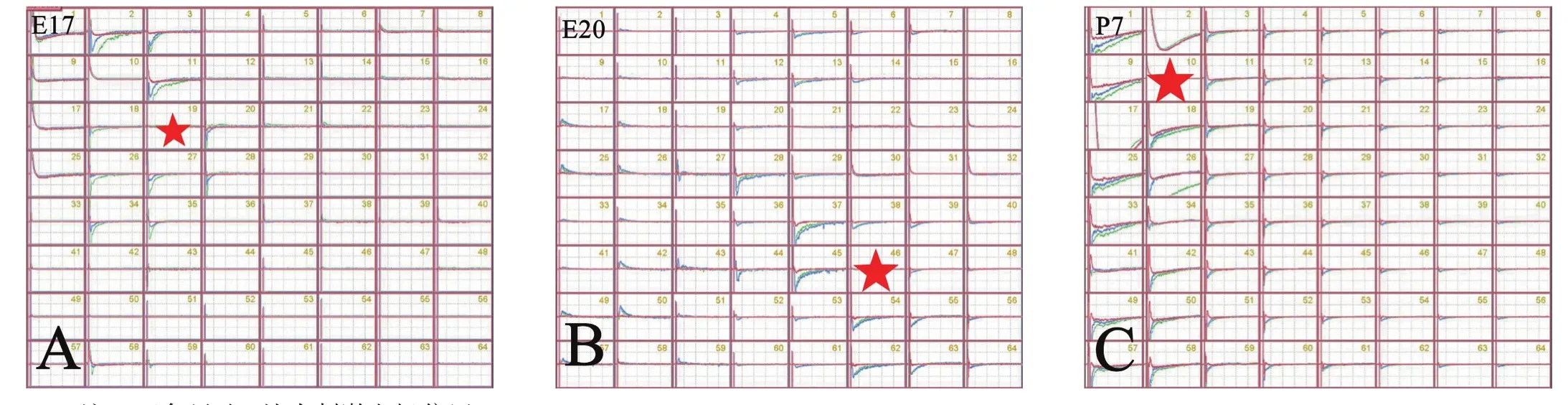
图2 MED-64系统记录大鼠脊髓前角fEPSP放电分布情况

图3 三组大鼠脊髓前角fEPSP放电数量(n=6)
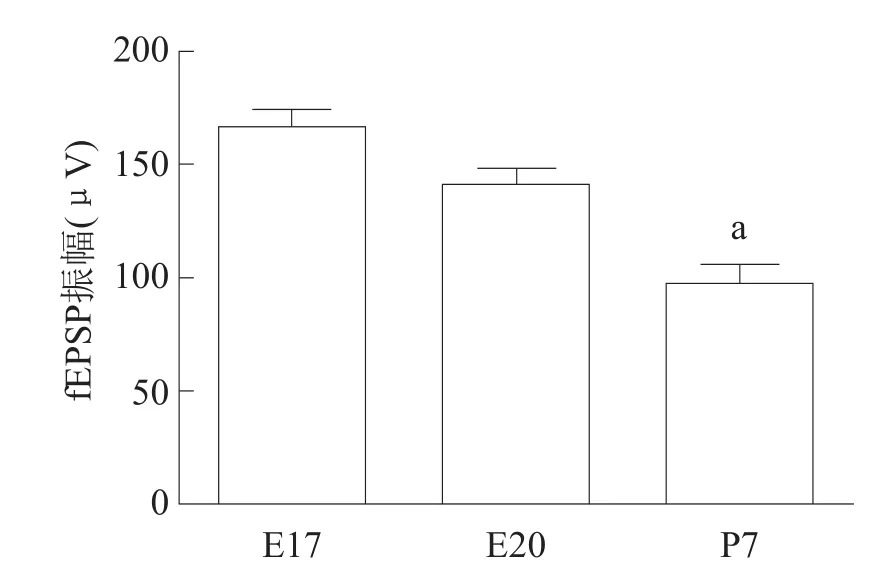
图4 三组大鼠脊髓前角fEPSP振幅变化(n=6)

图5 应用AMPA受体竞争性拮抗剂CNQX阻断大鼠脊髓前角fEPSP振幅变化情况(CCD显微照相机摄)
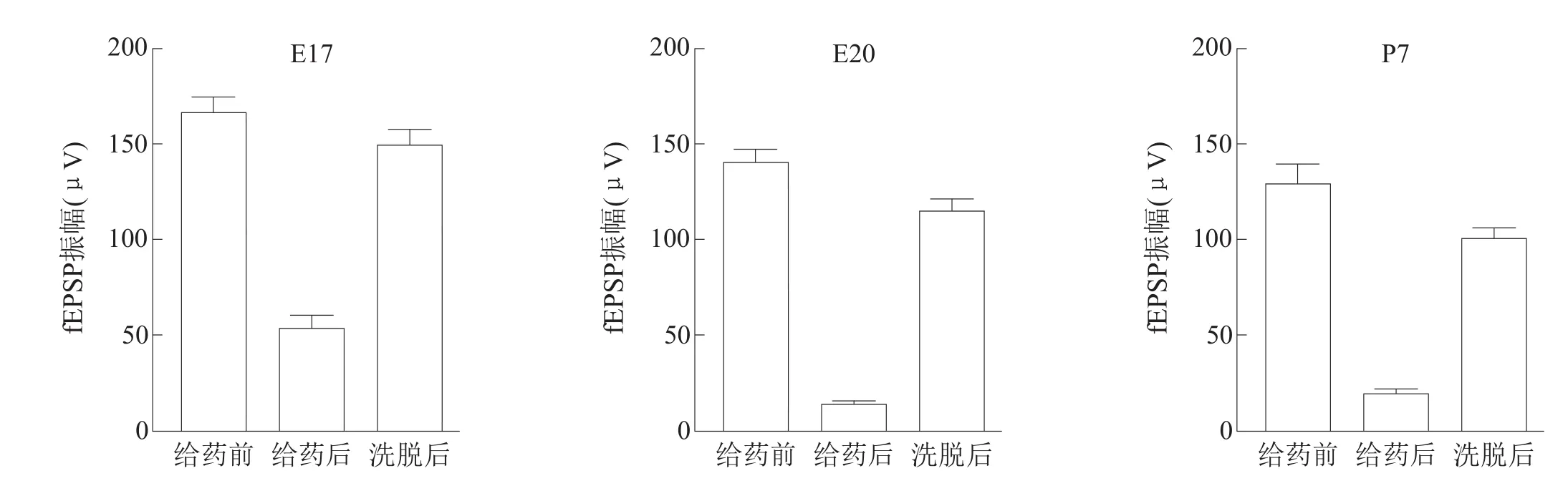
图6 应用AMPA受体竞争性拮抗剂CNQX阻断大鼠脊髓前角fEPSP振幅变化情况
3 讨论
CNS损伤一直被认为是中枢神经修复的一个重大难题,其中研究CNS发育是现代神经科学领域了解CNS再生后神经元变化的主要方式。AMPA受体作为哺乳动物CNS中重要的兴奋性谷氨酸非NMDA离子型受体,介导CNS中快兴奋性突触传递,主要参与CNS神经发育和信号转导。近期研究发现,AMPA受体主要分布在大脑海马[9]及小脑[10-11]的一些脑区神经细胞的突触后膜上,并参与学习和记忆活动[12]。但是对于AMPA受体在脊髓中的作用及功能却鲜有报道。
MED-64通道系统作为近年来研究神经网络的一种新型技术,已经被作为研究各突触间神经网络关系的一种重要手段[13-15],它可以选择一个点作为刺激位点并观察和持续记录周围63个位点的电位变化,并可以通过药理学手段来观察其药理学变化。
在哺乳动物胚胎发育阶段,中央管中的神经上皮细胞逐渐发育形成室管膜细胞,在脊髓发育神经板时期,腹侧的底板细胞发育形成脊髓灰质前角,运动神经元主要分布于此[16]。树突是神经元中接收、整合及传递信息的重要因素,树突的发育情况直接影响神经电活动情况以及神经网络的形成[17]。
本研究结果显示,E17胎鼠胸段脊髓前角的MAP2阳性细胞较少。随着发育的进行,神经元逐渐向中央迁移,前角中MAP2阳性细胞数量明显增多。神经元逐渐由椭圆形变成多角形,神经丝结构逐渐清晰,树突结构明显,脊髓灰质逐渐呈现 “蝴蝶”型。说明胚胎期脊髓灰质中的祖细胞经过分化和迁移,逐渐形成成熟的神经元。
谷氨酸是CNS中主要的兴奋性神经递质,CaMKⅡ磷酸化谷氨酸AMPA受体,增加其电导性[18],并且在大脑中能够诱导激活AMPA受体的转运和学习功能[19]。在本实验中,MAP2与CaMKⅡ阳性细胞E17即共定位表达,说明从E17开始,脊髓前角的成熟神经元中已经存在AMPA受体。
近年来研究发现,神经系统的发育可以分为两个时期:①机体自身驱动的活动,由此建立一个网络框架;②活动依赖性的可塑性,在已经建立的突触上加工和修饰[20]。在哺乳动物胚胎发育阶段和出生后早期,自发突触活动主要驱动其所需的循环机制;随后根据机体内环境的变化,诱发出一系列的突触活动,并在神经系统发育成熟中起重要作用[20]。
fEPSP是由刺激脊髓前角神经元并在周围神经元内记录到的电活动,当分别给予E17、E20、P7大鼠胸段脊髓前角相同刺激强度时,记录电极所记录到的fEPSP数量随着发育的进行而增多,并且形成不同类型的放电波形,包括正向波和负向波;随着发育的进行,fEPSP的振幅逐渐减小。以上结果说明大鼠脊髓在发育过程中由于神经元逐渐发育完善,突触间的联系增多,并逐渐形成功能性神经网络。这与免疫荧光染色结果相一致。
有研究表明,AMPA受体过量表达会引起肌萎缩侧索硬化症、脑卒中和脊髓损伤[21-22]。而同样有研究表明,CNQX作为AMPA受体拮抗剂能够抑制AMPA受体介导的电活动,可以作为神经保护剂治疗神经退行性疾病和外伤[23]。另外,在大脑[24]与小脑[25]中,CNQX通过抑制中间神经元的兴奋性反应,使细胞间突触传递减少,进一步提高下一级神经元的兴奋性。本实验显示,CNQX可以抑制AMPA受体介导的负向fEPSP振幅,采用ACSF进行灌流洗脱后fEPSP恢复。这说明在大鼠胸髓前角发育早期存在AMPA受体,并作为兴奋性功能突触受体传递神经电活动,这也与发育期AMPA受体的变化规律相吻合。
综上所述,AMPA受体可能作为脊髓发育早期主要的兴奋性功能突触发挥信号传导作用,在早期神经网络活动中起重要的调控作用。谷氨酸能AMPA受体如何在参与脊髓发育早期突触传递的过程中受到多种其他受体的影响,如何调控与其他受体间的相互作用,将可能成为研究AMPA受体突触传递调节机制新的热点。
[1]Traynelis SF,Wollmuth LP,Mcbain CJ,etal.Glutamate receptor ion channels:structure,regulation,and function[J].PharmacolRev,2010,62(3):405-496.
[2]Lee HK.Ca2+-permeableAMPA receptors in homeostatic synaptic plasticity[J].Front MolNeurosci,2012,5(3):17.
[3]Gan Q,Salussolia CL,Wollmuth LP.Assembly of AMPA receptors:mechanisms and regulation[J].JPhysiol,2015,513(1): 39-48.
[4]Huang Y,Goshgarian HG.The potential role of phrenic nucleus glutamate receptor subunits in mediating spontaneous crossed phrenic activity in neonatal rat[J].Int JDev Neurosci,2009,27 (5):477-483.
[5]Yoon YJ,White SL,NiX,etal.Downregulation of GluA2AMPA receptor subunits reduces the dendritic arborization of developing spinal motoneurons[J].PLoS One,2012,7(11): e49879.
[6]Schiapparelli L,Simón AM,Del Río J,et al.Opposing effects of AMPA and 5-HT1A receptor blockade on passive avoidance and object recognition performance:correlationwith AMPA receptor subunit expression in rat hippocampus[J].Neuropharmacology,2006,50(7):897-907.
[7]Chater TE,Goda Y.The role of AMPA receptors in postsynapticmechanisms of synaptic plasticity[J].Front Cell Neurosci, 2014,8:401.
[8]Ferguson AR,Bolding KA,Huie JR,et al.Group Imetabotropic glutamate receptors controlmetaplasticity of spinal cord learning through a protein kinase C-dependantmechanism[J]. JNeurosci,2008,28:11939-11949.
[9]Lee HK,Barbarosie M,Kameyama K,etal.Regulation of distinct AMPA receptor phosphorylation sites during bidirectional synaptic plasticity[J].Nature,2000,405(6789):955-959.
[10]Das I,Park JM,Shin JH,etal.Hedgehog agonist therapy corrects structural and cognitive deficits in a Down syndrome mousemodel[J].SciTranslMed,2013,5(201):201ra120.
[11]Kohda K,KakegawaW,Yuzaki M.Unlocking the secrets of theδ2 glutamate receptor:A gatekeeper for synaptic plasticity in the cerebellum[J].Commun Integr Biol,2013,6(6):e26466.
[12]Hoy KC,Huie JR,Grau JW.AMPA receptormediated behavioral plasticity in the isolated rat spinal cord[J].Behav Brain Res,2013,236(1):319-326.
[13]Oka H,Shimono K,Ogawa R,et al.A new planarmultielectrode array forextracellular recording:application to hippocampalacute slice[J].JNeurosciMethods,1999,93(1):61-67.
[14]Lai YJ,Huang EY,Yeh HI,et al.On themechanisms of arrhythm ias in the myocardium of mXinalpha-deficientmurine left atrial-pulmonary veins[J].Life Sci,2008,83(7-8): 272-283.
[15]Zhang HM,RobinsonN,Gómez-Curet I,et al.Neuronal and network activity in networks of cultured spinal motor neurons[J].Neuroreport,2009,20(9):849-854.
[16]Jo KD,Lee KS,LeeWT,etal.Expression of transient receptor potential channels in the ependymal cells of the developing ratbrain[J].AnatCellBiol,2013,46(1):67-78.
[17]Neale EA,Bowers LM,Sm ith TG Jr.Early dendrite development in spinal cord dellcultures:aquantitative study[J].JNeurosciRes,1993,34(1):54-66.
[18]Derkach V.Zoom ing in on AMPA receptor regulation by CaMKⅡ[J].NatNeurosci,2011,14(6):674-675.
[19]Naskar S,Wan H,Kemenes G.pT305-CaMKII stabilizes a learning-induced increase in AMPA receptors for ongoing memory consolidation after classical conditioning[J].Nat Commun,2014,5:3967.
[20]JablonskiAM,Kalb RG.GluA1 promotes the activity-dependentdevelopmentofmotor circuitry in the developing segmentalspinalcord[J].Ann N YAcad Sci,2013,1279:54-59.
[21]Chiu AY,Zhai P,Dal Canto MC,et al.Age-dependent penetranceof disease in a transgenicmousemodelof familialamyotrophic lateral sclerosis[J].Mol Cell Neurosci,1995,6(4): 349-362.
[22]Netzahualcoyotzi C,Tapia R.Degeneration of spinal motor neurons by chronic AMPA-induced excitotoxicity in vivo and protection by energy substrates[J].Acta Neuropathol Commun,2015,3:27.
[23]Gerardo-Nava J,Mayorenko II,Grehl T,etal.Differentialpattern of neuroprotection in lumber,cervical and thoracic spinal cord segments in an organotypic ratmodel of glutamate-induced excitotoxicity[J].JChem Neuroanat,2013,53:11-17.
[24]Maccaferri G,Dingledine R.Complex effects of CNQX on CA1 interneurons of the developing rathippocampus[J].Neuropharmacology,2002,43(4):523-529.
[25]Menuz K,Stroud RM,Nicoll RA,et al.TARP auxiliary subunits switch AMPA receptor antagonists into partial agonists[J].Science,2007,318(5851):815-817.
Physiological Characteristics of Synap tic Transm ission of Anterior Horn Early Developm ent in Thoracic Spinal Cord Mediated by AMPAReceptors in Rats
ZHANGWen-xiu1,DUANHong-mei2,XIEYa-bin1,LIMan-li2,YANG Zhao-yang1,LIXiao-guang1
1.Department of Neurobiology,CapitalMedical University,Beijing 100069,China;2.Departmentof Biomedical Engineering,Schoolof BiologicalScienceand Medical Engineering,Beihang University,Beijing 100191,China
Objective To explore the physiological characteristicsof synaptic transmission of anteriorhorn early development in thoracic spinal cordmediated byα-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid(AMPA)receptors in rats.Methods 36Wistar ratswere divided into embryonic 17 days group(E17,n=12),embryonic 20 days group(E20,n=12)and postnatal7 days group(P7,n=12).Immunofluorescentstaining of calmodulin-dependentprotein kinaseⅡ(CaMKⅡ)was used to test the distribution of AMPA receptors.Multi-electrode array technique(MED-64 system)wasused to test the changesof field excitatory post-synaptic potential(fEPSP)of synaptic transm issionmediated by AMPA receptor.Results Therewas small amount of CaMKⅡ-positive neurons existing in graymatter of spinal cord at E17,CaMKⅡ-positive neurons migrated to the center,and the number of neurons becamemore andmore in E20 and P7 rats.The number of evoked fEPSPgradually increased in rats from E17 to P7,and could be blocked by 6-cyano-7-nitroquinoxaline-2,3-dione(CNQX).The range of synaptic connection in spinal cord graymatter significantly reduced(P<0.001).Conclusion AMPA receptors participate in the early developmentof spinal cord in ratsand actas themain excitatory receptorof functionalsynaptic connection in neuralnetwork of ventricornu.
α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid receptor;spinal cord development;field excitatory postsynaptic potential;synaptic connection;rats
10.3969/j.issn.1006-9771.2015.12.005
R651.2
A
1006-9771(2015)12-1385-06
1.国家 “863”计划项目(No.2012AA020206);2.国家自然科学基金面上项目(No.31271037);3.国家自然科学基金国际合作与交流项目(No.31320103903);4.“十二五”国家科技支撑计划项目(No.2012BAI17B04);5.高等学校全国优秀博士学位论文作者专项资金资助项目(No.201356);6.国家国际科技合作专项项目(No.2014DFA30640);7.国家自然科学基金委员会资助项目(No.31130022)。
1.首都医科大学神经生物学系,北京市100069;2.北京航空航天大学生物医学工程学院,北京市100191。作者简介:张雯秀(1989-),女,新疆克拉玛依市人,硕士研究生,主要研究方向:AMPA受体在发育及脊髓损伤大鼠胸段脊髓中的表达情况及分布规律。通讯作者:李晓光(1959-),男,吉林长春市人,博士,教授,主要研究方向:应用组织工程学方法修复神经系统损伤的研究。E-mail:lxgwelcome@263. net。
先前研究发现,发育过程中AMPA受体在胚胎期及新生大鼠的中枢神经系统(central nervous system, CNS)中表达,并随着年龄的增长而逐步发育完善[4-5]。早期研究主要集中于探讨大脑中AMPA受体的作用机制及生理生化特征[6-7],并发现AMPA受体功能的改变导致大脑学习和记忆功能的减弱和丧失[8]。目前对于脊髓中AMPA受体能否参与突触传递,以及AMPA受体在参与形成神经网络的过程中的作用机制尚未有明确的报道。
本实验利用免疫荧光染色观察脊髓前角中钙调蛋白依赖性蛋白激酶Ⅱ(calmodulin-dependent protein kinase II,CaMKⅡ)阳性神经元的形态、分布及变化规律,采用电生理MED64平面微电极阵列技术检测发育期AMPA受体介导的神经网络活动变化,结合药理学检测AMPA受体在不同发育阶段的兴奋性特征,以探讨AMPA受体参与大鼠脊髓发育早期突触传递的生理学特点。
2015-09-18
2015-10-10)
