雷替曲塞联合顺铂同步放化疗治疗局部晚期食管癌的近期疗效观察
2015-11-21时亚伟吴朝阳
王 燕,时亚伟,吴朝阳,许 刚
(江苏大学附属人民医院肿瘤放疗科,江苏镇江212002)
雷替曲塞联合顺铂同步放化疗治疗局部晚期食管癌的近期疗效观察
王 燕,时亚伟,吴朝阳,许 刚
(江苏大学附属人民医院肿瘤放疗科,江苏镇江212002)
目的:探讨雷替曲塞联合顺铂同步放化疗治疗局部晚期食管癌的近期疗效及不良反应。方法:66例局部晚期食管癌患者,利用随机数字表法随机分成观察组及对照组,各33例,观察组放疗同步雷替曲塞加顺铂化疗,对照组放疗同步5-氟尿嘧啶(5-Fu)联合顺铂化疗。比较两组的近期疗效及不良反应。结果:观察组的近期有效率(完全缓解+部分缓解)为84.8%(28/33),明显高于对照组[60.6%(20/33),χ2=4.889,P<0.05];两组的1、2年生存率分别为84.8%(28/33),63.6%(21/33)及60.6%(20/33),42.4%(14/33),组间比较差异有统计学意义(χ2分别为4.89、3.88,P<0.05),两组不良反应之间的差异无统计学意义(P>0.05)。结论:雷替曲塞联合顺铂同步放化疗可提高局部晚期食管癌的无进展生存率和总生存率,不良反应可以接受。
食管癌;雷替曲塞;顺铂;5-氟尿嘧啶;同步放化疗
食管癌在我国发病率高,死亡率居世界首位。由于早期食管癌无特殊临床表现,就诊时大多已属于中晚期,失去了根治性手术切除的机会,因此同步放化疗等非手术治疗仍是目前食管癌的主要治疗手段,但是总的5年生存率大约在10%~20%[1]。接受单纯放疗者生存率更低,其中位生存时间仅为6~12个月,5年生存率0%~10%[2]。目前同步放化疗在美国、欧洲和日本已成为不能手术患者的标准治疗方案[3]。我们对收治的局部晚期食管癌采用雷替曲塞联合顺铂化疗,并与同期采用5-氟尿嘧啶(5-Fu)联合顺铂化疗的患者比较;随访2年,分析近期疗效、1年及2年生存率及不良反应,现报告如下。
1 对象与方法
1.1 病例
66例为2011年1月至2013年1月收住入院的初治食管鳞癌(未手术/放疗/化疗和靶向治疗)患者,其中男52例,女14例,年龄45~75岁,中位年龄60岁。所有患者为局部晚期(除T1N0M0和远处转移,AJCC2002),美国东部肿瘤协作组(Eastern Cooperative Onco1ogy Group,ECOG)活动状态评分0~2,预期生存期>3个月,无严重内科疾病。禁忌证:食管穿孔,恶病质,多处远处转移。全部病例均无放化疗禁忌证,采用随机数字表法分为观察组及对照组,两组在ECOG评分、病变部位、浸润深度(T分期)、淋巴结转移情况(N分期)、性别、年龄间差异均无统计学意义,见表1。本研究方案通过伦理委员会审查。

表1 两组患者一般情况比较
1.2 方法
1.2.1 放射治疗放疗设备采用西门子Oncor,计划系统为Pinnac1e3,采用三维适形放疗,CT模拟定位增强螺旋扫描,扫描范围包含下颈部及全胸部(食管下段癌患者包括上腹部到T12下缘),照射野设计时尽可能保护正常器官,所有计划均应用直线加速器及多叶光栅实施。根据ICRU50及ICRU62号报告,勾画肿瘤靶区体积(GTV)、临床靶区体积(CTV)、计划靶区体积(PTV)。6 MV及15 MV X线治疗,常规分割,单次剂量1.8~2 Gy/次,5次/周,总剂量61.2~62 Gy。要求PTV 95%接受100%处方剂量,20 Gy等剂量曲线所包括的肺组织体积占两肺的比例(V20)<30%、30 Gy等剂量曲线所包括的肺组织体积占两肺的比例(V30)<18%、5 Gy等剂量曲线所包括的肺组织体积占两肺的比例(V5)<70%,脊髓最大剂量<45 Gy,心脏平均剂量<30 Gy。计划经验证后开始实施,全部患者均顺利完成放疗。
1.2.2 同步化疗方案 观察组:雷替曲塞2.25 mg/m2静滴,第1天(15 min);顺铂25 mg/(m2·d)(第1-3天),每28天为1个周期,共4~6个周期(至少4个周期)。有1例患者因出现粒细胞缺乏,仅完成2周期化疗,其余32例患者均足量使用雷替曲塞按期完成化疗计划。对照组:5-Fu 2 400 mg/m2持续静脉泵入72 h、顺铂25 mg/(m2·d)(第1-3天),每28天为1个周期,共4~6个周期。有2例患者因粒细胞缺乏,仅完成3周期化疗。
1.3 疗效评价
放疗结束后2个月起进行近期疗效评定,采用WHO实体瘤疗效评价标准,分为完全缓解、部分缓解、稳定及进展,总有效率为完全缓解+部分缓解。所有患者均完成随访。在治疗结束后2年内每3个月随访1次,随访内容包括食管钡餐检查、胸部CT、腹部B超,每6月复查胃镜及上腹部CT。
1.4 不良反应
食管炎,肺炎,血液学指标(白细胞计数、血小板计数和血红蛋白含量),肝肾功能,胃肠道反应(厌食、呕吐和腹泻)等毒性作用的分级标准采用NCICTC 3.0普通毒性标准[4],分为0~4级。
1.5 统计学方法
应用SPSS 15.0软件进行统计分析,计数资料采用χ2检验,生存率采用Kap1an-Meier方法,两组生存率差异的比较采用Log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者近期疗效比较
入组的66例患者均可评价疗效。在观察组中,完全缓解5例,部分缓解23例,病情稳定2例,病情进展3例,有效率84.8%。而在对照组中,完全缓解1例,部分缓解19例,病情稳定5例,病情进展8例,有效率60.6%。两组有效率比较,差异有统计学意义(χ2=4.89,P<0.05)。
2.2 两组患者生存率比较
观察组和对照组1、2年生存率分别为84.8%(28/33)、60.6%(20/33)及60.6%(20/33)、42.4%(14/33),观察组1、2年生存率明显高于对照组(χ2分别为4.89、3.88,P<0.05),见图1。放疗后2年共计死亡32例,死亡原因包括局部未控及远处转移。其中观察组及对照组局部未控分别占15.1%(5/33),18.2%(6/33);远处转移分别为18.2%(6/33),36.4%(12/33);非癌性死亡分别为6.1%(2/33),3%(1/33)。
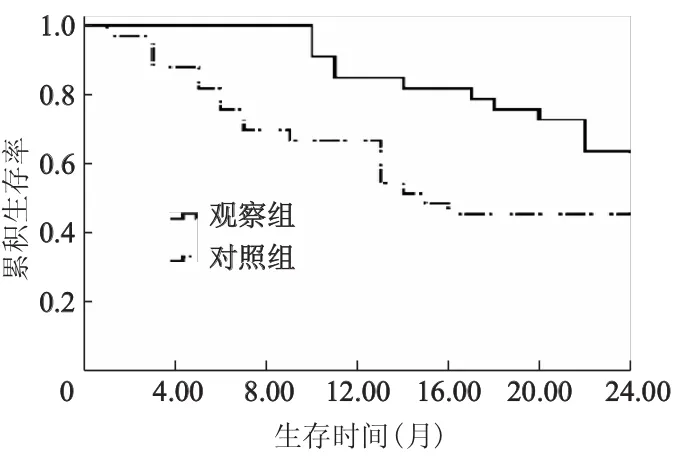
图1 两组患者生存率比较
2.3 不良反应
66例患者部分出现不同程度胃肠道反应、放射性食管炎、放射性气管炎、骨髓抑制等,经对症使用止吐药物、粒细胞集落刺激因子、康复新液、思密达保护消化道黏膜、止咳药物治疗后,不良反应均缓解,两组之间不良反应发生率的差异无统计学意义,见表2。
3 讨论
近年来大量的临床研究表明,采用同步放化疗治疗非手术食管癌,局部控制率和生存率均明显提高。RTOG85-01试验最早将同步放化疗确立为非手术局部进展期食管癌的治疗模式[5],该试验中单纯放疗组放疗剂量为64 Gy、32分次、45 d,同期放化疗组放疗剂量为50 Gy、25分次、35 d,同步化疗采用顺铂75 mg/m2(第1天),5-Fu 1 000 mg/(m2·d)持续静脉泵入(第1-4天),放疗结束后再行3周期的化疗,结果显示同步放化疗组与单纯放疗组5年生存率分别为26%、0%,局部复发率分别为25%、37%,同步放化疗组生存期明显延长、局部复发率降低,但接受放化疗的患者有33%发生Ⅲ度食管炎,而接受单纯放疗的患者中仅为18%,急性放疗反应较单纯放疗组增加。在2008年美国国立综合癌症网络(NCCN)指南第1版中已明确推荐50.4 Gy放疗联合5-Fu/顺铂的同步放化疗方案。但该方案在肾脏、骨髓及胃肠方面的不良反应较大,使其在临床上的应用仍然受到限制。如何选择同步化疗方案,是近来临床研究重点。
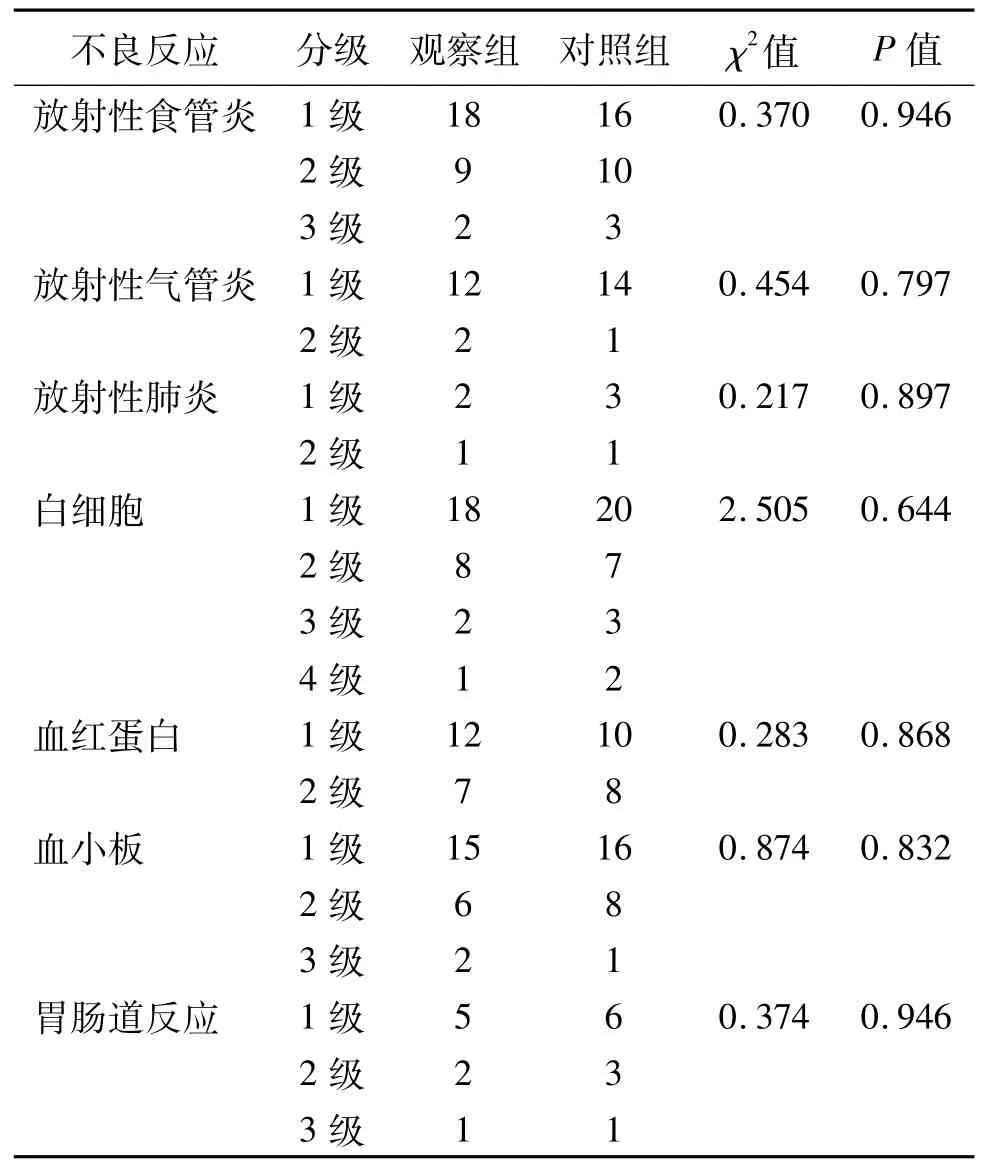
表2 两组患者不良反应比较
本研究考虑到RTOG85-01试验中5-Fu及顺铂剂量较大,部分患者难以完成化疗,剂量调整为5-Fu 2 400 mg/m2持续静脉泵入72 h、顺铂25 mg/(m2·d)(第1-3天),入组患者均能完成治疗。雷替曲塞是5-Fu类似物,通过抑制胸腺嘧啶合成酶发挥抗肿瘤作用。其血浆消除半衰期长(50~100 h),28天只需15 min静脉滴注即可,较之5-Fu的持续静脉泵入,使用方便,还减轻了5-Fu的血液学毒性。由于该药无心脏毒性,尤其适用于有潜在冠心病风险的老年患者,目前广泛应用于结直肠肿瘤的治疗[6-7]。孙静等[8]采用雷替曲塞联合顺铂治疗局部晚期食管癌取得了较好的疗效,故以雷替曲塞替代5-Fu,与顺铂组成同步放化疗中的化疗方案,可以减轻治疗相关毒性,提高治疗依从性。考虑到有2/3的患者同步放化疗效果差,为提高局部控制率,本研究中同步放疗剂量提高到61.2~62 Gy,结果表明雷替曲塞联合顺铂同步放化疗近期有效率及1、2年生存率均优于5-Fu联合顺铂化疗组,两组之间的不良反应无明显差异。
同样的放疗剂量及相同的同步化疗方案治疗不同的食管癌患者时,疗效不尽相同,这与个体差异及肿瘤的放疗敏感性有关,对放疗敏感的患者宜采用同步放化疗,且放疗剂量可适当降低。肖泽芬等[9]报道即使提高放疗总剂量仍有部分患者手术或尸检时发现有肿瘤残留,对此类放疗不敏感患者可通过行术前同步放化疗+手术或通过后程加速超分割放疗,缩短疗程,提高疗效。本研究结果表明雷替曲塞联合顺铂同步放化疗提高了局部晚期食管癌的近期疗效,但是远期疗效仍不明确,需要进一步随访。而且本研究样本量较少,仍需增加样本量作进一步研究。
[1] 殷蔚伯,谷铣之.肿瘤放射治疗学[M].3版.北京:中国协和医科大学出版社,2002:598
[2] Sun DR.Ten-year fo11ow-up of esophagea1 treated by radica1 radiation therapy:ana1ysis of 869 patients[J]. Int J Radiat Onco1 Bio1 Phys,1989,16(2):329-334.
[3] a1-Sarraf M,Martz K,Herskovic A,et a1.Progress report of combined chemoradiotherapy versus radiotherapy a-1one in patients with esophagea1 cancer:an intergroup study[J].J C1in Onco1,1997,15(1):277-284.
[4] Trotti A,Co1evas AD,Setser A,et a1.CTCAE v3.0:deve1opment of a comprehensive grading system for the adverse effects of cancer treatment[J].Sem In Radiat Onco1,2003,13(3):176-181.
[5] CooPer JS,Guo MD,Herskovic A,et a1.Chemoradiotherapy of 1oca11y advanced esophagea1 cancer:1ongterm fo11ow-up of a prospective randomized tria1(RTOG 85-01).Radiation Therapy Onco1ogy Group[J].JAMA,1999,281(17):1623-1627.
[6] Hong W,Sun X,Wu J,et a1.Ra1titrexed-based chemotherapy for advanced co1orecta1 cancer[J].C1in Res Hepato1 Gastroentero1,2014,38(2):219-225.
[7] Ke11y C,Bhuva N,Harrison M,et a1.Use of ra1titrexed as an a1ternative to 5-f1uorouraci1 and capecitabine in cancer patients with cardiac history[J].Eur J Cancer,2013,49(10):2303-2310.
[8] 孙静,胜照杰,郭君兰.雷替曲塞联合顺铂治疗进展期食管癌疗效观察[J].现代中西医结合杂志,2014,23(27):2989-2997.
[9] 肖泽芬,林冬梅,吕宁,等.32例食管癌放射治疗后死亡的尸检分析[J].中华放射肿瘤学杂志,2001,10(2):80-82.
R735.1
B
1671-7783(2015)06-0543-03
10.13312/j.issn.1671-7783.y150172
2015-08-05 [编辑] 何承志
