伤寒沙门菌外膜孔道蛋白ompC、ompF缺陷株的制备及其耐药性
2015-11-21汪伟伟王静瑜张桂红黄新祥生秀梅
汪伟伟,夏 歆,王静瑜,张桂红,陈 龙,黄新祥,生秀梅
(江苏大学医学院,江苏镇江212013)
伤寒沙门菌外膜孔道蛋白ompC、ompF缺陷株的制备及其耐药性
汪伟伟,夏 歆,王静瑜,张桂红,陈 龙,黄新祥,生秀梅
(江苏大学医学院,江苏镇江212013)
目的:制备伤寒沙门菌ompC缺陷株及ompC-ompF双缺陷株,研究外膜孔道蛋白OmpC、OmpF在伤寒沙门菌耐药中的作用。方法:经自杀质粒介导的同源重组方法制备ompC缺陷株及ompC-ompF双缺陷株,比较伤寒沙门菌ompC缺陷株、ompF缺陷株及ompC-ompF双缺陷株与野生株在多黏菌素B、卡那霉素以及氨苄青霉素处理下的生存能力。结果:成功制备伤寒沙门菌ompC单缺陷以及ompC-ompF双缺陷株。各菌株在普通培养条件下生长情况无差异;多黏菌素B及氨青苄霉素处理条件下ompC缺陷株、ompC-ompF双缺陷株生存能力明显强于野生株,而ompF缺陷株生存能力则低于野生株;卡那霉素处理条件下,各缺陷株生存能力均明显低于野生株。结论:外膜孔道蛋白OmpC、OmpF参与伤寒沙门菌耐药,但对不同药物的耐药机制不尽相同,具体机制有待进一步研究。
伤寒沙门菌;OmpC;OmpF;抗生素;耐药性
伤寒沙门菌(Saimoneiia enterica serovar Typhi,S.Typhi)是一种对人类肠道致病的革兰阴性杆菌,感染人体后常引起全身系统性感染伤寒热(typhoid fever)[1-3]。革兰阴性菌的外膜是限制β-内酰胺类抗生素进入菌体的第一道屏障。抗菌药物进入外膜有特异性和非特异性两种通道[4]。大肠埃希菌K-12中外膜亲水性的非特异性孔道蛋白(porin)为三聚体结构,两个孔道蛋白为OmpF与OmpC。OmpF的孔径为1.2 nm,OmpC的孔径为1.1 nm[4-6]。营养物质和β-内酰胺类抗生素大多经过此通道扩散进入大肠埃希菌体内[4]。
有关OmpF与OmpC参与伤寒沙门菌耐药的研究尚未有报道。本研究拟构建ompC缺陷株(ΔompC)及ompC-ompF双缺陷株(ΔompC-ompF),比较伤寒沙门菌ompC缺陷株、ompF缺陷株及ompC-ompF双缺陷株与野生株在多黏菌素B、卡那霉素以及氨苄青霉素处理下的生存能力,旨在探讨外膜孔道蛋白OmpC、OmpF在伤寒沙门菌耐药中的作用。
1 材料与方法
1.1 菌株与质粒
伤寒沙门菌野生株S.Typhi GIFU10007以及ΔompF、E.coii λ372和自杀质粒pGMB151来自日本岐阜大学医学院微生物学教研室;大肠埃希菌DH5α由本实验室保存。
1.2 主要试剂
限制性内切酶Bam HⅠ、T4DNA连接酶、碱性磷酸酶、Ex Taq、Ex Taq缓冲液、dNTP、DL2000标准参照物均为TaKaRa(大连)公司产品;胶回收试剂盒,氨苄青霉素,卡那霉素(Sigma公司);胰蛋白胨和酵母提取物(OXOID公司);PB购自上海谷研实业有限公司;DNA聚合酶pfu(Fermentas公司);酚/氯仿/异戊醇(25∶24∶1)混合液(So1arbio公司);质粒小量提取试剂盒(AXYGEN公司)。实验所用引物由上海生工生物技术服务有限公司合成;NaC1、NaOH、KC1、Na2HPO4、KH2PO4、EDTA-2Na 2H2O、冰乙酸、无水乙醇、异丙醇皆为分析纯级国产试剂。
1.3 主要仪器
核酸紫外检测仪(Eppendorf Biophotometer);PCR仪(Mastercyc1er Persona1,Eppendorf公司,德国);凝胶成像系统(Gene公司、美国);电转化仪(BioRad公司GENE PULSERⅡ);高速冷冻离心机Megafuge(HERAEUS);空气浴摇床TH-15(Johanna Otto公司,德国)。
1.4 方法
1.4.1 引物设计及合成 根据NCBI公布的伤寒沙门菌Ty2基因序列信息,以S.Typhi GIFU10007 DNA为模板,用O1igo 6.0软件在ompC基因上游和下游设计两对特异性PCR引物:P1A/P1B和P2A/ P2B,序列如下,P1A:CGGGATCCCGGTTGAAATAGGGGTAAACAGACA;P1B:CGATGTCCTGGTCTAATTTGTTGCCGTCTT;P2A:CAAATTAGACCAGGACATCGTAAAATACGT;P2B:CGGGATCCGTCATTTTCATCGCTGTTTATCCTC。P1A和P2B含Bam HⅠ酶切位点,在P1A及P2B的5′端加接,下划线部分为Bam HⅠ酶切位点。设计的上游同源片段F1长501 bp,下游同源片段F2长293 bp。上下游片段之间870 bp碱基为缺失部分。利用高保真DNA聚合酶pfu对目的基因进行扩增。
1.4.2 目的基因的获取及阳性克隆的筛选 以S. Typhi GIFU10007的全基因组为模板,PCR扩增目的基因上、下游同源性片段F1、F2。PCR扩增产物进行琼脂糖(10 g/L)凝胶电泳,EB染色,Genius凝胶电泳图像分析系统分析鉴定。以同源性片段F1、F2稀释10倍的混合液为模板,以P1A/P2B为引物进行PCR扩增。大批量扩增后采用Promega公司的胶回收试剂盒回收。回收片段与pGMB151自杀质粒用BamHⅠ酶切处理,用酚仿-乙醇法纯化后T4连接酶16℃连接4 h,将连接产物热击转化入E. coii SPY372λpir感受态细胞。次日挑取48个单菌落增菌后分别刮取菌苔于含40 μL蒸馏水的EP管中,用酚仿抽提法提取基因组进行电泳,初步筛选含阳性质粒的细菌。将阳性质粒送上海生工测序以进一步验证。
1.4.3 阳性自杀质粒电击转化伤寒沙门菌野生株及ΔompF 分别将2 mL LB过夜振摇的野生株和ΔompF以1∶100的比例转接到20 mL LB培养液中培养至对数生长期,制备相应电击感受态细胞。分别取2 μg重组阳性自杀载体与40 μL的电击感受态细胞混合后,加到预冷的电极杯中进行电击转化。电击后立即转到37℃预温的SOC营养液中,37℃振摇1 h,然后涂布于含氨苄西林的LB平板37℃过夜。
1.4.4 同源重组菌株的筛选鉴定 分别挑取一株在氨苄西林平板生长的抗性单菌落接种于1 mL LB液体培养基,37℃250 r/min振摇6 h,用灭菌水稀释105倍后取100 μL涂布于含5%蔗糖的LB平板上37℃过夜培养,筛选耐蔗糖菌落,用PCR(引物P1A、P2B)观察伤寒沙门菌的重组变异。连续3次传代8个单菌落验证均为重组菌,则为稳定变异株。
1.4.5 生长曲线的测定
接种野生株、ΔompC和ΔompF及ΔompC-ompF单菌落到2 mL LB,过夜培养后转接到20 mL LB中,250 r/min,每小时检测菌液600 nm光密度(D)值。重复3次,取平均值,比较各菌株在普通LB下的生长情况。以同样方法检测4种菌株分别在含0.2 μg/mL多黏菌素B、2.0 μg/mL氨苄青霉素或7.5 μg/mL卡那霉素的LB培养条件下的生长情况。
2 结果
2.1 成功制备伤寒沙门菌ompC缺陷株及ompC-ompF双缺陷株
2.1.1 重组质粒pGMB151的构建及酶切鉴定 以伤寒沙门菌GIFU10007野生株基因组DNA为模板进行PCR扩增,获得ompC基因上、下游同源性核苷酸片段F1和F2(图1a)。上下游片段利用黏性末端自连的特性连接成F1-F2片段后,克隆至自杀质粒pGMB151并转化入E.coii SPY372λpir。利用其氨苄西林抗性及空载体与重组载体分子质量大小差异,初筛出阳性菌落,提取阳性质粒进行PCR及Bam HⅠ酶切鉴定,结果表明重组自杀质粒pGMB151构建成功(图1b)。

(a)1:ompC上游扩增片段(501 bp);2:ompC下游扩增片段(293 bp);M:DL2000标准参照物(b)1:重组自杀质粒;2:重组自杀质粒Bam HⅠ酶切;M:DL2000标准参照物图1 重组pGMB151质粒的制备及鉴定
2.1.2 ompC缺陷株的筛选鉴定 将含ompC同源性核苷酸片段的重组自杀质粒pGMB151通过电穿孔法导入到伤寒沙门菌GIFU10007野生株中。首先在氨苄西林平板上筛选抗性菌落,抗性菌落接种于含5%蔗糖的LB平板上37℃温箱过夜培养,筛选耐蔗糖菌落。首次经LB-蔗糖平板筛选的菌落用PCR观察结果,大部分细菌出现大小2个片段,即共价整合体,挑选其中小片段占优势的菌落继续筛选得到完全重组菌株后,在LB平板上连续传代4次,筛选结果均仅有小片段出现(图2),显示已完全重组,说明该菌株已成为稳定的变异株。
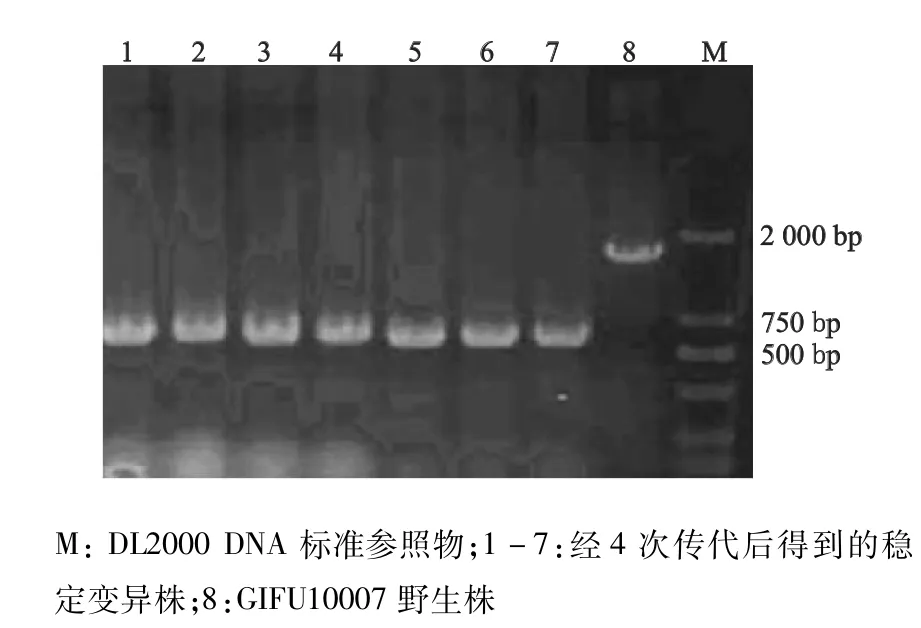
图2 ompC基因缺陷株的筛选
2.1.3 ompC-ompF双缺陷株的筛选鉴定将含ompC同源性核苷酸片段的重组自杀质粒pGMB151通过电穿孔法导入到伤寒沙门菌GIFU10007的ompF缺陷株中。在氨苄西林平板上筛选抗性菌落,抗性菌落接种于含5%蔗糖的LB平板上37℃温箱过夜培养,筛选耐蔗糖菌落。挑选其中小片段占优势的菌落继续筛选得到完全重组菌株后,在LB平板上连续传代4次,筛选结果均仅有小片段出现(图3),说明ompC-ompF双缺陷株制备成功,该菌株已成为稳定的变异株。
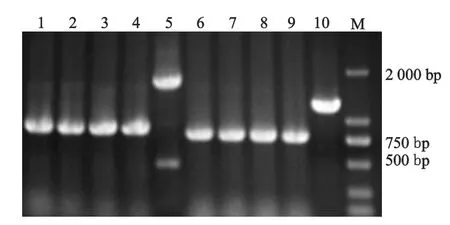
M:DL2000标准参照物;1-4:ompC-ompF双缺陷株ompC基因PCR验证;5:GIFU10007野生株ompC基因PCR验证;6-9:ompC-ompF双缺陷株ompF基因PCR验证;10:GIFU10007野生株ompF基因PCR验证图3 ompC-ompF基因双缺陷株的筛选
2.2 不同药物处理条件下各菌株的生存能力
为探索OmpC及OmpF在伤寒沙门菌耐药中的作用,本研究比较了普通培养条件及多黏菌素B、氨苄西林、卡那霉素处理条件下,伤寒沙门菌野生株、ΔompC、ΔompF及ΔompC-ompF的生存能力。结果见图4。在无药物处理的普通LB培养条件下,各缺陷株与野生株的生存能力基本一致,说明在非药物处理条件下OmpC、OmpF对伤寒沙门菌的生存能力无明显影响。多黏菌素B及氨苄西林处理条件下,ΔompC及ΔompC-ompF生存能力明显强于野生株,而ΔompF则低于野生株。卡那霉素处理条件下,ΔompC、ΔompF及ΔompC-ompF的生存能力均明显低于野生株,说明伤寒沙门菌OmpC和OmpF孔道均参与外排进入菌体内的卡那霉素。

图4 不同药物处理条件下各菌株的生存能力
3 讨论
膜孔道蛋白使某些药物不能进入菌体内部,产生“固有性耐药”(intrinsic resistance)。这种耐药并不是由于染色体的突变或获得耐药质粒所致[4]。目前,关于孔道蛋白的报道主要集中在大肠埃希菌,大肠埃希菌外膜蛋白OmpC、OmpF主要构成细胞膜孔道蛋白,使小分子物质(相对分子质量小于600)渗入细菌体内[7]。孔道蛋白OmpC和OmpF的表达受生长环境因素如温度、渗透压和pH值等的影响,OmpF的孔道直径(1.2 nm)大于OmpC的孔道直径(1.1 nm),所以OmpF在低渗条件下表达,OmpC的孔径较小因而在高盐环境中表达,用来调节细胞膜内外的渗透压[8]。在宿主肠道高渗环境中大肠埃希菌的孔道蛋白以OmpC表达为主,以降低胆盐的渗入[9-10]。
本研究结果说明,药物刺激时,伤寒沙门菌会通过改变OmpF和OmpC的表达,以改变膜的通透性从而参与抵制抗生素的杀伤作用。ΔompC中ompC的缺失可能导致OmpC孔道的关闭,以阻止多黏菌素B及氨苄西林进入菌体内而提高细菌生存能力;OmpF孔道则可能是多黏菌素B及氨苄西林的排出通道,其缺失不利于已进入菌体内药物的外排从而使细菌生存能力下降。大肠埃希菌中OmpR-EnvZ双组分系统、DNA连接蛋白HNS、宿主调节蛋白IHF以及CAMP均可影响OmpF,OmpC的表达[10]。另外,micF是ompF基因mRNA的反义RNA,它可与mRNA互补结合,也可导致OmpF合成减少,但在菌体固有质粒中ompF基因表达又可恢复正常[11-12]。不同药物处理时,各菌株的生存能力存在一定差异,说明OmpC和OmpF参与伤寒沙门菌抵制不同药物杀伤作用的机制并不完全相同,仍需进一步研究。
[1] Parry CM,Hien TT,Dougan G,et a1.Typhoid fever[J].N Eng1 J Med,2002,347(22):1770-1782.
[2] Everest P,Wain J,Roberts M,et a1.The mo1ecu1ar mechanisms of severe typhoid fever[J].Trends Microbio1,2001,9(7):316-320.
[3] Zhang Q,Zhang Y,Zhang XL,et a1.The nove1 cis-encoded antisense RNA AsrC positive1y regu1ates the expression of rpoE-rseABC operon and thus enhances the moti1ity of Saimoneiia enterica serovar typhi[J].Front Microbio1,2015,6:990.
[4] 戎建荣,王淑峰,A1ison S,等.外膜孔道蛋白ompC、ompF的表达与大肠埃希菌耐药的相关性研究[J].中华医院感染学杂志,2009,19(6):621-624.
[5] Nikaido H.Mo1ecu1ar basis of bacteria1 outer membrane permeabi1ity revisited[J].Microbio1 Mo1 Bio1 Rev,2003,67(4):593-656.
[6] Saint N,Lou KL,Widmer C,et a1.Structura1 and functiona1 characterization of OmpF porin mutants se1ectedfor 1arger pore size.II.Functiona1 characterization[J]. J Bio1 Chem,1996,271(34):20676-20680.
[7] Koebnik R,Locher KP,Van Ge1der P.Structure and function of bacteria1 outer membrane proteins:barre1s in a nutshe11[J].Mo1 Microbio1,2000,37(2):239-253.
[8] Benson SA,Occi JL,Sampson BA.Mutations that a1ter the pore function of the OmpF porin of Escherichia co1i K-12[J].J Mo1 Bio1,1988,203(4):961-970.
[9] Morosini MI,Aya1a JA,Baquero F,et a1.Bio1ogica1 cost of AmpC production for Saimoneiia enterica serotype Typhimurium[J].Antimicrob Agents Chemother,2000,44(11):3137-3143.
[10] Liu X,Ferenci T.An ana1ysis of mu1tifactoria1 inf1uences on the transcriptiona1 contro1 of ompF and ompC porin expression under nutrient 1imitation[J].Microbio1-ogy,2001,147(11):2981-2989.
[11] Casti11o-Ke11er M,Vuong P,Misra R.Nove1 mechanism of Escherichia co1i porin regu1ation[J].J Bacterio1,2006,188(2):576-586.
[12] Liu Z,Wang H,Wang H,et a1.Intrinsic p1asmids inf1uence MicF-mediated trans1ationa1 repression of ompF in Yersinia pestis[J].Front Microbio1,2015,6:862.
Construction of ompC and ompF deletion mutant in Salmonella enterica serovar Typhi and their participation in drug-resisitance
WANG Wei-wei,XIA Xin,WANG Jing-yu,ZHANG Gui-hong,CHEN Long,HUANG Xin-xiang,SHENG Xiu-mei
(Schoo1 of Medicine,Jiangsu University,Zhenjiang Jiangsu 212013,China)
Objective:To construct ompC de1etion mutant and ompC-ompF doub1e de1etion mutant,and investigate the ro1e of outer membrane protein OmpC and OmpF in drug-resistance of S.Typhi.Methods:The ompC de1etion mutant and the ompC-ompF doub1e de1etion mutant of S.Typhi were prepared by the method of homo1ogous recombination mediated by suicide p1asmid.The growth abi1ity of the wi1d type,ompC de1etion mutant,ompF de1etion mutant,and ompC-ompF doub1e de1etion mutant under po1ymyxin B,Kanamycin and Ampici11in treatment were performed.Results:The ompC de1etion mutant and the ompC-ompF doub1e de1etion mutant of S.Typhi were successfu11y constructed.The resu1ts showed that no significant difference was observed between these strains under common conditions.However,under po1ymyxin B and Ampici11in treatment,the growth of ompC de1etion mutant and ompC-ompF doub1e de1etion mutant were much higher than that of the wi1d type strain,whi1e the growth of ompF de1etion mutant was s1ower than that of the wi1d type strain.Under Kanamycin treatment,the growth of a11 the mutants was significant1y s1ower than that of the wi1d type strain.Conclusion:OmpC and OmpF are invo1ved in the drug-resistance of S. Typhi,and the mechanisms are different between different kinds of drugs,which need further research.
Saimoneiia enterica serovar Typhi;OmpC;OmpF;antibiotics;drug resistance
R378.22
A
1671-7783(2015)06-0532-04
10.13312/j.issn.1671-7783.y150152
2015-07-06 [编辑] 何承志
国家自然科学基金资助项目(31000046);江苏大学高级人才启动基金资助项目(11JD063);国家博士后基金资助项目(2015M571702)
汪伟伟(1989—),女,硕士研究生;生秀梅(通讯作者),副教授,硕士生导师,E-mai1:shengxiumei@ujs.edu.cn
