PAS三联疗法对老年急性脑梗死患者血清高迁移率族蛋白B1、骨保护素及巨噬细胞移动抑制因子水平的影响
2015-11-20吴振宏欧阳强梁俭孙广西民族医院神经内科广西南宁530001
吴振宏 欧阳强 梁俭孙 (广西民族医院神经内科,广西 南宁 530001)
急性脑梗死(ACI)是严重威胁老年患者身体健康的常见病、多发病,其发病率、病死率及病残率均较高,其主要病因为动脉粥样硬化(AS),在此基础上,颈动脉易损斑块突然溃疡或破裂、血小板激活是ACI重要的发病机制〔1〕。目前学术界关于PAS三联疗法(普罗布考、阿司匹林、他汀类药物)对ACI患者血清炎性因子水平的影响方面的报道不太多,本文探讨ACI患者血清高迁移率族蛋白(HMG)B1、骨保护素(OPG)及巨噬细胞移动抑制因子(MIF)水平的变化并观察PAS三联疗法对其干预作用。
1 资料与方法
1.1 诊断及排除标准〔2〕诊断标准参照《中国急性缺血性脑卒中诊治指南》的诊断标准,经头部CT和(或)MRI确诊,均为ACI。排除标准:①患者有严重肝肾疾病、2型糖尿病、血液病、自身免疫疾病、甲状腺疾病、结核以及恶性肿瘤。②无症状性脑梗死、心源性脑栓塞、梗死后出血和脑出血。③严重室性心律失常或心功能衰竭,服用了延长心电图Q-T间期的药物。④溶栓治疗、最近4 w严重感染、近4 w内服用降脂药物、妊娠、近期有消化道溃疡出血。⑤对本观察用的阿托伐他汀、普罗布考和阿司匹林不依从、不耐受。
1.2 一般资料 选取我院2010年1月至2012年12月神经内科的住院患者共150例,将颈动脉斑块呈高回声的纳入稳定斑块组,颈动脉呈低回声的纳入易损斑块组〔3〕。其中,稳定斑块组患者50例,易损斑块患者100例。按随机数字表法将易损斑块患者分为AS组和PAS组,AS组男26例,女24例,年龄61~79〔平均(67.8±6.9)〕岁。PAS组男25例,女25例,年龄62~78〔平均(68.6±7.1)〕岁。将稳定斑块患者设为对照组,男27例,女23例,年龄60~82〔平均(68.9±7.9)〕岁。三组患者年龄、性别差异无统计学意义(P>0.05),具有可比性。
1.3 治疗方法 3组患者(包括对照组、AS组和PAS组)均采用对症治疗,运用维生素E、C及调控血压、脱水治疗。对照组加用阿司匹林(100 mg/d)、阿托伐他汀钙(商品名:立普妥,辉瑞制药,10 mg/晚,口服);AS组采用阿司匹林(100 mg/d)、阿托伐他汀钙(辉瑞制药,20 mg/晚,口服);PAS组在AS组基础上加用普罗布考(齐鲁制药,0.25 g/次,2次/d,口服),所有患者均连服用12个月。治疗期间不用其他调脂及抗氧化药物,同时放弃吸烟、酗酒等不良生活方式。
1.4 检测方法 患者在治疗前即入院1 d后抽取清晨空腹肘静脉血,检测血脂、血尿大便常规及肝肾功能心肌酶学。颈动脉超声检查:由超声科的专家采用飞利浦IU22型大型多功能彩色大多普勒诊断仪进行操作,其探头中心频率为10 MHz。采用ELISA法测定血清HMGB1、OPG和MIF含量,具体操作严格按照说明书进行,HMGB1、MIF、OPG血清水平检测试剂盒是由武汉博士德生物工程有限公司生产。
1.5 观察指标 观察患者的一般指征,包括收缩压(SBP)、舒张压(DBP)、空腹血糖(FPG)、体重指数(BMI)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)。检测治疗前后血清因子HMGB1、OPG和MIF水平及变化情况,1年后随访PAS组和AS组斑块消失的情况,同时观察各组的不良反应。
1.6 统计学方法 采用SPSS16.0统计学软件进行t检验、方差分析及χ2检验。
2 结果
2.1 三组患者一般指征比较 3组患者一般指征无统计学差异(P均>0.05)。见表1。
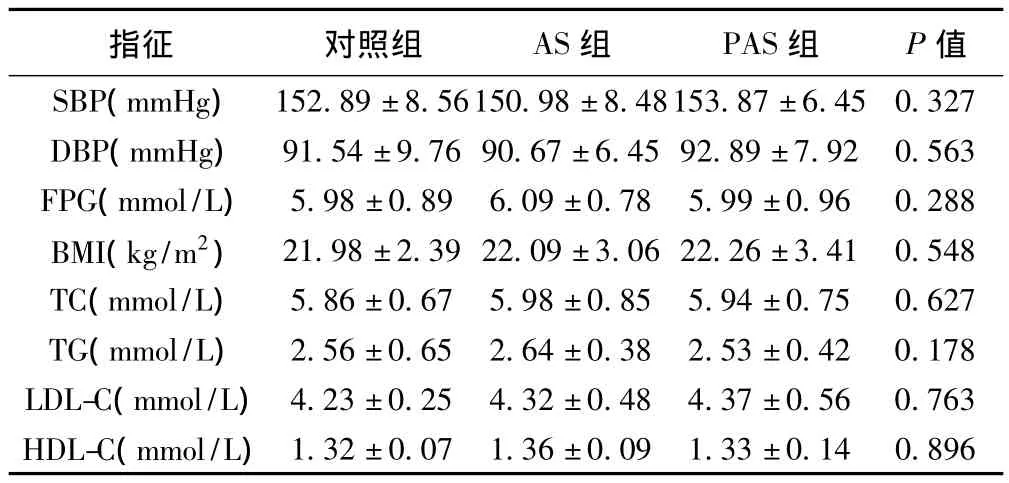
表1 三组患者一般指征情况比较(x ± s,n=50)
2.2 三组患者治疗前后血清因子HMGB1、OPG和MIF水平治疗前AS组、PAS组与对照组血清因子水平差异显著(P<0.05),AS组与PAS组无显著差异(P>0.05);治疗后AS组和PAS组与治疗前均有显著差异(P<0.01);且PAS组与AS组也有显著差异(P<0.05)。见表2。
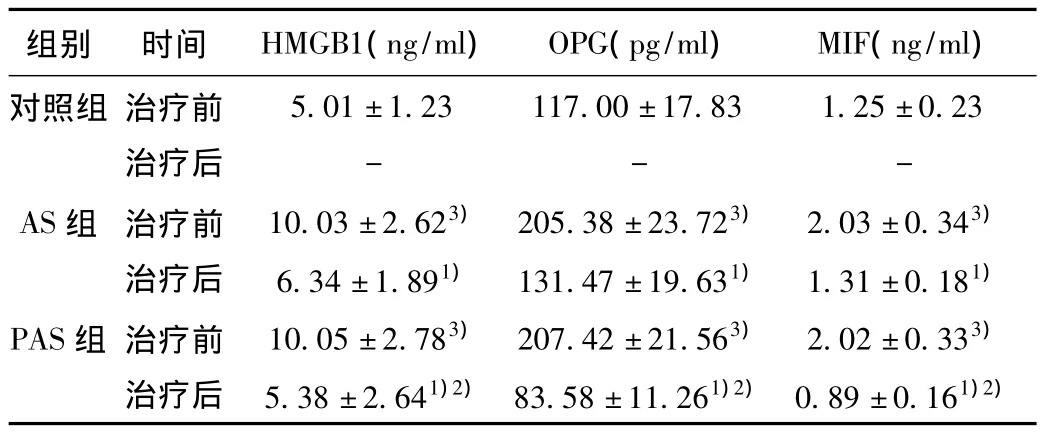
表2 三组患者治疗前后血清因子HMGB1、OPG和MIF水平比较(x ± s,n=50)
2.3 AS组与PAS组治疗后斑块数量情况 治疗1年后AS组斑块消失数为3例(6%),与PAS组〔14例(28%)〕比较差异显著(P<0.01)。
2.4 不良反应比较 PAS组有6例患者在治疗1 w左右出现转氨酶轻度升高,而AS组有4例,后复查时正常;PAS组和AS组均有3例患者出现消化道的不良反应。后经对症治疗后缓解,三组均未出现严重的不良反应。随访肾功能均正常,没有出现无力、发热、肌痛的症状。
3 讨论
ACI是造成老年人致残和致死的重要疾病之一,积极干预动脉粥样硬化形成是预防缺血性脑卒中发生的重要措施。国外有研究结果显示:即使按照指南要求积极干预危险因素,仍有近60%患者的颈动脉粥样硬化斑块在进展。因而提出了以动脉粥样硬化斑块为靶目标的强化治疗理念〔4〕。如何有效地积极干预AS斑块的形成,预防斑块的破裂是缺血性脑卒中治疗的重点和难点。许多炎性细胞因子均参与了AS的产生和进展〔5〕。如何使用药物提高斑块的稳定性和逆转斑块是目前治疗的热点,也是难点。有学者研究发现,PAS三联疗法可明显降低冠心病患者颈动脉内中膜厚度(IMT)值及斑块厚度〔6〕。普罗布考是目前应用广泛的一种抗氧化剂和抗炎药物,可显著减低颈动脉IMT值和缩小斑块面积,具有提高HDL-C水平和阻断动脉粥样硬化进展的作用。它还可显著抑制ox-LDL的产生和阻止巨噬细胞向斑块内浸润,抑制斑块内细胞凋亡,降低基质金属蛋白酶-2(MMP-2)、基质金属蛋白酶-9(MMP-9)、组织蛋白酶-K和组织蛋白酶的产生,抑制细胞外基质成分的降解,从而阻止动脉粥样硬化的进展〔7〕。目前已有研究证实,阿托伐他汀具有降低MMPs活性的作用〔8〕,阿司匹林有明显降低患者血糖水平、提高糖耐量和对胰岛素敏感性的能力,能阻止凝血素在体内合成。而普罗布考可降低病变部位巨噬细胞沉积,可抑制和稳定动脉粥样硬化斑块,具有减轻全身炎症反应,防止斑块进展和破裂的作用〔9〕。
OPG是肿瘤坏死因子受体家族成员之一,在血管钙化和AS中对内皮细胞和平滑肌细胞发挥自分泌和旁分泌作用,对血管起保护作用。在AS形成过程中,许多炎性因子都能上调OPG在血管平滑肌和内皮细胞内的表达,OPG表达越高〔10〕。国外有研究发现,大动脉粥样硬化型卒中患者血清OPG浓度明显高于小动脉粥样硬化型卒中和正常组患者,证实OPG参与了AS血栓形成所致的卒中发病机制〔11〕。HMGB1是一种晚期炎性因子,它可通过促进巨噬细胞迁移,它可介导炎症免疫反应的发展,促进各种炎性因子的释放,促进免疫细胞和血管平滑肌细胞。MIF可广泛表达于巨噬细胞,可由激活T淋巴细胞产生和巨噬细胞,存在于血管内皮细胞、皮肤表皮细胞、血管内皮细胞等各种细胞组织中。MIF除可促进体内的巨噬细胞抑制其游走外,向斑块部位聚集、还可促进炎症细胞在斑块内局部增生炎性细胞因子,如肿瘤坏死因子-α、白细胞介素-1等来加剧血管壁的炎症反应〔12〕。本文说明PAS三联疗法优于AS疗法,可更快降低血清炎性因子-HMGB1,OPG和MIF的水平,可提高易损斑块的稳定性。此外,药物的不良反应和有效性了是临床上观察的重点。本次观察的患者中,PAS组有6例患者在治疗1 w左右出现转氨酶轻度升高,而AS组有4例,后经过复查时正常:对症治疗后缓解,没有出现严重的不良反应。肾功能均能保持良好状态,无出现无力、肌痛、发热等症状。但由于本研究的样本不大,这就需要后续的研究进一步扩大样本量,进行更深入的研究。
总之,PAS三联疗法是一种安全性相对良好的治疗方法,本文显示血清HMGB1、MIF及OPG都参与了ACI患者AS的进化过程,三联疗法可更有效地快速降低血清因子HMGB1、OPG和MIF的水平,可作为评估颈动脉粥样硬化斑块稳定性的可靠预测因子,可提高易损斑块的稳定性,但血清ox-LDL,PAPP-A水平的变化及不良反应等研究还需要后继的学者做更深入的工作。
1 孟晓萍,王素香,张基昌,等.普罗布考联合降脂药物对动脉粥样硬化病人的干预治疗〔J〕.中华医学杂志,2009;89(28):1986-8.
2 中华医学会神经病学分会脑血管病学组急性缺血性脑卒中诊治指南撰写组.中国急性缺血性脑卒中诊治指南2010.中华神经科杂志,2010;43(2):146-53.
3 Ding S,Zhang M,Zhao Y,et al.The role of carotid plaque vulnerability and inflammation in the pathogenesis of acute ischemic stroke〔J〕.Am J Med Sci,2008;336(1):27-31.
4 Okamoto T,Atsumi T,Shimizu C,et al.The potential role of macrophage migration inhibitory factor on the migration of vascular smooth muscle cells〔J〕.J Atheroscler Thromb,2008;15(1):13-9.
5 Guldiken B,Guldiken S,Turgut B,et al.Serum osteoprotegerin levels in patients with acute atherothrombotic stroke and lacunar infarct〔J〕.Thromb Res,2007;120(4):511-6.
6 王素香,王拥军,尹洪超,等.PAS综合疗法对兔动脉粥样硬化病变N-FN〔J〕. 中国动脉硬化杂志,2008;16(8):628-32.
7 Nasr N,RuidaVets JB,Farghali A,et al.Lipoprotein(a)and carotidatherosclemsis in young patients with stroke〔J〕.Stroke,2011;42(12):3616-8.
8 Xie P,Cao YS,Su P,et al.Expression of toll-like receptor 4,tumor necrosis factor-alpha,matrix metalloproteinase-9 and effects of benazepril in patients with acute coronary syndromes〔J〕.Clin Med Insights Cardiol,2010;20(4):89-93.
9 Palazzuoli A,Rizzello V,Calabrò A,et al.Osteoprotegerin and B-type natriuretic peptide in non-ST elevation acute coronary syndromes:relation to coronary artery narrowing and plaques number〔J〕.Clin Chim Acta,2008;91(1-2):74-9.
10 Yamashita T,Hirata K.Anti-inflammatory and immune modulation therapy against atherosclerosis〔J〕.Nippon Rinsho,2011;69(1):168-72.
11 Abedin M,Omland T,Ueland T,et al.Relation of osteoprotegerin tocoronary calcium and aortic plaque(from the Dallas Heart Study)〔J〕.Am J Cardiol,2007;99(4):513-8.
12 Koba S,HiraIlo T.Dyslipidemia and atherosclerosis〔J〕.Nipponl,2011;69(1):138-43.
