莫西沙星对耐药葡萄球菌生物膜体外药效学研究
2015-11-20姜剑伟陈向东王素霞
姜剑伟,陈向东,汪 辉,李 魁,范 璐,王素霞
中国药科大学 生命科学与技术学院 微生物教研室,南京 210009
细菌生物膜(bacterial biofilms)是微生物分泌的胞外多聚基质将自身覆盖而形成的微生物聚集体结构,是相对于浮游菌而言的一种自我保护性生长模式,能有效促进微生物粘附于固相物表面,使微生物对抗生素的敏感性降低,还可使其逃逸机体的免疫系统,是临床中引起持续慢性感染疾病的最主要原因之一[1-3]。葡萄球菌是社区性感染和医院获得性感染的最主要致病菌之一,其导致的感染发病率逐年增加,尤其是耐甲氧西林表皮葡萄球菌(methicillin resistant Staphylococcus epidermidis,MRSE)和耐甲氧西林金黄色葡萄球菌(methicillin resistant Staphylococcus aureus,MRSA)的感染已成为全球性问题[4]。MRSE和MRSA引起的治疗难度加大的一部分原因是与其形成生物膜有关。本实验探究了新一类氟喹诺酮类化学治疗药莫西沙星对4株临床分离的耐药葡萄球菌生物膜的体外活性,以及该药与局部用药瑞他帕林(retapamulin)的体外联合应用的效果。
1 材 料
1.1 菌株
临床分离产生物膜耐药菌株4株(MRSE12、MRSE19、MRSA45、MRSA53)、 质控菌株金黄色葡萄球菌ATCC 29213均由中国药科大学微生物教研室提供。
1.2 药品与试剂
莫西沙星(拜耳医药保健有限公司);瑞他帕林(北京世纪迈劲生物科技有限公司);结晶紫(天津化学试剂研究所);冰乙酸 (南京化学试剂有限公司);无水甲醇(江苏汉邦科技有限公司生产);无水乙醇、氯化钠(国药集团化学试剂有限公司);胰酪胨大豆肉汤培养基、胰酪胨大豆琼脂培养基、MH肉汤培养基、MH琼脂培养基,均购自北京三药科技开发公司。
1.3 主要仪器
高压灭菌锅 (日本Hirayma仪器有限公司);GHX-9080B-1恒温培养箱 (上海福玛实验设备有限公司);酶标仪(美国伯乐有限公司公司);超声仪(昆山禾创超声仪器有限公司);96孔板(康宁公司)。
2 方 法
2.1 体外抗浮游菌活性测定
采用2012版美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)推荐的微量肉汤稀释法测定MIC。采用倍比稀释法制备不同浓度药液,使96孔板中的药物终浓度为0.03、0.06、0.125、0.25、0.5、1、2、4、8、16、32、64、128 mg·L-1,质控菌株为ATCC 29213,每孔菌液终浓度为105cfu·mL-1,37℃培养 18 h,观察结果。 肉眼未见浑浊的最低药物浓度即为最低抑菌浓度(MIC)[5]。
2.2 体外抗生物膜活性测定
本实验所选用的4株耐药葡萄球菌经刚果红平板法以及生物膜半定量法确定为产细菌生物膜菌株[6-7]。接菌于含1%葡萄糖的胰酪胨大豆肉汤培养基(TSBG)中,过夜培养,调菌浓度至约 1×107cfu·mL-1,取菌液200 μL加入到96孔板中,37℃孵育24 h,用生理盐水洗涤3次除去浮游菌后,制备体外细菌生物膜模型。加入200 μL含系列浓度药物的MH肉汤,37℃培养24h,观察结果。肉眼未见浑浊的最低药物浓度即为最低抑制生物膜浓度(MBIC)[8]。
测定MBIC后,对肉眼观察无浑浊的孔中,弃去含有药物的MH肉汤,用生理盐水洗涤3次,加入200μL的无药物的MH肉汤,37℃继续孵育20~24h,观察完全摧毁生物膜的最低药物浓度(MBEC),即肉眼观察仍未浑浊的最低药物浓度[9-10]。
2.3 莫西沙星对生物膜形成量的影响[5,7]
96孔板体外制备细菌生物膜模型后,加入含药物的 TSBG,使药物终浓度分别为 2×MIC、4×MIC、8×MIC和16×MIC,空白对照为不含药物的肉汤培养基,每株菌重复4孔,37℃培养24 h。采用生物膜半定量法进行测定:弃去培养物,用200 μL生理盐水每孔洗涤3次,每孔加入200 μL 99%的甲醇固定15 min后,每孔再加入0.2 mL用20%乙醇配制的2%(w/v)结晶紫,染色5 min,用流水冲去未附着的结晶紫。室温干燥后,加入160 μL的33%(v/v)的冰乙酸在室温下静置1 h进行复溶,用酶标仪测定A570。不同药物浓度下,细菌生物膜形成百分比(the percentages of biofilm formed)计算公式如下:
P=(A/A0)×100%
A为药物处理孔的吸光值;A0为空白对照孔的吸光值
2.4 对生物膜存活菌的影响
96孔板体外制备细菌生物膜模型后,加入含有药物的TSBG,药物终浓度分别为2、10、50和100倍MIC,空白为不含药物的TSBG。培养24 h后,弃去液体培养物,用生理盐水洗涤3次后,加入200 μL TSBG,用枪头刮下孔壁和底部的生物膜,40 kHz超声 5 min,取 100 μL 进行活菌计数[9,11]。
2.5 与瑞他帕林联合抗生物膜作用
生物膜协同试验采用微量稀释棋盘法(microdilution checkerboard method)。体外制备细菌生物膜,加入160 μL MH肉汤后,加入20 μL系列梯度浓度的莫西沙星和20 μL瑞他帕林。2种药物在孔中的终浓度为 0.0078~64 mg·L-1,37 ℃培养 24 h,测定两种药物的联合抗生物膜分数(MBIC)。计算瑞他帕林-莫西沙星对4株葡萄球菌的FBICs。FBIC计算公式如下:

A:药物 A;B:药物 B;c:联用用药;a:单独用药
FBIC≤0.5,A、B 两药协同;0.5<FBIC≤1,A、B两药部分协同;1<FBIC≤4,A、B 两药无关;FBIC>4,A、B 两药拮抗[12]。
3 结 果
3.1 体外抗浮游菌活性测定
莫西沙星、瑞他帕林对4株临床耐药葡萄球菌的MIC测定结果见表1。

表1 2种抗生素对4株葡萄球菌的MIC的测定结果/mg·L-1
3.2 MBIC和MBEC测定结果
莫西沙星、瑞他帕林的MBIC、MBEC的测定结果见表2。莫西沙星对4株临床耐药葡萄球菌的MBIC 范围为 0.25~2 mg·L-1,为 MIC 的 1~4 倍;瑞他帕林的 MBIC 范围为 0.25~0.5 mg·L-1,为 MIC 的 1~2倍。莫西沙星的MBEC范围是16~256mg·L-1,为MIC的 64~4096倍;瑞他帕林的 MBEC 为 64~>128 mg·L-1,为 MIC的 256~>512倍。 莫西沙星对 MRSE12、MRSE19、MRSA53的 MBEC 是 MIC 的 64~512倍,对MRSA45的MBEC约为MIC的4000倍。瑞他帕林对 MRSE12、MRSE19、MRSA53 的 MBEC 是 MIC的256倍,对MRSA45的MBEC是大于512倍MIC。
3.3 药物对生物膜形成百分比的影响
药物对MRSE12生物膜形成百分比的结果见图1(A),对MRSA45生物膜形成百分比的结果见图1(B)。莫西沙星和瑞他帕林都在2×MIC显著降低生物膜的形成量。对MRSE12,莫西沙星和瑞他帕林的药物浓度增加对生物膜形成的影响不明显,分别约为41%和35%;而对MRSA45,莫西沙星对生物膜形成的抑制呈浓度依赖性,但在8×MIC、16×MIC时,生物膜形成百分比都约为26%;瑞他帕林浓度对生物膜形成的影响不明显,生物膜形成百分比都约为18%。
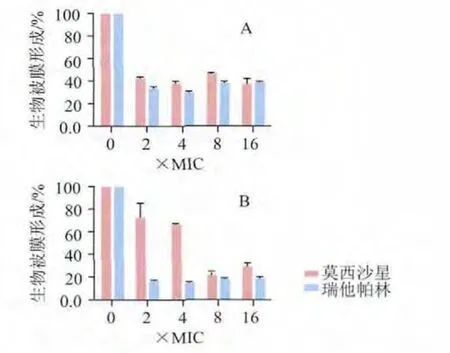
图1 药物在2、4、8、16倍MIC浓度作用下对MRSE12( A)和 MRSA45( B)生物膜形成量百分比
3.4 对生物膜存活菌的影响
莫西沙星对生物膜存活菌的影响见表3。对MRSE12,莫西沙星在2×MIC时,存活菌数显著降低, 在 10×MIC、50×MIC 和 100×MIC 作用下的存活菌数趋于一致,约为4.57 log10cfu·mL-1;对 MRSA45,莫西沙星在50×MIC时,存活菌数明显降低,在50×MIC、100×MIC作用下的存活菌数相似,约为5.56 log10cfu·mL-1。 莫西沙星在 100×MIC作用 24 h后,MRSE12和MRSA45的生物膜存活数明显降低了 1.92、1.40 log10cfu·mL-1。

表3 莫西沙星对MRSE12和MRSA45生物膜的影响
3.5 与瑞他帕林联合抗生物膜作用
莫西沙星与局部抗生素瑞他帕林对MRSE12、MRSE19、MRSA45、MRSA53 的 FBICs 都 小 于 1.0,分别为0.75、0.56、0.36和0.75,可见莫西沙星与瑞他帕林在体外进行联合用药时表现出协同作用和部分协同作用,无拮抗作用。
4 讨 论
莫西沙星和瑞他帕林对4株临床耐药葡萄球菌的MBIC为MIC的1~4倍,则两种药物对葡萄球菌生物膜都有很好地抑制作用。MBEC代表完全摧毁生物膜的最低药物浓度,莫西沙星对MRSA45的MBEC大于4000倍的MIC,推测MRSA45可能为强生物膜菌,明显降低了药物的渗透性,增加了对药物的耐药性。因此,莫西沙星摧毁耐药葡萄球菌生物膜的作用强弱具有菌株特异性,可能与菌株的生物膜形成能力强弱有关。
莫西沙星和瑞他帕林都可降低葡萄球菌生物膜形成量,可见两种药物都能抑制生物膜的形成。但在一定药物浓度范围(2~16)×MIC内,生物膜的形成量与药物浓度无关,可能是生物膜降低了药物的渗透性。然而,生物膜检测的96孔半定量法只能反映生物膜的总量,不能确定其中的存活菌数。因此,需要通过活菌计数来确定药物对生物膜存活菌的影响。结果发现,莫西沙星在100×MIC时可明显降低生物膜中存活菌数。当药物浓度范围在 (10~100)×MIC时,药物浓度对生物膜存活菌数影响不明显,推测药物在这个浓度范围内,生物膜降低了药物的渗透性,使高浓度药物表现出低浓度的杀菌效果[11]。生物膜最后在MBEC的作用下被完全摧毁,说明生物膜对莫西沙星存在一个较大的耐受浓度范围。
局部抗生素瑞他帕林在局部损伤部位可达到较高药物浓度,其软膏可使药物保持高浓度状态,所以能有效阻止和治疗局部感染[13]。瑞他帕林通过抑制肽酰转移酶的活性来杀灭微生物,与莫西沙星抑制DNA解旋酶和拓扑异构酶Ⅳ的作用机制不同[14-15]。因而测定莫西沙星和瑞他帕林的联合抗生物膜作用,实验结果证实,两者药效学方面相互作用为协同作用。因此,可以考虑莫西沙星与局部用药瑞他帕林一起联合用于治疗局部葡萄球菌生物膜相关感染。
综上所述,体外研究证明莫西沙星对临床耐药葡萄球菌生物膜活性具有抑制和摧毁作用,而且与局部用药瑞他帕林具有协同作用,两者可以进行联合用药。
[1]Black CE,Costerton JW.Current concepts regarding the effect of wound microbial ecology and biofilms on wound healing[J].Surg Clin N Am,2010,90(6):1147-60.
[2]Nuryastuti T,Krom BP,Aman AT,et al.Ica-expression and gentamicin susceptibility ofStaphylococcus epidermidis biofilm on orthopedic implant biomaterials[J].J Biomed Mater Res,2011,96A(2):365-71.
[3]Costerton JW,Stewart PS,Greenberg EP.Bacterial biobilms:a common cause of persistent infections[J].Science,1999,284(5418):1318-22
[4]Al-Shuneigat J,Cox SD,Markham JL.Effects of a topical essential oil-containing formulation on biofilmforming coagulase-negative staphylococci[J].Lett Appl Microbiol,2005,41(1):52-5.
[5]Roveta S,Schito AM,Marchese A,et al.Activity of moxifloxacin on biofilms produced in vitro by bacterial pathogens involved in acute exacerbations of chronic bronchitis[J].Int J Antimicrob Agents,2007,30(5):415-21.
[6]Arciola CR,Campoccia D,Gamberini S,et al.Detection of slime production by means of an optimised Congo red agar plate test based on a colourimetric scale in Staphylococcusepidermidisclinicalisolates genotyped for ica locus[J].Biomaterials,2002,23(21):4233-9.
[7]Stepanovic S,Vukovic D,Dakic I,et al.A modified microtiter-plate test for quantification of staphylococcal biofilm formation[J].J Microbiol Meth,2000,40(2):175-9.
[8]Labthavikul P,Petersen PJ,Bradford PA.In vitro activity of tigecycline against Staphylococcus epidermidis growing in an adherent-cell biofilm model[J].Antimicrob Agents Chemother,2003,47(12):3967-9.
[9]Cafiso V,Bertuccio T,Spina D,et al.Tigecycline inhibition ofamature biofilm in clinicalisolatesof Staphylococcus aureus:comparison with other drugs[J].FEMS Immunol Med Microbiol,2010,59(3):466-9.
[10]Reiter KC,Villa B,Paim TG,et al.Inhibition of biofilm maturation by linezolid in meticillin-resistant Staphylococcus epidermidis clinical isolates:comparison with other drugs[J].J Med Microbiol,2013,62(3):394-9.
[11]Pérez-Giraldo C,Gonzalez-Velasco C,Sánchez-Silos RM,et al.Moxifloxacin and biofilm production by coagulase-negative Staphylococci[J].Chemotherapy,2004,50(2):101-4.
[12]Kádár B,Szász M,Kristóf K,et al.In vitro activity of clarithromycin in combination with other antimicrobial agents against biofilm-forming Pseudomonas Aeruginosa strains[J].Acta Microbiol et Imm H,2010,57(3):235-45.
[13]Lipsky BA,Hoey C.Topical antimicrobial therapy for treating chronic wounds[J].Clin Infect Dis,2009,49(10):1541-9.
[14]Poulsen SM,Karlsson M,Johansson LB,et al.The pleuromutilin drugs tiamulin and valnemulin bind to the RNA at the peptidyl transferase centre on the ribosome[J].Mol Microbiol,2001,41(5):1091-9.
[15]Pestova E,Millichap JJ,Noskin GA,et al.Intracellular targets of moxifloxacin:a comparison with other fluoroquinolones[J].J Antimicrob Chemoth,2000,45(5):583-90.
