高内涵筛选结合活细胞实时成像技术分析谷氨酸诱导的小鼠神经瘤母细胞N2a凋亡
2015-11-19崔士超胡捷先陈献华
乔 可 崔士超 胡捷先 陈献华
(1复旦大学基础医学院医学分子病毒学教育部/卫生部重点实验室,2医学神经生物学国家重点实验室 上海 200032)
谷氨酸是中枢神经系统内一种重要的兴奋性神经递质,在突触可塑性和介导突触兴奋性活动等方面发挥着重要的作用,对脑内神经元生长发育、分化、迁移、成熟、修复等具有重要的影响[1]。但在病理情况下,过多谷氨酸积聚可导致谷氨酸受体的过度激活引起钙超载,从而激活神经毒性信号转导途径,最后导致细胞凋亡和坏死。目前认为谷氨酸兴奋毒性与多种神经元退行性疾病的神经元丢失有关,包括阿尔茨海默病、帕金森综合征、亨廷顿氏疾病、多发性硬化症等[2-3]。研究证实,谷氨酸诱导的神经元凋亡模型具有良好的可重复性,可作为研究神经元凋亡的可靠实验模型[4-5]。因此,建立和评价谷氨酸诱导的神经细胞损伤模型,对研究神经损伤和退行性疾病有重要意义。
高内涵筛选(high-content screening,HCS)分析系统是利用显微成像及图像分析技术,在细胞结构和功能完整的条件下,实时快速检测样品多维立体的生物效应信息,在单个细胞/亚细胞水平获取样品生物学变化的多元化数据,包括单细胞图像和各项指标、细胞群体的统计分析结果、细胞数量和形态改变、亚细胞结构变化、荧光信号随时间和空间的变化等[6-7]。该分析系统不仅能够像传统流式细胞仪那样进行群体分析,而且还可以对群体分析中具有特定数值特征的细胞进行形态观察和数值检测。神经瘤母细胞N2a是小鼠神经外胚层来源的细胞,因其易于转染并大量表达微管蛋白等特点,在神经细胞分化、轴突生长及信号通路领域被广泛应用[8]。
本实验利用HCS技术,分析不同浓度谷氨酸诱导的N2a细胞凋亡比例;并结合活细胞实时成像技术,跟踪谷氨酸诱导不同时间下的N2a凋亡的形态学变化特征以及N2a凋亡过程的各项指标,包括凋亡过程中细胞核的凝缩过程以及细胞核碎片化的过程。
材料和方法
仪器和试剂 HCS分析系统(Perkin Elmer Operetta);Annexin V-FITC/PI试剂盒(BD),Hoechst 33342(Sigma),NucRed Live 647(Life Technologies);二氧化碳培养箱(Fisher Scientific)。
细胞培养 N2a细胞在含10%胎牛血清(FBS)的MEM培养基(Gibco)中通气培养(37℃、5%CO2)。每3天以0.05%胰酶消化,按1∶5的比例传代。
谷氨酸处理细胞 将细胞接种于96孔板,每孔含100μL培养液,培养36 h后每孔加入不同浓度谷氨酸(250、500、750、1 000μg/mL)处理24 h,对照孔不加谷氨酸。
细胞荧光标记 谷氨酸处理24 h后,96孔板每孔100μL细胞培养基中加入1μL Annexin VFITC、1μL PI、1μL Hoechst 33342,轻轻混匀置于37℃、5%CO2培养箱中,孵育30 min后置于HCS系统。细胞凋亡形态实时追踪选择谷氨酸浓度750μg/mL处理20 h的N2a细胞,用NucRed Live 647和Annexin V-FITC标记。
图像获取、处理和数据分析 分别使用60×、20×、40×物镜(LWD),每孔选取10个视野分FITC、PI和Hoechst 33342等3个荧光通道拍摄图片,荧光光源为250 W连续氙灯。恒温37℃、5%CO2下连续拍摄活细胞实时成像图片。每隔0.5 h拍摄FITC和NucRed Live 647等2个荧光通道图片,连续采集记录6 h Time-lapse图像,从T0~T12。同时启动系统远红外激光自动对焦功能,防止长时间拍摄过程中焦点的漂移和维持焦平面稳定。
使用HCS系统Operetta中的Columbus软件来获取图像,并对图像进行参数调整以及生成显微缩时序列图,通过Hoechst 33342或NucRed Live 647找到细胞核,分别计算细胞总数、FITC荧光强度和早期凋亡细胞比例、胞核NucRed Live 647荧光染色面积以及荧光强度变异系数(coefficient of variation,CV),CV=(标准差÷平均值)×100%。对于谷氨酸对N2a细胞凋亡的影响和谷氨酸诱导N2a细胞凋亡的形态学动态追踪,各重复3次独立实验,每孔统计的细胞总数为417~1 176个,使用Excel结合SigmaPlot软件计算±s并作二维折线图。组间差异比较采用t检验,P<0.05为差异有统计学意义。
结 果
谷氨酸对N2a细胞凋亡的影响 在N2a细胞凋亡的检测中,Hoechst 33342标记细胞核(蓝色),Annexin V-FITC标记胞膜上外翻的磷脂酰丝氨酸(绿色),PI标记胞膜完整性被破坏的凋亡晚期细胞或坏死细胞的胞核(红色)。于谷氨酸处理24 h后,在细胞培养液中加入上述染色剂,利用HCS技术捕捉和分析细胞凋亡不同阶段的特征,并统计不同浓度谷氨酸诱导的N2a细胞发生早期凋亡的比例。
谷氨酸诱导的N2a细胞凋亡在不同阶段的特征 谷氨酸处理N2a细胞24 h后,利用HCS技术可以捕捉到细胞凋亡在不同阶段的特征。其中,未发生凋亡的细胞仅胞核被Hoechst 33342染色(蓝色)(图1A);细胞凋亡早期胞核被 Hoechst 33342染色(蓝色),胞膜被 AnnexinV-FITC染色(绿色)(图1B);细胞凋亡中晚期胞核同时被 Hoechst 33342(蓝色)和PI(红色)染色,胞膜被AnnexinVFITC染色(绿色)(图1C、D)。
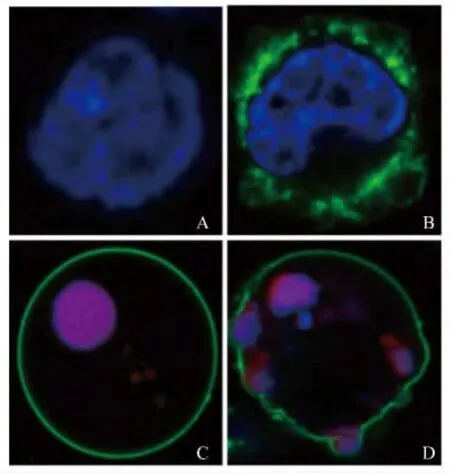
图1 谷氨酸诱导的N2a细胞凋亡在不同阶段的特征图像(×60)Fig 1 Characteristic images of N2acells at different apoptotic periods induced by glutamate(×60)
不同谷氨酸浓度诱导对N2a细胞早期凋亡比例的影响 随着谷氨酸诱导浓度的增加,早期凋亡细胞比例逐渐增加。当谷氨酸浓度为750μg/mL时,早期凋亡细胞比例达到峰值42.07%;当谷氨酸浓度为1 000μg/mL时,早期凋亡细胞比例开始减少(图2、3)。这可能与较高浓度谷氨酸诱导下直接进入坏死状态的细胞增多以及凋亡晚期进入坏死期细胞的增加有关。统计学分析发现,未加谷氨酸组和加不同浓度谷氨酸组之间数据的差异有统计学意义(P<0.05)。
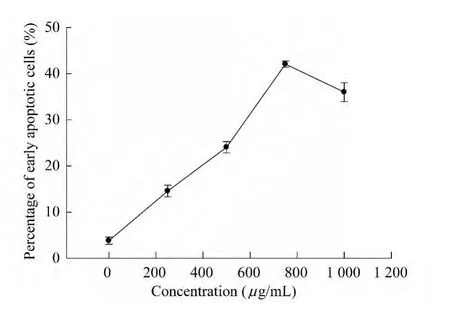
图2 不同浓度谷氨酸诱导下早期凋亡N2a细胞的比例Fig 2 The percentage of early apoptotic N2acells induced by different concentrations of glutamate
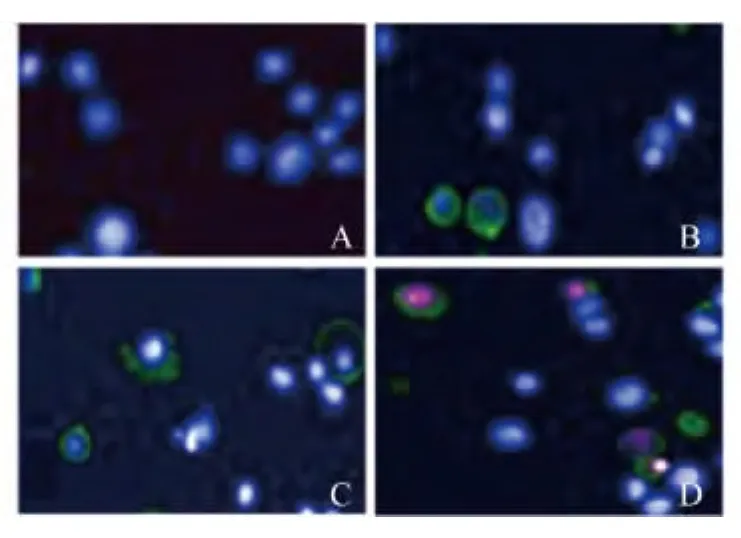
图3 不同浓度谷氨酸诱导下早期凋亡N2a细胞比例的变化(×20)Fig 3 The percentage of early apoptotic N2acells induced by different concentrations of glutamate(×20)
谷氨酸诱导N2a细胞凋亡的形态学动态追踪选择可诱导N2a细胞达凋亡峰值的谷氨酸浓度750μg/mL处理N2a细胞20 h作为拍摄起点,利用HCS系统对N2a细胞凋亡的形态学动态变化进行实时追踪。由于PI染料不适合长时间染色和追踪细胞凋亡动态,我们采用可进行活细胞染色和成像分析的NucRed Live 647标记细胞核(红色),同时结合Annexin V-FITC标记发生凋亡细胞的胞膜(绿色)。
结果显示,随着拍摄追踪时间的增加,带有绿色荧光(Annexin V-FITC)的细胞数目逐渐增多,即发生凋亡的细胞数目增多,而且细胞核逐渐出现碎片化(图4)。此外,还可以捕捉到同一个细胞发生凋亡的动态过程(图4中白色三角和箭头分别标示了两个细胞的凋亡动态变化)。与之相对应,随着拍摄追踪时间的增加,胞核的红色荧光(NucRed Live 647)强度不均一且荧光强度CV逐渐增大(图5A),凋亡细胞的胞核面积逐渐缩小(图5B)。统计学分析发现,未加谷氨酸组和加不同浓度谷氨酸组之间数据的差异有统计学意义(P<0.05)。
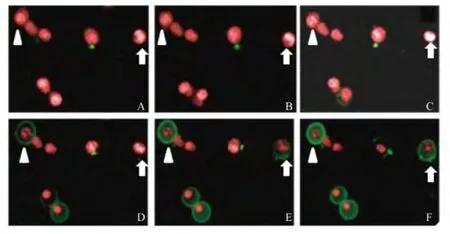
图4 谷氨酸诱导N2a细胞凋亡的形态学实时追踪(×40)Fig 4 The morphological real-time tracking images of apoptotic N2acells induced by glutamate(×40)
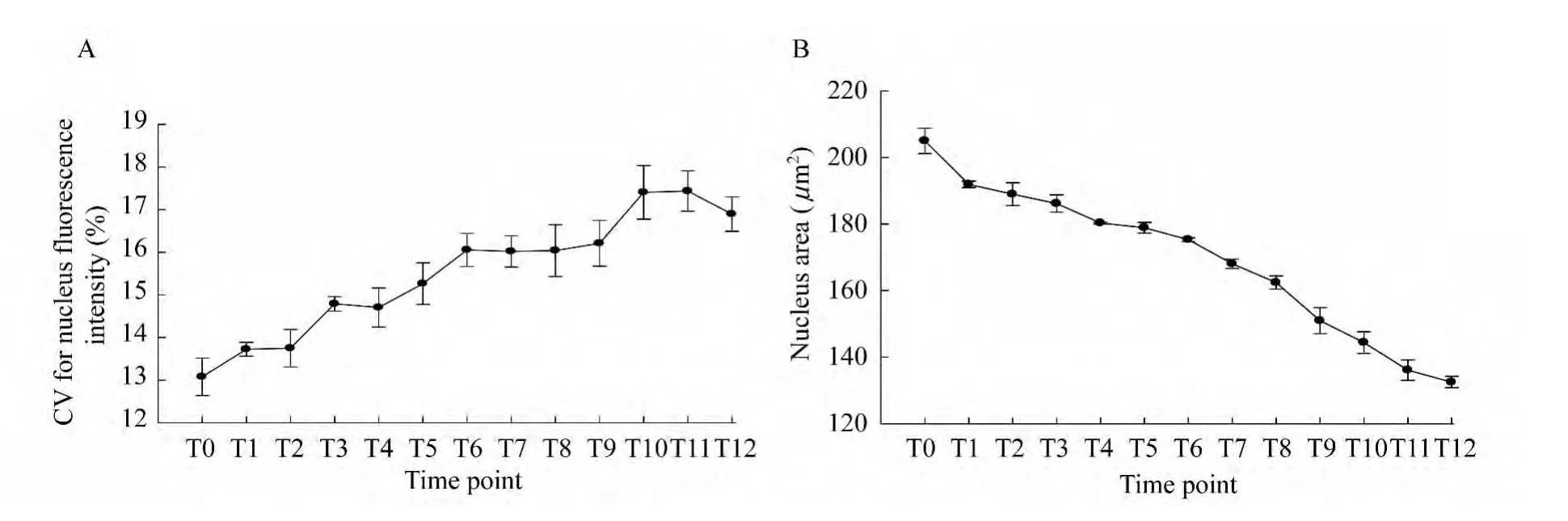
图5 凋亡的N2a细胞的胞核荧光强度CV值(A)及胞核面积(B)随谷氨酸诱导时间的变化Fig 5 CV of nucleus fluorescence intensity of glutamate induced apoptotic N2acells at different induction time
讨 论
有研究报道[9-10],离体培养的大脑皮层胶质细胞经不同浓度谷氨酸刺激后分别引起细胞的坏死和凋亡,低浓度谷氨酸(1×10-3mol/L)即可诱导胶质细胞发生凋亡,随着谷氨酸浓度的增高,凋亡细胞数目逐渐增多,但高浓度谷氨酸(1×10-2mol/L)则使胶质细胞的死亡方式以坏死为主。本实验选取介于两者之间的浓度250、500、750、1 000μg/mL(1.7~6.8×10-3mol/L)作为谷氨酸的诱导剂量,摸索其诱导N2a细胞凋亡达到峰值的浓度。通过HCS分析结合活细胞实时成像跟踪拍摄,可以捕捉到谷氨酸诱导后N2a细胞凋亡的形态学动态变化过程,包括从活细胞(Hoechst 33342+/AnnexinV-/PI-)进入凋亡早期(Hoechst 33342+/AnnexinV+/PI-)的胞膜磷脂酰丝氨酸外翻、细胞核凝缩状态,进一步进入细胞核碎裂的凋亡晚期(Hoechst 33342+/AnnexinV+/PI+)等各个阶段。
HCS分析系统通过全自动高速显微成像在短时间内生成大量的图像,全自动图像分析从这些图像中提取大量的数据,数据管理软件负责建档存储、注释比较、检索分享这些图像和数据。高内涵分析软件具有预设解决方案(ready-made solutions),预先安装常用图像分析方法和预设数据处理方案,如发现胞核、发现胞质、发现斑点、选择细胞区域、计算图像纹理密度特性数据、计算荧光特性数据、计算形态学特性数据等,不仅能获取大量细胞形态学数据,而且能对其进行有效的管理和分析[11-12]。
HCS分析不仅能够像传统流式细胞仪那样对样品进行群体分析,而且还可以对群体分析中具有特定数值特征的细胞进行形态学观察和数值检测,如对细胞核荧光强度变异系数以及胞核面积大小的改变等形态学指标进行定量检测。HCS分析结合活细胞实时成像技术可直观清晰地追踪拍摄谷氨酸诱导N2a细胞凋亡的形态学变化特征,是一种体外追踪单一神经细胞凋亡形态学变化的理想方法。该方法也可应用于药物对细胞凋亡的促进或抑制作用的形态学变化特征的研究。
[1] Aoyama K,Nakaki T.Neuroprotective properties of the excitatory amino acid carrier 1 (EAAC1)[J].Amino Acids,2013,45(1):133-142.
[2] Cassano T,Serviddio G,Gaetani S,et al.Glutamatergic alterations and mitochondrial impairment in a murine model of Alzheimer disease[J].Neurobiol Aging,2012,33(6):1121.e1-e12.
[3] Cao L,Li L,Zuo Z.N-acetylcysteine reverses existing cognitive impairment and increased oxidative stress in glutamate transporter type 3 deficient mice [J].Neuroscience,2012,220(18):85-89.
[4] Park SY,Jin ML,Kim YH,et al.Involvement of heme oxygenase-1 in neuroprotection by sanguinarine against glutamate-triggered apoptosis in HT22 neuronal cells[J].Environ Toxicol Pharmacol,2014,38(3):701-710.
[5] 朱加应,张广云,王建怡,等.雌激素及雌激素受体α减轻谷氨酸对神经细胞的损伤[J].中国病理生理杂志,2013,30(1):121-127.
[6] Christophe T,Ewann F,Jeon HK,et al.High-content imaging of Mycobacterium tuberculosis-infected macrophages:anin vitromodel for tuberculosis drug discovery[J].Future Med Chem,2010,2(8):1283-1293.
[7] Zock JM.Applications of high content screening in life science research [J].Comb Chem High Throughput Screen,2009,12(9):870-876.
[8] Wang C,Zeng Z,Liu Q,et al.Se-methylselenocysteine inhibits apoptosis induced by clusterin knockdown in neuroblastoma N2a and SH-SY5Y cell lines[J].Int J Mol Sci,2014,15(11):21331-21347.
[9] Yu X,Sun L,Luo X,et al.Investigation of the neuronal death mode induced by glutamate treatment in serum-,antioxidant-free primary cultured cortical neurons[J].Brain Res Dev Brain Res,2003,145(2):263-268.
[10] 王伟,唐荣华,刘洋,等.谷氨酸对大鼠胶质细胞细胞周期和凋亡坏死的影响[J].中华医学杂志,2000,80(1):67-68.
[11] Anguissola S,Garry D,Salvati A,et al.High content analysis provides mechanistic insights on the pathways of toxicity induced by amine-modified polystyrene nanoparticles[J].PLoS One,2014,9(9):e108025.
[12] Singh S,Carpenter AE,Genovesio A.Increasing the Content of High-Content Screening:An Overview[J].J Biomol Screen,2014,19(5):640-650.
