高脂饮食诱导的肥胖小鼠中缺氧对胰岛素抵抗及脂肪组织巨噬细胞浸润的影响
2015-11-19张莉亚李益明叶红英
张莉亚 苗 青 李益明 叶红英
(复旦大学附属华山医院内分泌科 上海 200040)
肥胖及其相关性疾病严重威胁着人类健康。肥胖主要的病理生理改变为脂肪细胞增大、脂肪组织分泌功能异常、巨噬细胞浸润等,是肥胖致胰岛素抵抗的重要因素。但肥胖致胰岛素抵抗的始动因素、巨噬细胞浸润增加的机制尚未完全阐明。
肥胖状况下,白色脂肪组织(white adipose tissue,WAT)的分泌功能发生明显变化,表现为炎性介质分泌显著增加和具有抗炎作用的脂联素分泌减少,被认为是肥胖致胰岛素抵抗的机制之一[1]。进一步研究发现,肥胖时这些炎性介质主要由浸润于脂肪组织的巨噬细胞分泌[2]。在肥胖状态下,脂肪组织是局部持续性激活巨噬细胞的炎症部位,表现为巨噬细胞特征性地围绕个别脂肪细胞成冠状而不是分散在脂肪细胞间,被巨噬细胞围绕的脂肪细胞呈特征性缩小[3-4]。
2007年,Ye等[5-6]首次发现ob/ob小鼠和高脂饮食诱导肥胖(diet-induced obesity,DIO)小鼠的脂肪组织存在局部缺氧并伴随炎性因子表达增加和脂联素表达降低。此后有多项研究在肥胖模型鼠及肥胖人群中都证实了其脂肪组织存在缺氧的现象[7-14]。Rausch等[13]证实高脂饲料喂养的肥胖小鼠的脂肪组织存在局部缺氧,且缺氧区域出现包绕脂肪细胞的F4/80阳性的巨噬细胞浸润。但肥胖时脂肪组织缺氧是否是胰岛素抵抗、巨噬细胞浸润的始动因素仍不明确。
因此,我们利用DIO小鼠模型,动态观察高脂饮食(high-fat diet,HFD)小鼠各时间点(4、8、12 w)病理生理特点的动态变化,明确缺氧是否为肥胖时脂肪组织胰岛素抵抗和巨噬细胞浸润的始动因素。
材料和方法
药品与试剂 超敏小鼠胰岛素ELISA试剂盒购自瑞典Mercodia公司;4%甲醛溶液、二甲苯、无水乙醇、伊红、苏木精均购自上海化工有限公司;F4/80单抗购自美国 R&D公司;hypoxyprobeTM-1试剂盒购自美国Chemicon公司。
实验动物 SPF级4周龄C57BL/6J雄性小鼠60只,购自上海斯莱克实验动物有限责任公司,按照SPF(无特定病原体动物)级动物饲养标准进行饲养,标准饲料(10%热卡来自脂肪)及高脂饲料(60%热卡来自脂肪)购自美国Research Diets公司。适应性喂养1周后,随机分为标准饲料组(CON)和HFD组,每组各30只。每周监测摄食量、体质量、空腹血糖。饮食干预后第4、8、12周时间点,两组小鼠禁食不禁水6 h后称重,进行实验,并在上述时间点处死CON组及HFD组小鼠各10只。
腹腔注射葡萄糖耐量实验评价小鼠糖代谢 采用50%注射用葡萄糖,按2.5 g/kg体质量进行腹腔注射。注射前和注射后15、30、60、90 min分别尾尖采全血,用拜耳拜安易血糖仪测定血糖(德国拜耳公司,检测高限30.5 mmol/L,血糖显示高者按30.5 mmol/L计算。腹腔注射葡萄耐量实验(intraperitioneal ghrcose tolerance test,ipGTT)曲线下面积计算公式:AUCipGTT(min·mmol/L)=30 min×[1/2×(BG0+BG90)+1×(BG15+BG30+BG60)]。
评价WAT量及其与体质量的比值 ipGTT2日后禁食不禁水6 h,摘眼球取血后,分离附睾脂肪,记录重量,4%甲醛溶液固定,液氮冻存。分离血样得血清后-80℃冻存待用。
ELISA检测血清胰岛素 根据胰岛素试剂盒操作手册测定血清胰岛素水平,并依据HOMA模型计算胰岛素抵抗指数 HOMA-IR,HOMA-IR=FBG (mmol/L)×FINS(μg/L)/22.5。
镜下观察脂肪细胞大小 取两组小鼠的附睾脂肪组织,4%甲醛溶液(pH=7.0)固定后,进行组织处理、石蜡包埋、切片,HE染色。用Image pro plus(IPP)6.0软件分析脂肪细胞的平均直径,以分析不同时间点脂肪细胞大小的动态变化。
免疫组化染色检测脂肪组织巨噬细胞浸润 取两组小鼠的附睾脂肪组织石蜡切片,用巨噬细胞特异性标记物F4/80抗体进行免疫组化,DAB显色,以显示脂肪组织中的巨噬细胞。
免疫组化染色检测脂肪组织缺氧情况 采用hypoxyprobeTM-1试剂盒对两组小鼠的附睾脂肪组织石蜡切片进行哌莫硝唑标记的免疫组化,DAB显色,以检测细胞缺氧情况。
统计学处理 采用SPSS 11.5软件,符合正态分布的计量资料以±s表示,两组之间采用t检验,不符合正态分布的计量资料,两组间采用Wilcoxon检验。P<0.05为差异有统计学意义。
结 果
HFD组和CON组小鼠体质量的动态变化HFD组与CON组小鼠的基础体质量差异无统计学意义(P=0.5029);随着喂养时间延长,两组小鼠体质量均增加;4周时间点两组小鼠体质量差异无统计学意义(P=0.2153);8周时间点HFD组体质量显著高于CON组(P<0.001),12周时间点两组体质量差异进一步增大(表1)。
表1 不同时间点HFD组和CON组小鼠体质量比较Tab 1 Comparison of body weight at different weeks of HFD group and CON group (±s)
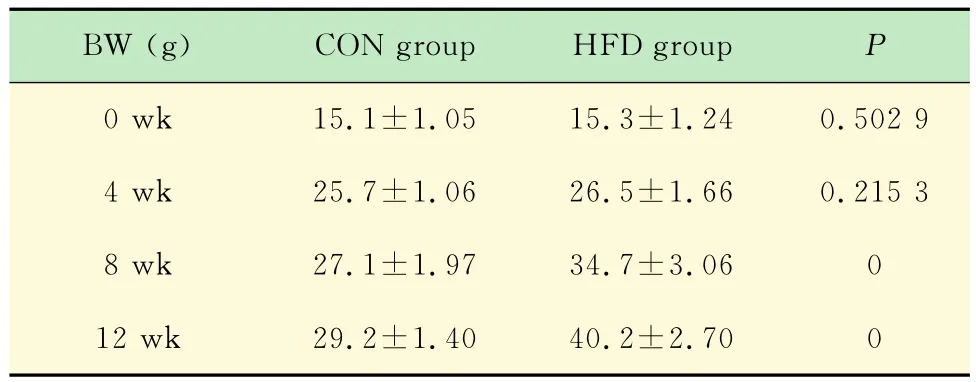
表1 不同时间点HFD组和CON组小鼠体质量比较Tab 1 Comparison of body weight at different weeks of HFD group and CON group (±s)
BW (g)CON group HFD group P 0wk 15.1±1.05 15.3±1.24 0.502 9 4 wk 25.7±1.06 26.5±1.66 0.215 3 8 wk 27.1±1.97 34.7±3.06 0 12 wk 29.2±1.40 40.2±2.70 0
HFD组和CON组小鼠WAT重量与体质量比值的动态变化 CON组附睾脂肪重量与体质量的比值(Wepi/BW)在各时间点均无明显变化,而HFD组进行性增加。两组相比,HFD组 Wepi/BW在4周时间点即显著高于CON组(P<0.001),在8周和12周时间点两组差异进一步增大(表2)。如果按脂肪比例增加为判断标准,HFD组在HFD4周时即已出现肥胖。
表2 不同时间点HFD组和CON组小鼠附睾脂肪重量与体质量的比值比较Tab 2 Comparison of the ratio of epididymal fat weight to body weight at different weeks of HFD group and CON group (±s)
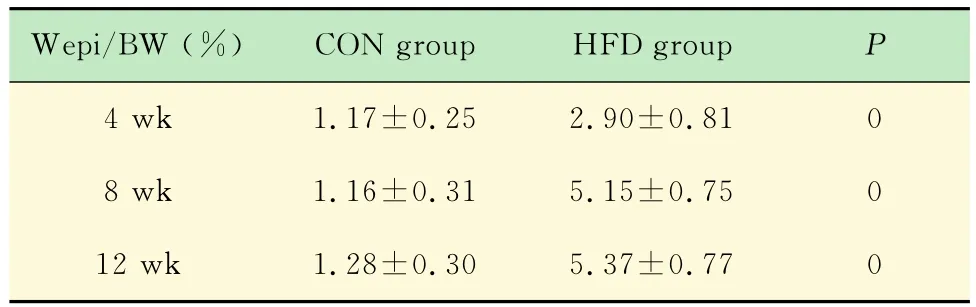
表2 不同时间点HFD组和CON组小鼠附睾脂肪重量与体质量的比值比较Tab 2 Comparison of the ratio of epididymal fat weight to body weight at different weeks of HFD group and CON group (±s)
Wepi/BW (%)CON group HFD group P 4 wk 1.17±0.25 2.90±0.81 0 8 wk 1.16±0.31 5.15±0.75 0 12 wk 1.28±0.30 5.37±0.77 0
HFD组和CON组小鼠糖耐量及胰岛素抵抗水平的动态变化 4周时间点HFD组的AUCipGTT即显著高于CON组(P<0.001),提示4周时间点即已经存在明显糖耐量异常;在8和12周时间点两组间糖耐量差异进一步增大(表3)。4周时间点,两组间HOMA-IR水平的差异无统计学意义(P=0.505 1);8周时间点 HFD组 HOMA-IR水平显著高于CON组(P<0.001),12周时间点两组HOMA-IR水平的差异进一步增大(表4)。
表3 不同时间点HFD组和CON组小鼠的AUCipaTT比较Tab 3 Comparison of AUCipGTTat different weeks of HFD group and CON group (±s)
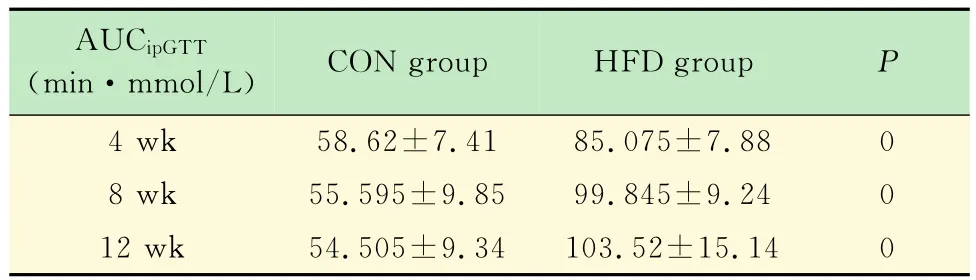
表3 不同时间点HFD组和CON组小鼠的AUCipaTT比较Tab 3 Comparison of AUCipGTTat different weeks of HFD group and CON group (±s)
AUCipGTT(min·mmol/L)CON group HFD group P 4 wk 58.62±7.41 85.075±7.88 0 8 wk 55.595±9.85 99.845±9.24 0 12 wk 54.505±9.34 103.52±15.14 0
表4 不同时间点HFD组和CON组小鼠的胰岛素抵抗水平比较Tab 4 Comparison of HOMA-IR at different weeks of HFD group and CON group (±s)
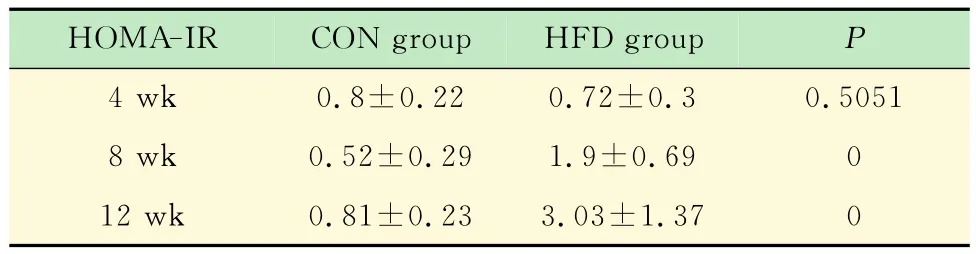
表4 不同时间点HFD组和CON组小鼠的胰岛素抵抗水平比较Tab 4 Comparison of HOMA-IR at different weeks of HFD group and CON group (±s)
HOMA-IR CON group HFD group P 4 wk 0.8±0.22 0.72±0.3 0.5051 8 wk 0.52±0.29 1.9±0.69 0 12 wk 0.81±0.23 3.03±1.37 0
HFD组和CON组小鼠脂肪细胞体积的动态变化 在不同时间点,CON组脂肪细胞的直径无明显变化,而HFD组进行性增大。4周时间点HFD组附睾脂肪组织的细胞大小即大于CON组,在8和12周时间点两组脂肪细胞大小的差异进一步增大(图1)。
HFD组和CON组小鼠脂肪组织巨噬细胞浸润的动态变化 F4/80为巨噬细胞的特异性标记物,经免疫组织化学染色,表达F4/80的巨噬细胞内可见黄褐色颗粒沉淀,而其他细胞则不被染色。在12周时HFD组附睾脂肪组织F4/80阳性染色的巨噬细胞浸润较CON组增加,且呈聚集现象,包绕一个直径明显小于周围细胞的脂肪细胞(图2)。
HFD组和CON组小鼠脂肪组织脂肪组织缺氧状况的动态变化 12周时间点HFD组哌莫硝唑阳性染色的脂肪细胞较CON组增加,证实HFD组小鼠附睾脂肪组织局部存在缺氧,而在4和8周时间点未显示哌莫硝唑阳性染色(图3)。
讨 论
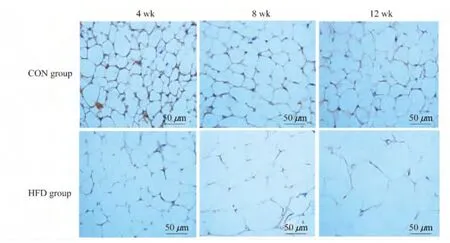
图1 不同时间点HFD组和CON组小鼠附睾脂肪细胞大小Fig 1 The size of adipose cells of epididymal fat at different weeks of HFD group and CON group

图2 不同时间点HFD组和CON组小鼠附睾脂肪组织内巨噬细胞浸润情况Fig 2 The macrophage infiltration into epididymal fat at different weeks of HFD group and CON group
DIO小鼠模型被广泛用于肥胖和胰岛素抵抗为特点的代谢综合征及相关疾病的研究。本研究选用60%热卡来自脂肪的高脂喂养5周龄C57BL/6J小鼠,利用简单的动态观察有效地展现了DIO小鼠的体质量、WAT重量与体质量的比值、糖耐量及胰岛素抵抗状况、缺氧、脂肪组织巨噬细胞浸润的动态变化。研究发现,与对照组比较,尽管4周时HFD组小鼠的体质量无显著升高,但已出现脂肪细胞直径增大及Wepi/BW显著升高。而脂肪组织比例的增加正是肥胖的关键要素,如果按脂肪比例增加为判断标准,HFD组在4周时即已肥胖;在8和12周时HFD组小鼠的平均体质量较对照组分别增高28%和37.7%,达到了体质量增加20%的肥胖建模标准。另外,4周时HFD组小鼠的AUGCipGTT即显著高于对照组,提示在4周时即已存在明显的糖耐量异常;在8周时HFD组小鼠HOMA-IR水平较对照组显著升高,提示在8周时存在明显的胰岛素抵抗。
哌莫硝唑因其特殊的化学性质可以作为缺氧化学探针,哌莫硝唑在缺氧环境(PO2<10 mmHg)中和蛋白质反应产生新蛋白质化合物[7],标记这些新生成的蛋白质并根据标记信号的强弱可反映缺氧状况。F4/80是巨噬细胞的特异性表达抗原,利用F4/80抗体对脂肪组织行免疫组化染色可以将巨噬细胞与其他脂肪组织间质细胞鉴别[4]。本研究分别用哌莫硝唑和F4/80为标记对DIO小鼠的附睾脂肪组织进行了免疫组化染色。我们的研究结果显示,脂肪组织缺氧和巨噬细胞浸润增加同步出现在HFD后12周时间点,迟于糖代谢异常和胰岛素抵抗的出现。
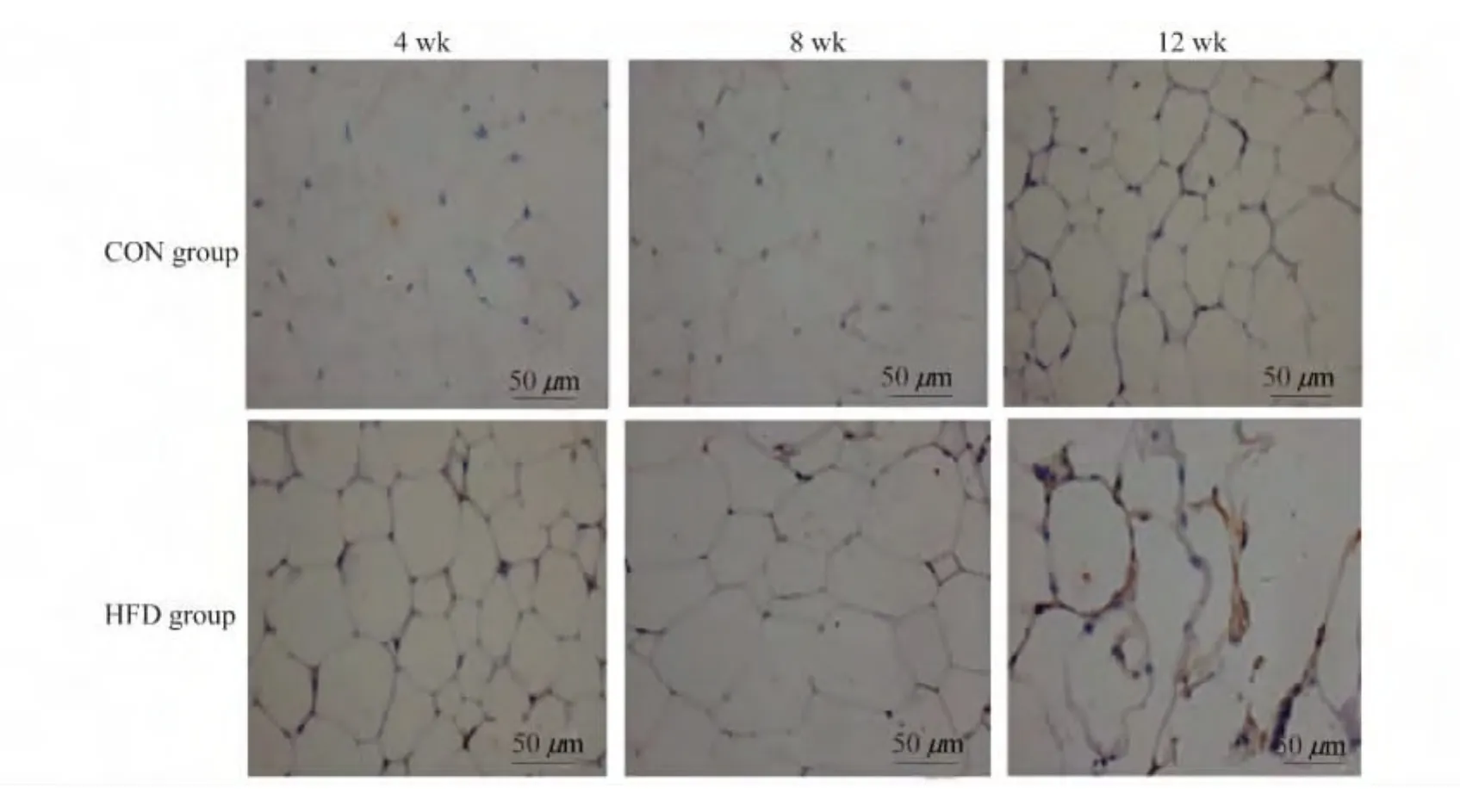
图3 不同时间点HFD组和CON组小鼠附睾脂肪组织缺氧情况Fig 3 The existence of hypoxia of epididymal fat at different weeks of HFD group and control group
Ye等[5]仅对肥胖模型的12周时间点进行了观察,只能观察到胰岛素抵抗、脂肪因子分泌变化、巨噬细胞浸润、缺氧等病理生理变化同时存在,提示了相关性,但却无法回答其中可能的因果关系。Elias等[15]发现过表达血管内皮生长因子的脂肪组织可通过增加氧供而改善胰岛素抵抗,但并未阐明缺氧是否启动了胰岛素抵抗的发生。而我们的研究通过动态观察提示了各种病理生理改变的时间先后关系,至少可以得出结论---缺氧可能不是HFD致糖代谢异常和胰岛素抵抗的启动因素。
巨噬细胞作为炎性因子的经典来源,其在肥胖和代谢疾病发生机制中的作用已越来越受到关注。多项研究表明,只有在肥胖个体的脂肪组织中才出现巨噬细胞浸润而正常个体并没有这种现象[4,16]。在肥胖发展过程中,脂肪组织中的巨噬细胞浸润呈渐进性,其数量甚至可达到脂肪组织细胞总数的40%,而这种增多与胰岛素抵抗密切相关[17]。相反,体质量减轻则会减少巨噬细胞浸润、改善胰岛素抵抗[18]。此外,采用特异性基因敲除阻断巨噬细胞的炎症信号通路也可改善肥胖小鼠的胰岛素抵抗[19]。然而,对于造成肥胖个体脂肪组织巨噬细胞浸润的原因,目前尚不明确,可能与脂肪细胞增生与肥大导致的脂肪细胞因子异常分泌、局部脂肪组织缺氧状态及营养性内毒素血症有关。而我们的研究发现脂肪组织缺氧和巨噬细胞浸润增加同步出现在同一时间点,提示缺氧与巨噬细胞浸润相关,前者可能是后者的原因、伴随现象或加重因素。
为了进一步研究脂肪组织缺氧与巨噬细胞浸润的关系,我们后续建立了体外间歇缺氧的大鼠模型,发现体外间歇缺氧改变脂肪组织多种脂肪因子基因表达但脂肪组织内巨噬细胞并未增加。此外,我们开展的体外试验发现,与正常培养相比,体外缺氧(1%O2)环境下的脂肪细胞培养液对单核细胞的趋化作用未增加。以上研究结果提示肥胖时脂肪组织缺氧可能并非巨噬细胞浸润的始动因素。但缺氧与肥胖时脂肪组织巨噬细胞浸润的关系仍待进一步研究。
[1] Dandona P,Aljada A,Bandyopadhyay A.Inflammation:the link between insulin resistance,obesity and diabetes[J].Trends Immunol,2004,25(1):4-7.
[2] Fain JN,Madan AK,Hiler ML,et al.Comparison of the release of adipokines by adipose tissue,adipose tissue matrix and adipocytes from visceral and subcutaneous abdominal adipose tissues of obese humans [J].Endocrinology,2004,145(5):273-282.
[3] Xu H,Barners GT,Yang Q,et al.Chronic inflammation in fat plays a crucial role in the development of obesityralated insulin resistance[J].J Clin Invest,2003,112(12):1821-1830.
[4] Weisberg SP,McCann D,Desai M,et al.Obesity is associated with macrophage accumulation in adipose tissue[J].J Clin Invest,2003,112(12):1796-1808.
[5] Ye J,Gao Z,Yin J,et al.Hypoxia is a potential risk factor for chronic inflammation and adiponectin reduction in adipose tissue of ob/ob and dietary obese mice[J].Am J Physiol Endocrinol Metab,2007,293(4):E1118-1128.
[6] Ye J.Emerging role of adipose tissue hypoxia in obesity and insulin resistance[J].Int J Obes (Lond),2009,33(1):54-66.
[7] Hosogai N,Fukuhara A,Oshima K,et al.Adipose tissue hypoxia in obesity and its impact on adipocytokine dysregulation[J].Diabetes,2007,56(4):901-911.
[8] Zhang L,Ebenezer PJ,Dasuri K,et al.Aging is associated with hypoxia and oxidative stress in adipose tissue:Implications for adipose function[J].Am J Physiol Endocrinol Metab,2011,301(4):E599-E607.
[9] Yin J,Gao Z,He Q,et al.Role of hypoxia in obesityinduced disorders of glucose and lipid metabolism in adipose tissue[J].Am J Physiol Endocrinol Metab,2009,296(2):E333-E342.
[10] Pasarica M,Rood J,Ravussin E,et al.Reduced oxygenation in human obese adipose tissue is associated with impaired insulin suppression of lipolysis[J].J Clin Endocrinol Metab,2010,95(8):4052-4055.
[11] Greenstein AS,Khavandi K,Withers SB,et al.Local inflammation and hypoxia abolish the protective anticontractile properties of perivascular fat in obese patients[J].Circulation,2009,119(12):1661-1670.
[12] Pasarica M,Sereda OR,Redman LM,et al.Reduced adipose tissue oxygenation in human obesity:evidence for rarefaction,macrophage chemotaxis,and inflammation without an angiogenic response[J].Diabetes,2009,58(3):718-725.
[13] Rausch ME,Weisberg S,Vardhana P,et al.Obesity in C57BL/6J mice is characterized by adipose tissue hypoxia and cytotoxic T-cell infiltration[J].Int J Obes (Lond),2008,32(3):451-463.
[14] Goossens GH,Bizzarri A,Venteclef N,et al.Increased adipose tissue oxygen tension in obese compared with lean men is accompanied by insulin resistance,impaired adipose tissue capillarization,and inflammation[J].Circulation,2011,124(1):67-76.
[15] Elias I,Franckhauser S,Ferré T,et al.Adipose tissue overexpression of vascular endothelial growth factor protects against diet-induced obesity and insulin resistance[J].Diabetes,2012,61(7):1801-1813.
[16] Clement K,Viguerie N,Poitou C,et al.Weight loss regulates inflammation-related genes in white adipose tissue of obese subjects[J].Faseb,2004,18(14):1657-1669.
[17] Di Gregorio GB,Yao-Borengasser A,Rasouli N,et al.Expression of CD68 and macrophage chemoattractant protein-1 genes in human adipose and muscle tissues:association with cytokine expression,insulin resistance,and reduction by pioglitazone[J].Diabetes,2005,54(8):2305-2313.
[18] Cancello R,Henegar C,Viguerie N,et al.Reduction of macrophage infiltration and chemoattractant gene expression changes in white adipose tissue of morbidly obese subjects after surgery-induced weight loss[J].Diabetes,2005,54(8):2277-2286.
[19] Arkan MC,Hevener AL,Greten FR,et al.IKK-βlinks inflammation to obesity-induced insulin resistance[J].Nat Med,2005,11(2):191-198.
