前哨淋巴结阳性的乳腺癌患者非前哨淋巴结转移影响因素分析
2015-11-19陈宏亮王富文王懋莉
陈宏亮 丁 昂 王富文 王懋莉
(复旦大学附属妇产科医院乳腺外科 上海 200011)
前哨淋巴结活检(sentinel lymph node biopsy,SLNB)于90年代早期引入,应用于临床腋窝阴性的早期乳腺癌[1]。若前哨淋巴结(sentinel lymph node,SLN)阴性,则进一步发生腋窝淋巴结转移的可能性极小(1%~2%)[2],可以免除腋窝淋巴结清扫 (axillary lymph node dissection,ALND),进而避免了ALND的并发症诸如淋巴水肿等。而对于SLN阳性患者,目前推荐需要进一步行ALND[3]。但国内外临床发现,在T1~T2期乳腺癌中有40%~70%的SLN阳性患者,SLN是其唯一转移的淋巴结[4-6]。ALND并未使这部分患者得到进一步的临床获益,反而带来了一系列的相关并发症[7-8]。因此,分析SLN阳性的乳腺癌发生进一步的非前哨淋巴结(non-sentinel lymph node,NSLN)转移的相关影响因素,有助于筛选出不必要行ALND的病例,对减少手术创伤、提高患者生活质量有着重要的意义。国内对于SLN阳性乳腺癌发生NSLN转移的影响因素研究较少,本文将复旦大学附属妇产科医院乳腺外科2010年至2013年治疗的SLN宏转移的临床早期乳腺癌患者144例进行总结分析。
资料和方法
研究对象 从2010年至2013年诊治的450例行SLNB的临床早期乳腺癌患者中筛选研究对象。筛选标准:(1)穿刺活检或切除活检,术中冰冻病理明确为浸润性乳腺癌;术后石蜡病理明确病理类型为浸润性乳腺癌;(2)临床早期,肿瘤≤5 cm、临床及影像学检查提示腋窝阴性,并排除骨、肝、肺、脑及其他远处转移;(3)术前未进行化疗、放疗;(4)SLNB至少发现1枚SLN宏转移;(5)行ALND,并行全乳切除手术或保留乳房手术;(6)采用免疫组化方法检测肿瘤组织的雌激素受体(ER)、孕激素受体(PR)、人类表皮生长因子受体-2(HER2)以及Ki-67的表达。其中HER2(3+)定义过表达,HER2(-)/(1+)定义为阴性,HER2(2+)必要时行FISH检测。依据St Gallen专家共识[9]对病例进行分子分型。
活检 使用亚甲蓝染料法行SLNB。在乳晕旁2处不同部位皮下或皮内注射1%亚甲蓝2 mL,注射后局部按摩10 min,然后于胸大肌外缘处做弧形切口,逐层切开,寻找到蓝染淋巴管后沿其追踪,将所有蓝染淋巴管进入的第一个蓝染淋巴结以及周边触诊发现的肿大质硬的淋巴结均作为SLN送检(图1)。取出的SLN行快速冰冻活检,随后与肿瘤标本同行石蜡切片、HE染色检查。
图1 SLNB标本的标识Fig 1 Identification of SLNB specimen
分组及测量 根据NSLN状态将SLN阳性病例进行分组,比较两组病例间的临床病理特征。其中,上肢淋巴水肿的测量及判断标准是:取患肢腕横纹处、尺骨鹰嘴上下各10cm处分别测量其周径,与健侧作对比。患侧周径比健侧大2cm及以上即为上肢淋巴水肿。
统计学方法 运用SPSS19.0统计学软件进行统计分析。组间定量指标的比较采用t检验,组间样本率比较采用χ2检验或Fisher精确概率法。通过单因素分析筛选NLSN阳性的影响因子。将单因素分析中差异有统计学意义的因子纳入多因素分析,采用Logistic回归分析进行多因素分析。均采用双侧检验,以P<0.05为差异具有统计学意义。
结 果
一般情况 2010年至2013年间450例行SLN病例中,154例SLN阳性,其中10例为微转移,144例为宏转移。将后者纳入研究对象。
144例病例的平均年龄为(49.8±10.8)岁,平均肿瘤大小为(2.8±1.1)cm,中位阳性SLN 数目为1枚(1~5枚),其中102例阳性SLN数目1枚,36例阳性SLN数目2枚,6例阳性SLN数目≥3枚。中位SLN数目为3枚(1~10枚),中位腋窝淋巴结清扫数目为15枚(8~38枚)。病理类型均为浸润性导管癌。142例均行术后辅助化疗(除2例80岁以上),58例行术后放疗,94例行内分泌治疗。术后上肢淋巴水肿发生率为19.4%。
分组比较 根据NSLN状态将144例病例分为NSLN阳性组与NSLN阴性组,分析比较两组间临床病理特征:患者年龄、肿瘤大小、组织学分级、脉管侵犯、阳性SLN数目、阳性SLN比例、手术方式、分子分型以及上肢淋巴水肿发生率 (表1)。
单因素分析 从单因素分析发现,原发肿瘤大小、脉管侵犯、阳性SLN数目以及分子分型是NSLN转移的潜在影响因素。肿瘤体积大、脉管侵犯阳性、阳性SLN≥2枚以及Luminal B型及HER2型,NSLN转移的风险较大。
多因素分析 将上述因子纳入多因素分析,发现原发肿瘤>2cm、脉管侵犯阳性以及阳性SLN数目≥2枚是NSLN转移的独立危险因素;而分子分型尽管显示出Luminal B型及HER2型的NSLN转移风险较高的趋势,但差异未达到统计学意义(表2)。

表1 NSLN转移的单因素分析Tab 1 Univariate analysis of NSLN metastasis[n(%)]
讨 论
近年来,国外研究趋势反映并非所有SLN阳性的乳腺癌均需要常规行ALND。Bilimoria等[10]回顾性分析国家肿瘤数据中心1998年至2005年9 7314例临床腋窝阴性而SLN阳性的乳腺癌,约20.8%只行SLNB未行 ALND。Yi等[11]回顾性分析 SEER (surveillance,epidemiology,and end results)数据库1998至2004年26986例SLN活检阳性的乳腺癌,16.4%只进行SLNB。这一趋势的呈现,主要基于以下事实:首先,尽管SLN宏转移的NSLN转移率达40%~58%[4],仍有一半甚至更多的ALND为过度治疗[12]。本文同样发现,144例SLN阳性病例中,有94例NSLN为阴性,而这些患者术后淋巴水肿等并发症的发生率为19.1%。由于SLN较ALND显著降低淋巴水肿的发生率[13],故从理论上讲,65.3%的ALND可以避免,这些患者淋巴水肿的发生率可以显著降低。其次,许多研究随访了部分SLN阳性但未行ALND的病例,发现局部复发转移率较低[14],并认为,化疗和放疗等辅助治疗在肿瘤局部治疗中非常有效[7]。以上观察均提示在SLN阳性的病例中,有一部分无法从ALND获益,临床上只需要行SLNB。
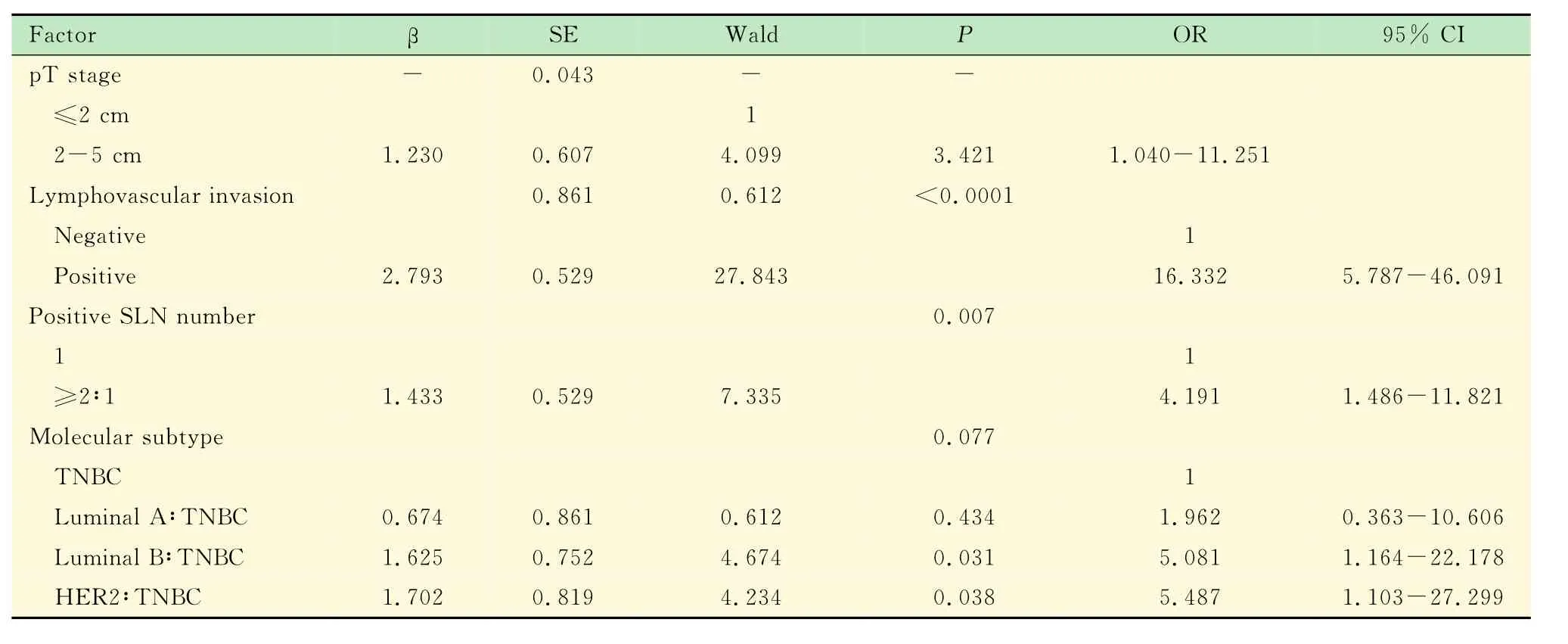
表2 NSLN转移的多因素分析Tab 2 Multivariate analysis of NSLN metastasis
国内外的相关文献针对不同特征的研究对象,分析了NSLN转移的预测因素,包括原发肿瘤大小、组织学类型、细胞核分级、多发病灶、ER、SLN的检测手段、脉管侵犯、阳性SLN数目、SLN转移灶大小、阳性SLN的比例及阳性SLN包膜侵犯等,多数文献为回顾性研究[5,7,15-20]。本文发现:对于临床早期、未行新辅助治疗的SLN宏转移的乳腺癌,原发肿瘤大小、脉管侵犯以及阳性SLN的数目是NSLN转移的独立影响因素,与文献报道基本相符。本文中阳性SLN数目以1~2个占绝大多数,与国内文献报道基本一致[21-22]。有不少研究将SLN转移灶大小作为 NSLN 的预测指标[23-24],认为SLN宏转移发生NSLN转移的风险显著增高。但MSKCC模型并未将其纳入预测指标,认为肿瘤细胞在淋巴结中分布模式存在差异,一些淋巴结包含散在的单个肿瘤细胞或多灶性肿瘤细胞簇,其转移灶大小无法测量,故推荐测量淋巴结转移灶的容积,但实际操作性不强。本文的病例均为SLN宏转移,故未将SLN转移灶大小作为预测指标进行分析。另外,由于本文中病理未常规进行阳性淋巴结包膜侵犯的检测,故无相关数据,不将这一因素纳入分析。本文分析未得出阳性SLN比例对NSLN状态的影响,可能是由于样本量不足导致检验校能不足的假阴性所致;另一方面,由于目前SLNB推荐使用蓝染料法+核素示踪的联合法,而本文受到条件限制只采用蓝染料法,为了降低假阴性,根据2013年中国抗癌协会乳腺癌指南[25],将所有蓝染淋巴管进入的第一个蓝染淋巴结以及周边触诊发现的肿大质硬的淋巴结均作为SLN送检,故平均SLN数目较文献报道的略高,导致阳性SLN比例相应降低,因此在统计分析中未得出相关结论。
本文单因素分析提示Luminal B型及HER2型分子亚型发生NSLN转移的风险较高,而预后相对较差的TNBC的风险度较低。有研究提示TNBC的淋巴结转移率并不高[26],其预后不依赖于淋巴结肿瘤负荷,甚至TNBC这一分子类型是预测腋窝淋巴结转移的保护性因素(以激素受体阳性的乳腺癌作为比较基线,TNBC的OR:0.88,95%CI:0.88-0.97;HER2型的 OR:1.35,95%CI:1.23-1.48,P<0.001)[27]。多因素分析并未得出统计学差异(P=0.061),可能是因为样本量不足。相关文献通过多因素分析提示Luminal A型及Luminal B型的NSLN转移的风险较高,而HER2型NSLN转移风险并不高于TNBC[28]。与本文结论有差异,分析原因,前者研究对象包括25%的SLN微转移病例,分析中未纳入脉管侵犯因素,且分子分型依据2011年St·Gallen专家共识。
国外多个研究中心先后设计了以多个临床病理因素为变量的NSLN转移预测模型。目前较为常见的有 MSKCC 模型[7]、Mayo模型[29]、Cambridge模型[23]以及 Stanford模型[24]等,其各自所含预测因素不尽相同。MSKCC模型是世界上第一个NSLN转移预测模型,一共纳入了9个指标,其经典病例的受试者工作特征曲线(receiver-operating characteristic curve,ROC)下面积(area under the curve,AUC)为0.77,但不同中心的验证结果也有所不同,AUC介于0.53~0.86[29-31]。
一个预测模型的建立往往是基于一组特定人群的临床病理资料,但是在不同国家或区域之间往往存在较大的差异,因此会影响预测模型的预测准确性。Fan等[32]指出,中国人乳腺癌发病年龄高峰有2个,第1高峰在45~59岁,第2高峰在70~75岁,而西方国家乳腺癌发病年龄高峰在70~75岁。此外,不同地区对于SLN寻找方法、病理评估方法和肿瘤生物学特性的差异,是导致预测准确性改变的重要因素[33]。国外SLNB多采用核素结合异硫蓝或专利蓝染料法;国内多采用亚甲基蓝染料法;国外SLN转移诊断方法包括冰冻切片、石蜡切片HE染色、连续切片HE染色和IHC染色法等,而国内主要是冰冻切片和石蜡切片HE染色法。以上多种因素可能导致国外的预测模型直接用于中国人乳腺癌患者,预测准确性偏低,临床实用性也不高[21]。因而,需要通过国内相关临床资料进行研究总结。本文作为一个初步的研究,总结了一些预测因素,期待通过更多的研究资料来建立一个基于中国人乳腺癌患者临床特点的预测NSLN转移的预测模型并在临床上推广使用。
属于低危的SLN阳性患者能否只行SLNB,尚需要临床实验的长期随访分析。对此,国外学者做了一些研究。IBCSG23-01临床实验分析934例SLN阳性乳腺癌,ALND组与SLN组的5年无病生存率(84.4%:87.8%,P=0.16)及总生存率(97.6%:97.5%,P=0.73)无显著性差异[34]。但是,该试验的研究对象是SLN微转移的乳腺癌病例,且只有9%的病例行全乳切除手术。
ACOSOG Z0011临床实验证实,对T1-T2、临床腋窝阴性、SLN转移≤2枚、保乳手术、术后进行全乳腺放疗、未接受新辅助化疗的患者,仅接受SLNB(446例)组与进一步ALND组(445例)相比,两组的总生存率、无病生存率和局部复发率的差异无显著性[35-36]。尽管一些学者认为该实验的结论需要谨慎解读,但NCCN指南[37]及St.Gallen共识已将其纳入实际执行,欧美较多国家的临床实践已经发生改变[38-39]。而中国抗癌协会乳腺癌诊治指南与规范(2013版)[25]中指出:虽然St.Gallen共识建议,对于未接受过新辅助治疗的临床T1-2期、腋窝淋巴结为阴性、但病理1~2枚SLN宏转移且会接受后续进一步辅助全乳放疗及全身系统治疗的保乳患者,可免除ALND,但是中国学者倾向建议对所有腋窝淋巴结宏转移患者仍采用ALND。可能是考虑到我国乳腺癌临床病理特点以及SLN开展状况与国外的差异。
对于SLN阳性接受全乳切除术而不行进一步的ALND的文献随访资料较为有限,大部分报道认为进一步行ALND并未使生存获益,但文献研究对象中SLN微转移的比例较高(40%~90%)[10,40-42]。
最近,Cowher等[43]对一项新的手术方式:保留腋窝的区域切除(conservative axillary regional excision,CARE)做了随访报道。CARE术式使用蓝染法,切除前哨淋巴结以及周边可触及的淋巴结,不行术中冰冻病理,即使术后病理提示淋巴结阳性也不再行进一步的ALND。其切除淋巴结数量约是传统ALND的50%,术后淋巴水肿的发生率也相应降低(3.4%)。587例病例中位随访5.1年,7例发生局部复发,其中3例为腋窝复发。由此推断,并非所有的淋巴结阳性、行全乳切除术的病例均需要接受传统的ALND。
该术式提供了一个新的理念,但需要更大规模的多中心的临床研究以及长期的随访才能更好地验证其结论。CARE术式不进行病例筛选,不行术中SLN病理,仅做腋窝淋巴结部分清扫,在国内推行目前不太现实。
综上所述,国内外对于SLN宏转移病例开展保乳手术以及全乳切除手术时对于腋窝处理方式的差异,本研究的意义是可以作为一个初步探索,筛选出较Z0011实验更严格指征的SLN宏转移的低危病例(原发肿瘤≤2 cm、脉管侵犯阴性、阳性SLN数目1枚),在保乳手术+术后规范辅助治疗的患者中免除ALND,在行全乳切除术的病例中,逐步开展CARE术式。通过长期积累大量的临床资料,分析我国乳腺癌这部分病例行保乳手术免除ALND的安全性,以及在国内开展CARE术式的意义,可能的情况下可以逐步扩大适应证并缩小腋窝手术范围。
本文存在一些不足之处,例如,SLN的检测因条件限制,无法采用连续切片,对于微转移可能存在低估。本文病例的病理类型均为浸润性导管癌,而部分浸润性小叶癌在SLN中呈现孤立的肿瘤细胞,可能不易被HE染色检测,需要免疫组化检测[44];浸润性微乳头状癌淋巴结转移率高,SLNB的作用受到质疑[45]。故本文结论在其他病理类型中的应用需进一步的检验分析。另外,由于SLN微转移的病例数过少,本文只针对SLN宏转移的病例进行分析,需要增加SLN微转移病例可使结论更加完善。当然,本文的样本量尚偏少,需要进一步的积累。
基于目前的临床研究,对于SLN阳性的患者,仍推荐ALND。但已经明确,有将近半数的低危患者仅需要SLNB。对此,我们尚需要根据相关的预测因素,筛选出低危病例,在充分知情的前提下,进行大规模的临床随机对照实验,通过长期随访,比较进行与不进行ALND的生存率与局部复发情况,才能得出确凿的依据以指导临床实践。
[1] Giuliano AE,Kirgan DM,Guenther JM,et al.Lymphatic mapping and sentinel lymphadenectomy for breast cancer[J].Ann Surg,1994,220(3):391-401.
[2] Turner RR,Ollila DW,Krasne DL,et al.Histopathologic validation of the sentinel lymph node hypothesis for breast carcinoma[J].Ann Surg,1997,226(3):271-278.
[3] Lyman GH,Giuliano AE,Somerfield MR,et al.American Society of Clinical Oncology guideline recommendations for sentinel lymph node biopsy in early stage breast cancer[J].J Clin Oncol,2005,23(30):7703-7720.
[4] Kamath V,Giuliano R,Dauway E,et al.Characteristics of the sentinel lymph node in breast cancer predict further involvement of higher-echelon nodes in the axilla:a study to evaluate the need for complete axillary lymph node dissection[J].Arch Surg,2001,136(6):688-692.
[5] Stitzenberg KB,eyer AA,Stern SL,et al.Extracapsular extension of the sentinel lymph node metastasis:a predictor of nonsentinel node tumor burden[J].Ann Surg,2003,237(5):607-612.
[6] Kim T,Giuliano AE,Lyman GH.Lymphatic mapping and sentinel lymph node biopsy in early-stage breast carcinoma:a meta-analysis[J].Cancer,2006,106(1):4-16.
[7] Van Zee K,Manasseh DE,Bevilacqua JL,et al.A nomogram for predicting the likelihood of additional nodal metastasis in breast cancer patients with a positive sentinel node biopsy[J].Ann Surg Oncol,2003,10(10):1140-1151.
[8] Barranger E,Coutant C,Flahault A,et al.An axilla scoring system to predict non-sentinel lymph node status in breast cancer patients with sentinel lymph node metastasis[J].Breast Cancer Res Treat,2005,91(2):113-119.
[9] Goldhirsch A,Winer EP,Coates AS,et al.Personalizing the treatment of women with early breast cancer:highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2013[J].Ann Oncol,2013,24(9):2206-2223.
[10] Bilimoria KY,Bentrem DJ,Hansen NM,et al.Comparison of sentinel lymph node biopsy alone and completion axillary lymph node dissection for node-positive breast cancer[J].J Clin Oncol,2009,27(18):2946-2953.
[11] Yi M,Giordano SH,Meric-Bernstam F,et al.Trends in and outcomes from sentinel lymph node biopsy(SLNB)alone vs.SLNB with axillary lymph node dissection for node-positive breast cancer patients:experience from the SEER database[J].Ann Surg Oncol,2010,17(Suppl 3):343-351.
[12] Coutant C,Olivier C,Lambaudie E,et al.Comparison of models to predict non sentinel lymph node status in breast cancer patients with metastatic sentinel lymph nodes:a prospective multicenter study[J].J Clin Oncol,2009,27(17):2800-2808.
[13] McLaughlin SA,Wright MJ,Morris KT,et al.Prevalence of lymphedema in women with breast cancer 5 years after sentinel lymph node biopsy or axillary dissection:objective measurements[J].J Clin Oncol,2008,26(32):5213-5219.
[14] Jeruss JS,Winchester DJ,Sener SF,et al.Axillary recurrence following sentinel node biopsy[J].Ann Surg Oncol,2005,12(1):34-40.
[15] Turner RR,Chu KU,Qi K,et al.Pathologic features associated with nonsentinel lymph node metastasis in patients with metastatic breast carcinoma in a sentinel lymph node[J].Cancer,2000,89(3):574-581.
[16] Wong SL,Edwards MJ,Chao C,et al.Predicting the status of the nonsentinel axillary nodes:a multicenter study[J].Arch Surg,2001,136(5):563-568.
[17] Nos C,Harding-MacKean C,Freneaux P,et al.Prediction of tumor involvement in remaining axillary lymph nodes when the sentinel node in a woman with breast cancer contains metastasis[J].Br J Surg,2003,90(11):1354-1360.
[18] Mittendorf EA, Hunt KK, Boughey JC,et al.Incorporation of sentinel lymph node metastasis size into a nomogram predicting nonsentinel lymph node involvement in breast cancer patients with a positive sentinel lymph node[J].Ann Surg,2012,255(1):109-115.
[19] Tan EY,Ho B,Chen JJ,et al.Predictors of nonsentinel nodal involvement to aid intraoperative decision making in breast cancer patients with positive sentinel lymph nodes[J].ISRN Oncol,2011,2011:539503.
[20] 高雅军,何英剑,范照青,等.阳性前哨淋巴结≤2枚乳腺癌非前哨淋巴结状态影响因素分析[J].中华医学杂志,2014,94(30):2355-2358.
[21] 曹迎明,刘淼,周波,等.MSKCC和SOC模型预测中国乳腺癌患者非前哨淋巴结转移的验证比较研究[J].中国肿瘤临床,2014,41(8):508-512.
[22] 肖遥,梁峰,郝晓鹏,等.前哨淋巴结阳性乳腺癌患者腋窝转移危险因素的研究[J].军事医学,2013,37(12):917-921.
[23] Pal A,Provenzano E,Duffy SW,et al.A model for predicting non-sentinel lymph node metastatic disease when the sentinel lymph node is positive[J].Br J Surg,2008,95(3):302-309.
[24] Kohrt HE,Olshen RA,Bermas HR,et al.New models and online calculator for predicting non-sentinel lymph node status in sentinel lymph node positive breast cancer patients[J].BMC Cancer,2008,8:66.
[25] 中国抗癌协会乳腺癌专业委员会.中国抗癌协会乳腺癌诊治指南与规范(2013版)[J].中国癌症杂志,2013,23(8):637-684.
[26] Crabb SJ,Cheang MC,Leung S,et al.Basal breast cancer molecular subtype predicts for lower incidence of axillary lymph node metastases in primary breast cancer[J].Clin Breast Cancer,2008,8(3):249-256.
[27] Lin NU, Vanderplas A, Hughes ME, et al.Clinicopathological features,patterns of recurrence,and survival among women with triple-negative breast cancer in the National Comprehensive Cancer Network[J].Cancer,2012,118(22):5463-5472.
[28] Zhou WB,He ZY,Xue JL,et al.Molecular subtype classification is a determinant of non-sentinel lymph node metastasis in breast cancer patients with positive sntinel lmph nodes[J].PLoS ONE,2012,7(4):e35881.
[29] Degnim AC,Reynolds C,Pantvaidya G,et al.Nonsentinel node metastasis in breast cancer patients:assessment of an existing and a new predictive nomogram[J].Am J Surg,2005,190(4):543-550.
[30] Klar M,Jochmann A,Foeldi M,et al.The MSKCC nomogram for prediction the likelihood of non-sentinel node involvement in a German breast cancer population[J].Breast Cancer Res Treat,2008,112(3):523-531.
[31] Alran S,De Rycke Y,Fourchotte V,et al.Validation and limitations of use of a breast cancer nomogram predicting the likelihood of non-sentinel node involvement after positive sentinel node biopsy[J].Ann Surg Oncol,2007,14(8):2195-2201.
[32] Fan L,Zheng Y,Yu KD,et al.Breast cancer in a transitional society over 18 years:trends and present status in Shanghai,China[J].Breast Cancer Res Treat,2009,117(2):409-416.
[33] Lambert LA,Ayers GD,Hwang RF,et al.Validation of a breast cancer nomogram for predicting nonsentinel lymph node metastases after a positive sentinel node biopsy[J].Ann Surg Oncol,2006,13(3):310-320.
[34] Galimberti V,Coel BF,Zurrida S,et al.IBCSG23-01 randomised controlled trial comparing axillary dissection versus no axillary dissection in patients with sentinel node micrometastases[J].Lancet Oncol,2013,14(4):297-305.
[35] Giuliano AE,McCall L,Beitsch P,et al.Locoregional recurrence after sentinel lymph node dissection with or without axillary dissection in patients with sentinel lymph node metastases:the American College of Surgeons Oncology Group Z0011 randomized trial[J].Ann Surg,2010,252(3):426-433.
[36] Giuliano AE,Hunt KK,Ballman KV,et al.Axillary dissection vs no axillary dissection in women with invasive breast cancer and sentinel node metastasis:a randomized clinical trial[J].JAMA,2011,305(6):569-575.
[37] National Comprehensive Cancer Network.NCCN Clinical Practice Guidelines in Oncology(NCCN Guidelines).Breast Cancer.Version3.2014[EB/OL][2014-04-01].http://www.nccn.org/professionals/physician_gls/pdf/breast.pdf.
[38] Yi M,Kuerer HM,Mittendorf EA,et al.Impact of the American College of Surgeons Oncology Group Z0011 Criteria applied to a contemporary patient population[J].J Am Coll Surg,2013,216(1):105-113.
[39] Wright GP,Mater ME,Sobel HL,et al.Measuring the impact of the American College of Surgeons Oncology Group Z0011 trial on breast cancer surgery in a community health system[J].Am J Surg,2015,292(2):240-245.
[40] Milgrom S,Cody H,Tan L,et al.Characteristics and outcomes of sentinel node-positive breast cancer patients after total mastectomy without axillary-specific treatment[J].Ann Surg Oncol,2012,19(12):3762-3770.
[41] Crawford JD,Ansteth M,Barnett J,et al.Routine completion axillary lymph node dissection for positive sentinel nodes in patients undergoing mastectomy is not associated with improved local control[J].Am J Surg,2013,205(5):581-584.
[42] Spiguel L,Yao K,Winchester DJ,et al.Sentinel node biopsy alone for node-positive breast cancer:12-year experience at a single institution[J].J Am Coll Surg,2011,213(1):122-128.
[43] Cowher MS,Grobmyer SR,Lyons J,et al.Conservative Axillary Surgery in Breast Cancer Patients Undergoing Mastectomy:Long-Term Results[J].J Am Coll Surg,2014,218(4):819-824.
[44] Mittendorf EA,Sahin AA, Tucker SL,et al.Lymphovascular invasion and lobular histology are associated with increased incidence of isolated tumor cells in sentinel lymph nodes from early-stage breast cancer patients[J].Ann Surg Oncol,2008,15(12):3369-3377.
[45] Paterakos M,Watkin WG,Edgerton SM,et al.Invasive micropapillary carcinoma of the breast:aprognostic study[J].Hum Pathol,1999,30(12):1459-1463.
