烟曲霉Aspf3和Aspf4的表达纯化与多克隆抗体的制备
2015-11-19霍克克季朝能唐海平徐万祥顾少华
高 岩 ,霍克克,季朝能,唐海平,徐万祥,谢 毅,顾少华
(1.复旦大学 生命科学学院,遗传工程国家重点实验室,上海 200438;2.上海市工业菌株工程技术研究中心,上海 200438;3.上海市计划生育科学研究所,国家人口和计划生育委员会重点实验室,上海 200032)
侵袭性曲霉病(Invasive Aspergillosis,IA)具有50%~95%死亡率,大约80%的IA 由烟曲霉(Aspergillus fumigatus)感染引起,黄曲霉(Aspergillus flavus)约占15%~20%,少量的为黑曲霉(Aspergillus niger)和土曲霉(Aspergillus terreus)[1-2].曲霉是条件致病菌,恶性血液病患者、造血干细胞和器官移植受体、慢性肺阻塞患者、危重病人、长期使用类固醇者和中性白细胞减少症患者及艾滋病患者为易感人群[3-6].IA 的早期诊断和抗真菌药物的及时使用能大为提高患者的生存率[7].
IA 的临床诊断有3个标准:(1)确诊标准(Proven Criteria):组织病理学或无菌体液检测所获得的微生物学证据;(2)临床诊断标准(Probable Criteria):由宿主因素、临床指征及微生物学标准支持;(3)拟诊标准(Possible Criteria):仅具备宿主因素、临床指征支持,缺少微生物学证据[8].然而,肺活检通常由于病人冒风险而忌用,组织病理学方法约有20%的假阴性[9],因此在临床实践中通常用第二种标准对患者进行曲霉感染风险评判.
在IA 的血清学诊断中常用半乳甘露聚糖(Galactomannan,GM)单抗检测可疑血清样本中半乳甘露聚糖的GM 方法[10].GM 是曲霉菌细胞壁的多糖成分,随着菌丝体的生长和孢子的萌发而进入宿主的血循环,成为诊断IA 的抗原标志物.在异基因造血干细胞移植IA 患者中,GM 血清检测的灵敏度和特异性分别高达95%和98%[11].然而,在实体器官移植受体、慢性肺阻塞和重症监护室IA 患者中,GM 血清检测的灵敏度仅为40%~50%[4,12-14];在这部分IA 患者中,中性白细胞清除GM,使GM 血清检验灵敏度显著降低[15].此外,使用β-内酰胺类抗生素、输注血小板、肾衰竭和食物等因素会引起GM 血清检验假阳性结果[16-19].
人体在感染曲霉菌过程中,针对特定蛋白抗原,会产生相应的抗体.用烟曲霉免疫原,制备重组蛋白和多克隆抗体,继而用多克隆抗体对靶抗原进行B 细胞表位精细扫描,分析鉴定烟曲霉特异性表位和致病曲霉中的保守性表位,将免疫原性强的特异性和保守性表位组合构建嵌合肽,检测相应的循环抗体,是诊断曲霉感染的一个方向.烟曲霉Asp f3为过氧化物酶体膜蛋白(Peroxysomal protein),Asp f4为功能未知蛋白,均为烟曲霉的主要免疫原[20-21],且与致病曲霉中的同源蛋白高度保守.本研究制备烟曲霉Asp f3和Asp f4重组蛋白,免疫新西兰白兔,得到多克隆抗体,为进一步表位鉴定、分析和研制诊断IA 多表位嵌合肽打下了基础.
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
大肠杆菌E.coli BL21(DE3)和质粒pET-21(b+)、pET-22(b+)为本实验室保存.
1.1.2 主要试剂
限制性内切酶BamHⅠ-HF、SalⅠ-HF和T4DNA 连接酶购自New England Biolabs公司;6×His单克隆抗体、弗氏完全佐剂以及弗氏不完全佐剂购自Sigma公司;辣根过氧化物酶(HRP)标记的羊抗鼠、羊抗兔IgG 购自Santa Cruz Biotechnology公司.
1.1.3 实验动物
成年雄性新西兰大白兔10只,质量均约2kg,以及标准兔饲料均购于上海西普尔-必凯实验动物有限公司.单只分笼饲养于上海市计划生育科学研究所普通级家兔动物房内,室温(20±2)℃,并保证良好的光照及通风条件.
1.2 方法
1.2.1 Asp f3和Asp f4的同源蛋白分析
根据BLAST及文献阅读结果,应用http:∥www.ebi.ac.uk/Tools/msa/clustalo/和http:∥espript.ibcp.fr/ESPript/cgi-bin/ESPript.cgi这两个网站的同源蛋白分析工具,进行烟曲霉Asp f3 和Asp f4分别与其黑曲霉、黄曲霉、土曲霉中同源蛋白的序列比对及分析.
1.2.2 Asp f3和Asp f4的表达与纯化
1.2.2.1 原核表达载体pET-21(b)-Asp f3和pET-22(b)-Asp f4的构建
根据烟曲霉Af293菌株的Asp f3(NCBI accession No:XP_747849)和Asp f4(NCBI accession No:XP_749515)的蛋白序列,依据大肠杆菌密码子偏好性,由上海旭冠生物科技发展有限公司全合成基因,分别从EcoRⅠ、HindⅢ和EcoRⅠ、SalⅠ酶切位点克隆于pET-21(b+)和pET-22(b+),构建pET-21(b)-Asp f3和pET-22(b)-Asp f4重组质粒.其中,根据SignalP 软件预测,Asp f4 的信号肽为1~14aa,故pET-22(b)-Asp f4重组质粒中,Asp f4的序列为15~322aa.
1.2.2.2 重组Asp f3和Asp f4表达与鉴定
将C端带有6×His标签的重组质粒pET-21(b)-Asp f3和pET-22(b)-Asp f4分别转化到大肠杆菌BL21(DE3)感受态细胞中,挑取单克隆菌落于含50μg/mL氨苄青霉素的LB液体培养基中,37℃培养过夜.翌日,按照1∶50的比例将过夜菌转接至新的LB 液体培养基中,氨苄青霉素的工作浓度不变,37℃培养约2.5~3h(OD600为0.6~0.8)后,加入终浓度为1mmol/L 的异丙基硫代半乳糖苷(IPTG)诱导重组蛋白表达,表达条件为37℃培养4h.诱导完成后,10 000r/min离心5min,收集菌体,用150μL 1×PBS缓冲液溶菌,并加入50μL 4×SDS-PAGE Loading Buffer混匀.15%SDS-PAGE 电泳及6×His单克隆抗体Western blot 鉴定蛋白表达结果.对确定有表达的菌株重新诱导培养,诱导完成后,10 000r/min离心5min,弃去培养基后用150μL 1×PBS缓冲液溶菌,对全菌蛋白超生破菌(超声1s暂停1s,直至菌液澄清,冰上操作),10 000r/min,4℃离心20min分离上清和沉淀,同样用150μL 1×PBS缓冲液溶解沉淀.按照“全菌-上清-沉淀”的顺序上样,进行15%SD-PAGE 电泳及6×His单克隆抗体Western blot鉴定蛋白表达结果,观察目的蛋白在上清和沉淀中表达量的差异.
1.2.2.3 重组Asp f3和Asp f4蛋白的纯化
选取表达量高的单克隆菌株,将保种菌接入50mL 含50μg/mL 氨苄青霉素的LB 液体培养基中37℃培养过夜.次日,按照1∶50的比例将菌液转入500mL含50μg/mL 氨苄青霉素的LB液体培养基中,用1mmol/LIPTG 诱导4h.收集菌体,超声破菌后离心取上清(条件与上述一致).通过镍柱亲和层析纯化上清中的目的蛋白.将纯化后蛋白经过超滤、浓缩处理,用Bradford法估测纯化后蛋白浓度.取纯化蛋白进行SDS-PAGE电泳,用像素计算软件估测纯化蛋白的纯度.纯化后蛋白用于免疫新西兰大白兔.
1.2.3 兔抗Asp f3和Asp f4蛋白多克隆抗体的制备、效价测定与特异性检测
1.2.3.1 制备
免疫前收集对照雄性新西兰大白兔耳缘静脉血1~1.5mL用作阴性对照.重组蛋白用生理盐水稀释后与完全弗氏佐剂等体积混合,得到乳化混合液后对新西兰大白兔进行后颈部皮下多点注射免疫,每个重组蛋白免疫4只兔子.初次免疫时,每只兔子注射1mg重组蛋白.3周后进行第一次加强免疫,用不完全弗氏佐剂与重组蛋白等体积混合乳化,每只兔子注射0.5mg重组蛋白.两周后进行第二次加强免疫,方法与第一次相同.第二次加强免疫一周后于耳缘静脉取血,对取得的抗血清进行ELISA 效价分析,抗体滴度高于1∶105后取血约70~80mL.将取得的血液置于37℃培养箱1h 后4 ℃过夜.然后4 ℃,8 000r/min离心20min,收集上清即抗血清.
1.2.3.2 效价测定
以纯化后的Asp f3和Asp f4蛋白按1μg/孔包被酶标板,用免疫前血清作阴性对照,以收集的抗血清进行倍比稀释(1∶103,1∶104,1∶2×104,1∶4×104,1∶8×104,1∶1.6×105,1∶3.2×105,1∶6.4×105,1∶1.28×106)后用作一抗,以HRP标记的羊抗兔IgG 作二抗(1∶104稀释),加入邻苯二铵(OPD)底物反应液,37℃避光反应5min后加入反应终止液,测定各孔OD450值.
1.2.3.3 特异性检测
在获得抗血清之后,将抗血清与经超声破碎后的E.coli BL21(DE3)菌体按比例混合(100mL摇过夜菌液离心后得到的菌体溶于1mL 1×PBS缓冲液中,超声破菌后,与1mL 抗血清等体积混合),37℃孵育1.5h,12 000r/min离心20min后取上清.将诱导表达的全菌蛋白进行SDS-PAGE 电泳后,分别以吸附菌体后的抗血清及免疫前血清(作为阴性对照)作为一抗(1∶5×103稀释),HRP 标记的羊抗兔IgG(1∶5×103稀释)作为二抗,进行Western-blot检测.
2 结果
2.1 Asp f3、Asp f4蛋白序列分析
Asp f3的BLAST 分析表明其与黄曲霉的同源蛋白:过氧化物氧化还原酶(Peroxiredoxin,XP_002375948)的一致度(Identity)为70%;与黑曲霉的同源蛋白:过氧化物氧化还原酶pmp20(Peroxiredoxin pmp20,XP_001395908)的一致度为90%;与土曲霉的同源蛋白:类似过氧化物酶体膜蛋白(Hypothetical protein ATEG_09752,XP_001218374)的一致度为70%(图1).Asp f4的BLAST 分析表明其与黄曲霉的同源蛋白:变应原Asp F4样蛋白(allergen Asp F4-like,XP_002383433)的一致度为60%;与黑曲霉的同源蛋白:Asp f4(XP_001391915)的一致度为62%;与土曲霉的同源蛋白:Asp f4(XP_001218129)的一致度为60%(图2).

图1 Asp f3与黄曲霉、黑曲霉和土曲霉同源蛋白的序列比对Fig.1 An alignment of the Asp f3sequence and those of the homologous proteins

图2 Asp f4与黄曲霉、黑曲霉和土曲霉同源蛋白的序列比对Fig.2 An alignment of the Asp f4sequence and those of the homologous proteins
2.2 Asp f3、Asp f4蛋白的原核表达、纯化与验证
重组质粒pET-21(b)-Asp f3 和pET-22(b)-Asp f4 转化E.coli BL21(DE3)感受态细胞,在1mmol/L IPTG、37℃的条件下诱导4h.破碎菌体后15%SDS-PAGE 检测裂解液上清和沉淀中的蛋白质,分别以转入pET-21(b+)、pET-22(b+)空载体的E.coli BL21(DE3)作为阴性对照.经SDS-PAGE电泳检测显示,图3(a)中,在15ku至25ku之间约22ku处有明显的蛋白表达条带,与Asp f3的理论分子质量加上载体上氨基酸的分子质量总和约22ku相一致.且上清中的蛋白表达明显高于沉淀.上清经镍柱亲和层析后得到纯度约为98%、浓度约为15mg/mL的重组蛋白.

图3 Asp f3和Asp f4重组蛋白表达及纯化SDS-PAGE图谱Fig.3 SDS-PAGE of expression and purification of Asp f3or Asp f4
图3(b)中,表达的Asp f4 蛋白主条带在SDSPAGE凝胶上显示的相对分子质量约为40ku,略大于其理论相对分子质量与载体氨基酸之和35ku,但6×His单克隆抗体的免疫印迹鉴定结果表明PAGE凝胶上显示的相对分子质量为40ku蛋白条带是目的蛋白(图4).虽然蛋白大部分存在于沉淀中,但上清中蛋白量也达到了后续扩大表达纯化的要求.上清经镍柱亲和层析,得到纯度约为80%、浓度约为4mg/mL的重组蛋白.经过以His单克隆抗体为一抗,以辣根过氧化物酶标记的羊抗鼠为二抗的Western blot验证,结果表明上述特异性表达条带及镍柱亲和层析蛋白条带均分别为Asp f3和Asp f4重组蛋白的诱导表达条带.
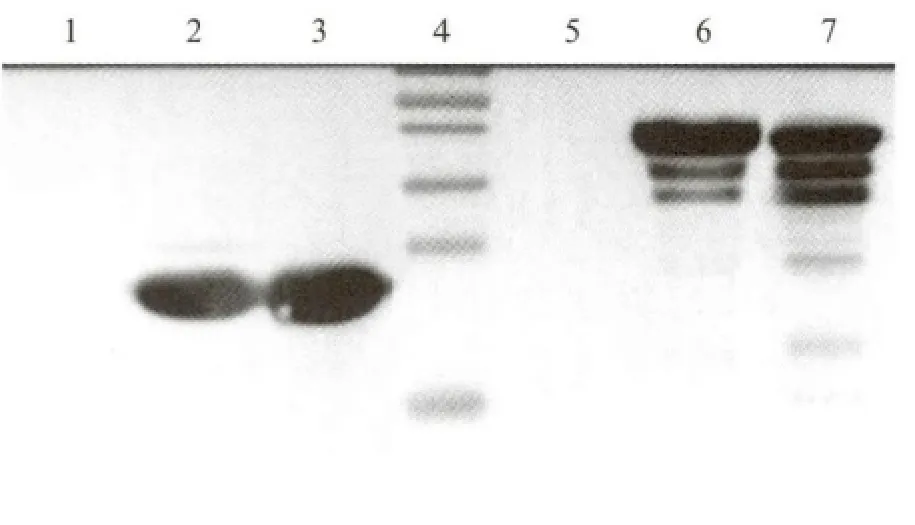
图4 Asp f3和Asp f4蛋白表达的Western blot验证Fig.4 Western blot of recombinant Asp f3and Asp f4
2.3 重组Asp f3、Asp f4蛋白多克隆抗体的制备及其特异性检测
将纯化好的Asp f3、Asp f4蛋白免疫新西兰大白兔,以免疫前血清做为阴性对照.经3次免疫后取血样,通过ELISA 实验测定兔抗重组Asp f3、Asp f4蛋白抗血清效价.结果表明,分别免疫Asp f3和Asp f4的8只实验兔的抗血清中特异性IgG 抗体滴度均在1.28×106以上(图5),符合后续实验要求.
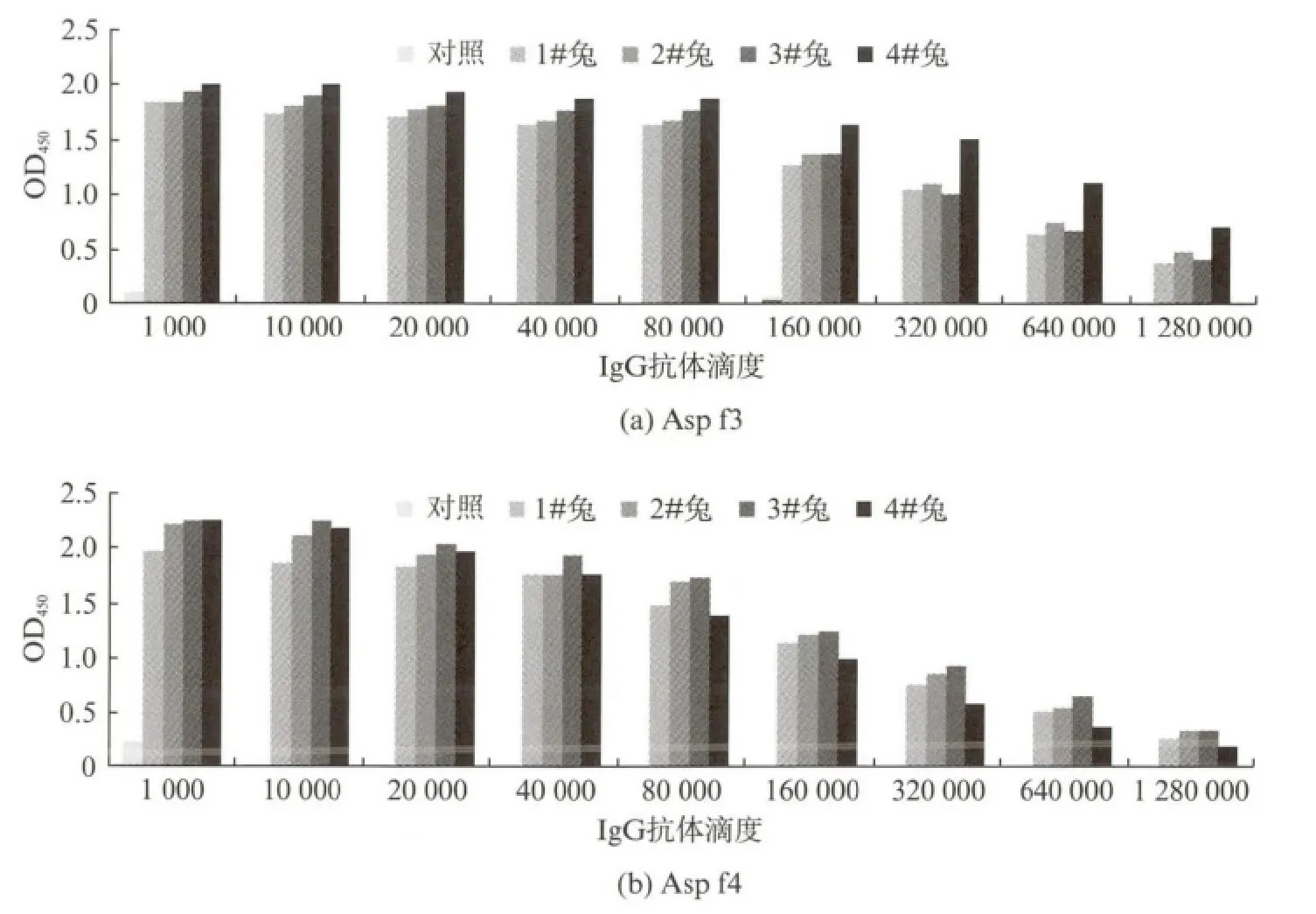
图5 兔抗Asp f3或Asp f4抗血清ELISAFig.5 ELISA of antiserum to Asp f3or Asp f4
取抗体滴度最高的抗Asp f3的4号兔的抗血清以及抗Asp f4的3号兔的抗血清进行进一步的吸附纯化,以纯化后的抗血清作为一抗,以辣根过氧化物酶标记的羊抗兔(Santa Cruz Biotechnology,Inc.)为二抗,对未纯化目的蛋白进行Western bolt.结果表明,实验获得了高滴度、特异性较好的兔抗Asp f3和兔抗Asp f4蛋白多克隆抗体(图6).
3 讨论
本研究构建了带有6×His 标签的重组质粒pET-21(b)-Asp f3 和pET-22(b)-Asp f4,在大肠杆菌中高效表达了目的蛋白.如图3 所示,Asp f3 在SDS-PAGE凝胶上显示的相对分子质量与其理论相对分子质量22ku相接近;Asp f4条带在SDS-PAGE凝胶上显示的相对分子质量大于其理论相对分子质量35ku,这可能与重组蛋白的氨基酸电荷组成情况有关,是基因工程表达目的蛋白常见的现象[22-24].6×His单克隆抗体的免疫印迹结果显示在22ku左右有清晰的条带即Asp f3重组蛋白以及在35ku上方有清晰的条带即Asp f4重组蛋白.如图3(b)所示,两个目的蛋白在破菌后上清中的表达量都比较高,因此可直接取上清进行镍柱亲和层析.纯化后所得的蛋白用超滤的方法将缓冲液替换为Milli-Q 超纯水以减少蛋白中的盐分对后续免疫工作的影响,并进行浓缩.Asp f4蛋白在表达和纯化后有一定程度的降解,降解可能发生在带有His标签的另一端即N 端.Asp f4蛋白的稳定性较低,但由于以主条带为主,可以用作抗血清的制备.经过新西兰大白兔后颈部皮下多点注射,获得了兔抗Asp f3和Asp f4蛋白的抗血清,并且经ELISA 实验验证其抗体效价符合后续实验的要求.但是,由于Asp f3和Asp f4蛋白是借助于大肠杆菌系统进行表达的,因此本研究获得的多克隆抗体中,难免会出现抗大肠杆菌本体蛋白的抗体,因此需要在获得抗血清后进一步对其进行吸附处理,Western blot验证其抗Asp f3和Asp f4特异性,以在进行表位鉴定时避免大肠杆菌本体蛋白产生的杂带干扰.如图6所示,本研究制备的多克隆抗体具有较好的抗Asp f3和Asp f4特异性,可以用作下一步的表位的鉴定.
本研究制备了高滴度兔抗Asp f3和Asp f4多克隆抗体.进一步拟用生物合成肽方法[26]鉴定Asp f3和Asp f4最小线性B细胞表位,分析其烟曲霉特异性及与黄曲霉、黑曲霉和土曲霉保守性,构建检测可疑血清样本中相应抗体的多表位嵌合肽,以诊断烟曲霉特异性IA 和致病曲霉广谱性IA.

图6 兔抗重组Asp f3和Asp f4蛋白多克隆抗体特异性的Western blot验证Fig.6 Western blot of specificity of antiserum to Asp f3and Asp f4
[1]Abad A,Fernández-Molina JV,Bikandi J,et al.What makes Aspergillus fumigatus a successful pathogen?Genes and molecules involved in invasive aspergillosis[J].Rev Iberoam Micol,2010,27(4):155-182.
[2]Krishnan S,Manavathu E K,Chandrasekar P H.Aspergillus flavus:An emerging non-fumigatus Aspergillus species of significance[J].Mycoses,2009,52(3):206-222.
[3]Garcia-Vidal C,Upton A,Kirby K A,et al.Epidemiology of invasive mold infections in allogeneic stem cell transplant recipients:Biological risk factors for infection according to time after transplantation[J].Clin Infect Dis,2008,47(8):1041-1050.
[4]Guinea J,Torres-Narbona M,Gijon P,et al.Pulmonary aspergillosis in patients with chronic obstructive pulmonary disease:Incidence,risk factors,and outcome[J].Clin Microbiol Infect,2010,16(7):870-877.
[5]Blot S I,Taccone F S,van den Abeele A M,et al.A Clinical algorithm to diagnose invasive pulmonary aspergillosis in critically ill patients[J].Am J Respir Crit Care Med,2012,186(1):56-64.
[6]Latge J P.Aspergillus fumigatus and aspergillosis[J].Clin Microbiol Rev,1999,12:310-350.
[7]Greene R E,Schlamm H T,Oestmann J W,et al.Imaging findings in acute invasive pulmonary aspergillosis:Clinical significance of the halo sign [J].Clin Infect Dis,2007,44:373-379.
[8]de Pauw B,Walsh T J,Donnelly J P,et al.Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group(EORTC/MSG)Consensus Group [J].Clin Infect Dis,2008,46(12):1813-1821.
[9]Guarner J,Brandt M E.Histopathologic diagnosis of fungal infections in the 21st century [J].Clin Microbiol Rev,2011,24(2):247-280.
[10]Mennink-Kersten M A,Donnelly J P,Verweij P E.Detection of circulating galactomannan for the diagnosis and management of invasive aspergillosis[J].Lancet Infect Dis,2004,4(6):349-357.
[11]Maertens J,Theunissen K,Lodewyck T,et al.Advances in the serological diagnosis of invasive Aspergillus infections in patients with haematological disorders[J].Mycoses,2007,50(Suppl 1):2-17.
[12]Guinea J,Jensen J,Pelaez T,et al.Value of a single galactomannan determination(Platelia)for the diagnosis of invasive aspergillosis in nonhematological patients with clinical isolation of Aspergillus spp[J].Med Mycol,2008,46(6):575-579.
[13]Meersseman W,Lagrou K,Maertens J,et al.Galactomannan in bronchoalveolar lavage fluid:A tool for diagnosing aspergillosis in intensive care unit patients[J].Am J Respir Crit Care Med,2008,177(1):27-34.
[14]Meersseman W,Vandecasteele S J,Wilmer A,et al.Invasive aspergillosis in critically ill patients without malignancy[J].Am J Respir Crit Care Med,2004,170(6):621-625.
[15]Guinea J,Bouza E.Current Challenges in the Microbiological Diagnosis of Invasive Aspergillosis[J].Mycopathologia,2014.
[16]Gerlinger M P,Rousselot P,Rigaudeau S,et al.False-positive galactomannan Platelia due to iperacillintazobactam [J].Med Mal Infect,2012,42:10-14.
[17]Martin-Rabadan P,Gijon P,Alonso Fernandez R,et al.False-positive Aspergillus antigenemia due to blood product conditioning fluids[J].Clin Infect Dis,2012,55(4):22-27.
[18]Patterson T F.Risk stratification for invasive aspergillosis:Early assessment of host susceptibility [J].Med Mycol,2009,47(1):S255-S260.
[19]Girmenia C,Santilli S,Ballaro D,et al.Enteral nutrition may cause false-positive results of Aspergillus galactomannan assay in absence of gastrointestinal diseases[J].Mycoses,2011,54(6):883-884.
[20]Hemmann S,Blaser K,Crameri R.Allergens of Aspergillus fumigatus and Candida boidinii share IgEbinding epitopes[J].Am J Respir Crit Care Med,1997,156(6):1956-1962.
[21]Kurup V P,Banerjee B,Hemmann S,et al.Selected recombinant Aspergillus fumigatus allergens bind specifically to IgE in ABPA [J].Clin Exp Allergy,2000,30(7):988-993.
[22]徐万祥,何亚萍,洪爱真,等.人卵透明带蛋白huZP3a22-176 和huZP3b177-348肽段在大肠杆菌中的表达及其纯化[J].生殖与避孕,2004,24(3):143-148.
[23]徐万祥,谢 毅,王 健,等.猪卵透明带-3基因在大肠杆菌中的融合表达和鉴定[J].中华微生物学和免疫学杂志,1999,19(2):137-141.
[24]Stahl S,Sjolander A,Nygren P A,et al.Adual expression system for the generation,analysis and purification of antibodies to a repeated sequence of the Plasmodium faiciparum antigen PT155/RESA[J].J Immunol Meth,1989,124(1):43-52.
[25]吴 敬,吴梧桐.B细胞蛋白质抗原表位的研究方法进展[J].药物生物技术,2000,7(4):239-242.
[26]Xu W X,He Y P,Tang H P,et al.Minimal motif mapping of a known epitope on human zonapellucida protein-4using apeptide biosynthesis strategy[J].J Reprod Immunol,2009,81:9-16.
