MYB家族转录因子OsMYB84通过ABA信号通路参与盐胁迫响应
2015-11-19张文政李春雨
吕 波,张文政,李春雨,明 凤
(1.复旦大学 生命科学学院 植物科学研究所,上海 200433;2.复旦大学 遗传工程国家重点实验室,上海 200433)
MYB转录因子家族是植物中最大的转录因子家族之一.MYB家族转录因子在C 端与DNA 结合域之间都具有一个富含酸性氨基酸的转录激活功能域,根据所包含的MYB 结构域的序列和数量,植物中MYB家族转录因子可以分为1R-MYB、3R-MYB、4R-MYB以及R2R3-MYB共4大类[1].已在多种植物中发现MYB家族转录因子,水稻和拟南芥中已发现有198个和183个MYB家族的成员[2].
MYB家族转录因子广泛存在于各种植物体中,其具有非常广谱的作用功能,如在参与植株形态建成以及花器官发育[3]和叶片形态的建成[4];参与了植物次生代谢过程[5],参与激素调控和信号转导[6-7],植物的防御反应以及在非生物逆境中发挥作用[8].大量的证据表明,在高温[9]、低温[10]、干旱[11]、高盐[12]、氮缺失[13]等非生物胁迫应答过程中,MYB转录因子也起着调控目标基因表达从而调节生物防御反应的功能.
拟南芥中的AtMYB84(又被称为AtRAX3),其突变体最早在1998年就有报道[14],但直到2006年Muller等[15]才发现当AtMYB84基因与其他两个基因AtMYB37(RAX1),AtMYB38(RAX2)共突变时才表现出对拟南芥侧生分生组织发育的影响,因此将这三个基因命名为RAX(Regulators of Axillarymeristems)基因.
通常根据MYB转录因子在植物抗逆胁迫过程中是否依赖脱落酸(abscisic acid,ABA)信号传导途径可将其分为两类:一类是和ABA 信号相关的转录因子,启动子区域常含有ABRE 一致序列;另一类是独立于ABA 信号途径的转录因子,其启动子中含有如CRT/DRE等核心元件[8].
水稻是人类的主要粮食作物之一,优良品种选育是提高水稻产量的主要方式之一.矮秆品种的选育和推广是上世纪水稻育种的最主要成就之一.水稻的矮生性是指成熟期水稻植株高度较正常植株矮的遗传特性.研究表明,这些矮秆或半矮秆水稻的产量一般比高杆品种要高20%~30%以上[16].因此,矮秆基因的挖掘、鉴定和利用对于水稻增产的研究是有重要意义的.
植物生长和发育受到多种环境因素的影响,其中,盐胁迫是环境胁迫中影响植物生长和农业性状的最主要因素之一.现实生产中,土壤盐渍化、海水倒灌等因素影响着水稻耕地面积,约有20%的世界耕地面积受到盐碱化的影响[17].Liu等[18]研究发现一个水通道蛋白基因OsPIP1;1过表达可以提高水稻对高盐胁迫的抗性、根系导水率以及种子产量.因此,研究高盐抗性基因,对水稻生长发育分子机理的探讨和提升农业性状有重要意义.
水稻中MYB84同源基因的分离以及功能研究还未见报道,因此本研究通过克隆OsMYB84基因,以转基因日本晴水稻为材料,研究OsMYB84转基因水稻正常生长表型以及在高盐胁迫下的表型,为探索水稻矮秆,抗逆性状基因以及其作用机制提供理论依据.
1 材料和方法
1.1 材料与试剂
水稻日本晴(Oryza sativa L.japonica.cv.Nipponbare)在培养箱(GXZ-380D,Ningbo,China)中培养,生长条件为光周期16 h/8 h(Light/Dark),28 ℃.根癌农杆菌菌株Agrobacterium tumefaciens EHA105,E.coli DH5α均购自TaKaRa公司.pSPT19载体购自Roche,pCR-Blunt、pCAMBIA-1304(含CaMV35S组成型启动子)、pC35S:GFP均由本实验室保存.PCR 引物、限制性内切酶、逆转录试剂盒均购自TaKaRa公司,其他试剂均为进口或国产分析纯.水稻培养液配方参照Yoshida等[19]的方法.
1.2 方法
1.2.1 水稻OsMYB84基因的获得
用TRIzol提取水稻野生型植株的总RNA,并用逆转录酶合成cDNA 第一条链,目的基因OsMYB84 PCR 引物见表1,利用此引物克隆OsMYB84的克隆全长OsMYB84,共1 209bp,回收PCR 产物构建到pCRBlunt载体中;利用引物OsMYB84Enyzme和pCRBlunt-OsMYB84克隆全长OsMYB84并加入酶切位点BglⅡ和SpeⅠ,回收PCR 产物进行双酶切,得到含有两个酶切位点的目的基因片段,将其连入同样双酶切的pCAMBIA1304载体中,构建好的载体导入农杆菌EHA105.PCR 的程序为:94℃4min;94℃40s,50℃40s,68℃90s;68℃10min,35个循环.
1.2.2 OsMYB84的序列比对和聚类分析
根据OsMYB84的DNA 序列,通过NCBI数据推测出相应的氨基酸序列,在数据库中检索不同物种中R2R3-MYB亚家族的同源基因,用Clustal X 软件进行同源基因的序列比对,通过Neighbour-joining法对这些基因进行进化分析,并利用MEGA4软件绘制了进化树.
1.2.3 亚细胞定位
采用GFP标签技术,通过BglⅡ和SpeⅠ双酶切得到的目的基因片段连入植物表达载体pC35S:GFP中,构建OsMYB84与GFP融合蛋白表达载体,通过基因枪转化的方法转化洋葱表皮细胞,研究目的蛋白OsMYB84的亚细胞定位.
1.2.4 农杆菌介导的水稻转化
将已构建的包含35S:OsMYB84过表达转基因载体pCAMBIA1304-OsMYB84,通过农杆菌介导法转化水稻.以农杆菌菌株EHA105为载体,侵染诱导的日本晴水稻愈伤组织,经过共培养、筛选、诱导分化和生根,获得转基因苗,得到的子代经育种筛选获得转基因水稻纯合体.
1.2.5 OsMYB84在水稻不同器官中的表达谱
用TRIzol提取水稻不同发育时期的叶片以及根、茎与花序的总RNA,并用PrimeScriptTMRT Reagent Kit(TaKaRa)分解混入的DNA 并发转录合成第一链cDNA.采用SYBR Premix Ex TaqTMⅡ(Perfect RealTime)(TaKaRa Code:DRR081)进行qRT-PCR 反应检测OsMYB84的mRNA 水平.目的基因OsMYB84和内参基因OsACTIN 的qRT-PCR 引物见表1.Real-Time PCR 程序为95 ℃3 min;94℃10s,55℃20s,40个循环.
1.2.6 OsMYB84在不同激素和逆境胁迫处理下的表达谱
以野生型水稻发芽后两周,分别选用10%聚乙二醇(polyethylene glycol,PEG)和低温4 ℃处理1~4d;200μmol/L NaCl、100μmol/L 茉莉酸(jasmonate,JA)处理1d;10μmol/L 激动素(kinetin,KT)、10μmol/L细 胞 分 裂 素(6-benzyladenine,6-BA)、10 μmol/L 生 长 素(indoleacetic acid,IAA)、5μmol/L赤霉素(gibberellin,GA)处理1d;50μmol/L 脱落酸(abscisic acid,ABA)处理2~24h,按照1.2.5的方法检测OsMYB84的表达量.
1.2.7 原位杂交
选取OsMYB84mRNA 的308bp的高特异性片段为探针,以克隆的OsMYB84片段为模板,设计原味杂交探针引物(表1),回收PCR 片段,EcoRⅠ和XbaⅠ双酶切后连入同样双酶切的pSPT19载体.探针制备方法参照Roche DIG RNA labeling Kit(SP6/T7).选取水稻根、芽以及不同发育时期的花,4%多聚甲醛固定,参照Wang等[20]方法进行脱水包埋、切片、杂交.
1.2.8 转基因植株的RNA 表达水平鉴定
以两周龄的水稻叶片为材料,按照1.2.5的方法检测目的基因的表达量.
1.2.9 转基因植株苗期耐盐性鉴定
将OsMYB84过表达株系和野生型催芽后,转移到培养箱中正常生长两周,两周后转移至添加200mmol/L NaCl(参照文献[10])的培养液中培养;15h后取部分植株测量转基因株系与野生型在两种培养条件下的叶片的电导率(电导率仪:雷磁DDS-307),剩余植株恢复培养;恢复培养2d后测量转基因株系和野生型株系的茎、根以及整株鲜重,并与对照组比较取相对值为相对茎鲜重(Relative Shoot Weight,RSW)、相对根鲜重(Relative Root Weight,RRW)以及相对整株鲜重(Relative Fresh Weight,RFW).

表1 实验所用引物*Tab.1 Primers used in the study
2 结果与分析
2.1 OsMYB84基因的克隆、序列分析和亚细胞定位
通过对应的拟南芥的AtMYB84进行生物信息学分析与基因文库中比对与搜索,克隆水稻中与拟南芥的AtMYB84 最为相似的基因(80%相似性),命名为OsMYB84(NM_001057941.1),该基因全长1 209bp,开放阅读框为966bp,编码321 个氨基酸残基,分子质量35.35ku.同源序列比对分析表明OsMYB84基因含有R2和R3保守的3个色氨酸区域(图1(a)),属于R2R3-MYB家族.
根据NCBI数据库中提供的不同物种R2R3-MYB 家族成员序列比对,发现OsMYB84与其他MYB家族基因一样具有保守的R2R3结构域,聚类分析显示OsMYB84除了与AtMYB84基因关系较近外,还与GmMYB161、AtRAX2、AtMYB37、AtMYB96 等基因关系也相近(图1(b)),其中,AtMYB84、AtRAX2、AtMYB37参与拟南芥侧生分生组织的起始[15],而AtMYB96 参与拟南芥在干旱[21-23]和冷胁迫[21]下的响应,所以推测OsMYB84与这些基因功能最为相近.
根据全长cDNA 推测的OsMYB84蛋白,通过生物信息学网站预测含有潜在的核定位信号.为了研究OsMYB84蛋白的亚细胞定位,将去掉终止密码子的OsMYB84编码框链接在绿色荧光蛋白GFP的N端,构建pOsMYB84-GFP融合蛋白表达载体,在35S启动子驱动下表达.在仅转化GFP的对照洋葱表皮细胞中,绿色荧光均匀分布在整个细胞中(图1(c)1~3);而融合蛋白表达载体转化的洋葱表皮细胞中,绿色荧光集中分布在细胞核中(图1(c)4~6).这些结果说明OsMYB84蛋白属于核定位蛋白.
2.2 OsMYB84在水稻不同器官中以及不同激素和逆境胁迫处理下的表达模式分析
为了解OsMYB84基因在水稻不同器官中的表达定位,对不同发育时期的叶片以及其他器官如根、茎与花序取样,进行Real-Time RNA 水平分析.结果表明OsMYB84基因为组成型表达(图2(a)),但在各器官之间表达量有很大差异:在茎中表达量最高,茎、幼叶、成熟叶、老叶之间的表达量没有明显差异,根中表达量相对较少,花中表达量最少.

图1 (a)OsMYB84基因序列比对,(b)进化分析和(c)亚细胞定位Fig.1 (a)Amino acids sequence alignment,(b)phylogenetic analysis and(c)subcellular localization of OsMYB84
为了解OsMYB84基因对非生物胁迫和外源植物激素处理的表达特性,对野生型日本晴水稻发芽后14d的幼苗进行了生长素(IAA)、激动素(KT)、脱落酸(ABA)、赤霉素(GA)、细胞分裂素(6-BA)、聚乙二醇(PEG)、高盐以及低温等处理.利用Real-Time PCR 的方法检测不同激素和胁迫处理下OsMYB84表达量的变化.在ABA 处理6h后,OsMYB84表达水平迅速提高,随着处理时间的延长,表达量随之上升,到12h表达量达到最大值,而到24h时,OsMYB84表达量与对照并没有显著差异(图2(b,c)).此外,OsMYB84的表达还受到6-BA、PEG、NaCl诱导.PEG 模拟干旱处理1d时OsMYB84表达量与对照组相比并没有显著差异,到4d时表达水平变高;盐胁迫处理1d时OsMYB84就开始表达,到4d时与对照组差异更显著(图2(d)).上述研究结果表明,OsMYB84基因受到ABA、高盐胁迫诱导高表达,也受到干旱诱导的微弱表达,暗示着OsMYB84在应答高盐、干旱胁迫时可能是依赖于ABA 途径.

图2 OsMYB84在水稻(a)不同器官、(b)不同激素、(c)激素ABA 不同时间段和(d)逆境胁迫处理下的表达模式Fig.2 The OsMYB84expression pattern(a)in various organs of rice,(b)under different hormones treatment,(c)ABA treatment over different times,(d)different abiotic stresses
2.3 OsMYB84基因组织水平的表达模式分析
因器官表达谱(图2(a))说明OsMYB84表达的遍在特性,为进一步确定目标基因在不同组织器官中的具体定位,通过序列同源性分析,设计OsMYB84高特异片段为原位探针,对水稻不同花发育时期、根、芽进行了原位杂交.结果显示OsMYB84在颖花原基(图3(a,b))、小穗(图3(c,d))、药室(图3(e,f))与花粉(图3(h))中高度表达,这些结果暗示OsMYB84可能参与花粉发育.同时,该基因在叶基部叶枕(图3(i))和根原基高表达(图3(j)),也预示着OsMYB84可能参与细胞分裂分化.

图3 OsMYB84在不同组织的原位分析Fig.3 In situ hybridization analysis of OsMYB84in various tissues
2.4 过表达OsMYB84基因的水稻株系株高变矮
由于OsMYB84基因在不同器官中的表达差异,为深入了解OsMYB84 基因对水稻发育的影响,将OsMYB84基因的编码框连入pCAMBIA1304载体,使之在35S启动子驱动下表达.利用real-time PCR的方法检测转基因水稻纯合体株系中的OsMYB84的表达水平(图4(a)),结果显示OX1、OX3、OX4转基因株系中目的基因表达量高于野生型(WT).通过对28℃光照16h/黑暗8h培养两周龄的转基因株系OX1与野生型(WT)的株高分析测量(图4(b,c)),结果表明正常培养下的转基因水稻株高要明显比野生型矮.

图4 OsMYB84转基因水稻的(a)RNA 水平鉴定,(b)株高表型及(c)株高分析Fig.4 (a)RNA level identification,(b)the height phenotype and(c)measurement of wild type and OsMYB84transgenic rice
2.5 过表达OsMYB84基因的水稻提高了对高盐胁迫的耐性
因OsMYB84受到高盐诱导,推测其参与高盐胁迫下的水稻逆境的应答反应,在逆境应答中起重要的调控作用.因此,通过对正常培养两周龄的转基因株系OX1与野生型植株分别放至正常培养液以及添加200mmol/L NaCl的培养液中培养,正常培养下的转基因和野生型水稻叶片都没有发生变黄卷曲现象,而NaCl处理的野生型水稻叶片相较于转基因水稻卷曲黄化更明显,这种黄化现象在恢复培养后越加明显(图5(a)).

图5 OsMYB84转基因株系OX1与野生型水稻幼苗的高盐抗性Fig.5 High salinity tolerance of wild type and OsMYB84transgenic rice OX1at the vegetative stage
盐处理15h后测量转基因株系与野生型在两种培养条件下的叶片的电导率(图5(b)),转基因株系的电导率显著低于野生型.并将NaCl处理的幼苗用正常培养液恢复培养,恢复培养2d后,测量转基因株系和野生型株系的茎、根以及整株鲜重,并与对照组比较取相对值(图5(c)),结果显示转基因水稻相对茎鲜重显著高于野生型,表明OsMYB84 转基因植株受高浓度盐胁迫的损伤比野生型小.这些结果说明OsMYB84过表达能够显著提高苗期水稻对高盐胁迫的耐受能力.
2.6 过表达OsMYB84基因的水稻对激素ABA表现敏感
由于OsMYB84受到激素ABA 诱导高表达,推测其影响了水稻对激素ABA 的敏感性.因此,对萌发期转基因水稻进行了ABA 处理实验,以正常MS培养基为对照,选取3μmol/L ABA 为添加处理激素,检测了转基因水稻在ABA 处理下的发芽情况(图6(a)),并测定每天的发芽率(图6(c)).在添加ABA 培养基上转基因水稻的种子萌发受到显著抑制,而无论是否添加ABA,野生型种子的萌发却无明显抑制现象.同时分析了水稻发芽8d后的生长势情况(图6(b,d)),结果显示转基因株系的生长受到ABA 抑制,相对株高显著低于野生型(图6(a,b,d)).这些结果说明转基因水稻对ABA 更敏感.
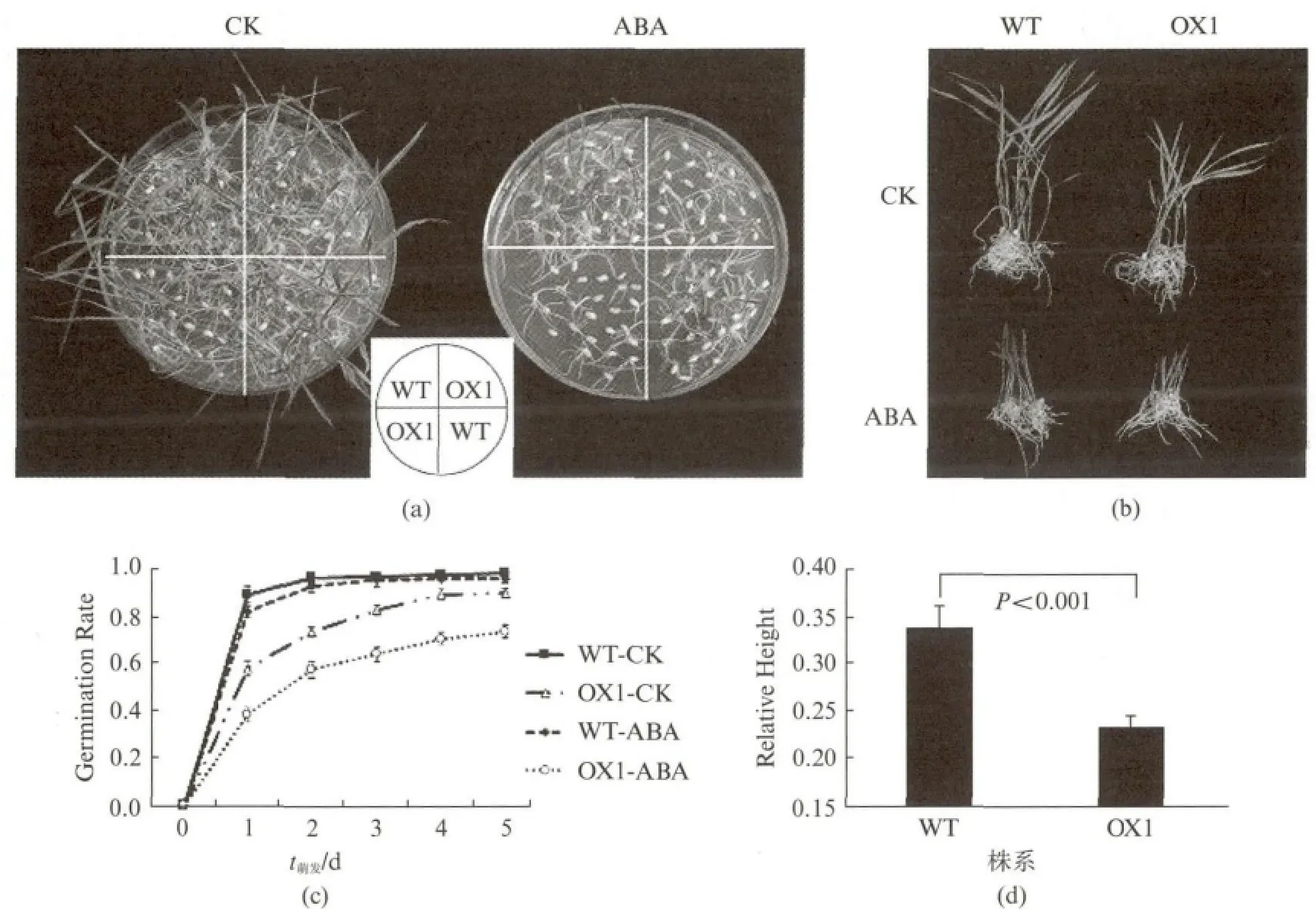
图6 OsMYB84转基因株系OX1与野生型水稻在3μmol/L ABA 处理下的种子萌发情况Fig.6 Seed germination of wild type and OsMYB84transgenic rice OX1under treatment of 3μmol/L ABA
3 讨论
3.1 OsMYB84属于R2R3-MYB亚家族,定位于细胞核内
MYB家族转录因子包含很多基因,功能广泛,参与植物生长发育的各个过程.本研究从水稻中克隆了一个与拟南芥AtMYB84(At3g49690)高度同源的新基因OsMYB84(Os03g0771100),通过同源比对该基因具有两个保守的结构域,R2 和R3,得出OsMYB84 属于R2R3-MYB 亚家族.聚类分析显示OsMYB84与GmMYB84、AtMYB84同源性最高.亚细胞定位结果表明OsMYB84属于核定位蛋白.
3.2 OsMYB84可能通过ABA 信号通路参与水稻耐盐响应
根据Nakashima等的研究,当植物受到高盐等渗透胁迫时,除了启动CBF 和DREB 类调节子的表达,还会启动表达多种激素ABA 合成基因,如ZEP、NCED 等,从而大量积累ABA,并且通过含有ABA响应元件ABRE的调节因子启动下游基因表达[25].而MYB转录因子在植物抗逆胁迫过程中根据是否依赖ABA 信号途径可将其分为依赖于ABA 和独立于ABA 信号通路两类[8].OsMYB84胁迫和激素表达谱分析结果表明,OsMYB84受到NaCl和ABA 的显著诱导.200mmol/L NaCl苗期处理和3μM ABA 萌发实验分别说明OsMYB84 参与了水稻耐盐响应以及ABA 信号通路.另外,我们通过生物信息学网站(http:∥www.dna.affrc.go.jp/PLACE/)预测OsMYB84基因启动中的顺式元件,发现在启动子中含有一个ABA 响应元件ABRELATERD1.因此,我们推测OsMYB84可能通过ABA 信号通路参与水稻耐盐响应.
3.3 OsMYB84基因其他功能的探索
叶枕是在禾本科植物中,在叶片、叶鞘连接处的外侧,具有决定叶倾角发育,影响水稻株高的功能[24].拟南芥中与OsMYB84最为同源的基因AtMYB84基因,当其与其他两个基因AtMYB37、AtMYB38共突变时叶腋发育受到抑制[15],也与侧枝发育相关.OsMYB84器官表达谱结果表明OsMYB84在水稻叶片和根部高表达,原味杂交结果进一步验证OsMYB84在叶片叶枕部位高表达.同时,我们在获得OsMYB84转基因水稻的基础上,比较了OsMYB84过表达与野生型水稻的株高表型,发现过表达水稻的株高要明显比野生型矮.这些结果说明OsMYB84参与了水稻生长,且有可能与叶枕发育有关.但是,OsMYB84参与株高发育的具体机制,尚需更多的实验探索.
根系生长是多种植物激素,如生长素IAA、细胞分裂素CK 等调控的结果[26].在根系发育中,细胞分裂素可以促进植物根系生长并抑制侧根和冠根的起始[27].OsMYB84 激素表达谱分析结果表明,OsMYB84受到6-BA 的诱导,同时器官表达谱和原味杂交的结果表明此基因在根系中高表达,这些结果说明OsMYB84基因极有可能参与了水稻根系发育,而且与细胞分裂素有关.
根据Preston等的研究结果,MYB家族成员AtMYB32调控拟南芥花粉的正常发育[28];Baumann等也发现AtMYB16可以调控细胞和花瓣形态的建成[29].OsMYB84器官表达谱和原位杂交结果表明,此基因在小穗、药室与花粉中高度表达,说明OsMYB84也有可能参与了花器官形态建成和花粉发育过程,但具体的功能以及调控机制尚需实验验证.
[1]Dubos C,Stracke R,Grotewold E,et al.MYB transcription factors in Arabidopsis[J].Trends in Plant Science,2010,15(10):573-581.
[2]Yanhui C,Xiaoyuan Y,Kun H,et al.The MYB transcription factor superfamily of Arabidopsis:Expression analysis andphylogenetic comparison with the rice MYB family[J].Plant Mol Biol,2006,60(1):107-124.
[3]Yan X Y,Li J G,Pei M,et al.Over-expression of a flower-specific transcription factor gene AtMYB24 causes aberrant anther development[J].Plant Cell Reports,2007,26(2):219-228.
[4]Singh K B,Foley R C,Onate-Sanchez L.Transcription factors in plant defense and stress responses[J].Current Opinion In Plant Biology,2002,5(5):430-436.
[5]Yamagishi M,Shimoyamada Y,Nakatsuka T,et al.Two R2R3-MYBgenes,homologs of petunia AN2,regulate anthocyanin biosyntheses in flower tepals,tepal spots and leaves of Asiatic Hybrid Lily[J].Plant and Cell Physiology,2010,51(3):463-474.
[6]Abe H,Urao T,Ito T,et al.Arabidopsis AtMYC2(bHLH)and AtMYB2(MYB)function as transcriptional activators in abscisic acid signaling[J].Plant Cell,2003,15(1):63-78.
[7]Raffaele S,Rivas S,Roby D.An essential role for salicylic acid in AtMYB30-mediated control of the hypersensitive cell death program in Arabidopsis[J].FEBS Letters,2006,580(14):3498-3504.
[8]刘 蕾,杜 海,唐晓凤,等.MYB转录因子在植物抗逆胁迫中的作用及其分子机理[J].遗传,2008,30(10):1265-1271.
[9]Feng C P,Andreasson E,Maslak A,et al.Arabidopsis MYB68in development and responses to environmental cues[J].Plant Science,2004,167(5):1099-1107.
[10]Liao Y,Zou H F,Wang H W,et al.Soybean GmMYB76,GmMYB92,and GmMYB177genes confer stress tolerance in transgenic Arabidopsis plants[J].Cell Research,2008,18(10):1047-1060.
[11]Cominelli E,Galbiati M,Vavasseur A,et al.A guard-cell-specific MYB transcription factor regulates stomatal movements and plant drought tolerance[J].Current Biology,2005,15(13):1196-1200.
[12]Dai X Y,Xu Y Y,Ma Q B,et al.Overexpression of an R1R2R3 MYB gene,OsMYB3R-2,increases tolerance to freezing,drought,and salt stress in transgenic Arabidopsis[J].Plant Physiology,2007,143(4):1739-1751.
[13]Lea U S,Slimestad R,Smedvig P,et al.Nitrogen deficiency enhances expression of specific MYB and bHLH transcription factors and accumulation of end products in the flavonoid pathway[J].Planta,2007,225(5):1245-1253.
[14]Wisman E,Cardon G H,Fransz P,et al.The behaviour of the autonomous maize transposable element En/Spm in Arabidopsis thaliana allows efficient mutagenesis[J].Plant Mol Biol,1998,37(6):989-999.
[15]Muller D,Schmitz G,Theres K.Blind homologous R2R3 Myb genes control the pattern of lateral meristem initiation in Arabidopsis[J].Plant Cell,2006,18(3):586-597.
[16]ACTZC.Semidwarf in rice germplasm collections and their potentials in rice improvement[J].Phytibreedon,1985,1(1):1-9.
[17]Zhu J.Plant salt tolerance[J].Trends Plant Science,2001,6(2):66-71.
[18]Liu C W,Fukumoto T,Matsumoto T,et al.Aquaporin OsPIP1;1promotes rice saltresistance and seed germination[J].Plant Physiology and Biochemistry,2013,63:151-158.
[19]Yoshida S D A F.Routine procedure for growing rice plants in culture solution[M].Laboratory manual for physiological studies of rice.3rded.Los Banos,Laguna,Philippines:The International Rice Research Institute,1976:61-66.
[20]Wang J,Ming F,Pittman J,et al.Characterization of a rice(Oryza sativa L.)gene encoding a temperature-dependent chloroplastω-3fatty acid desaturase[J].Biochemical and Biophysical Research Communications,2006,340(4):1209-1216.
[21]Guo L,Yang H,Zhang X,et al.Lipid transfer protein 3as a target of MYB96 mediates freezing and drought stress in Arabidopsis[J].J Exp Bot,2013,64(6):1755-1767.
[22]Seo P J,Xiang F,Qiao M,et al.The MYB96transcription factor mediates abscisic acid signaling during drought stress response in Arabidopsis[J].Plant Physiol,2009,151(1):275-289.
[23]Seo P J,Lee S B,Suh M C,et al.The MYB96transcription factor regulates cuticular wax biosynthesis under drought conditions in Arabidopsis[J].Plant Cell,2011,23(3):1138-1152.
[24]张所兵,张云辉,林 静,等.水稻无叶枕突变体oslg-h 鉴定及基因定位[J].分子植物育种,2014,12(1):37-42.
[25]Nakashima K,Ito Y,Yamaguchi-Shinozaki K.Transcriptiona lregulatory networks in response to abiotic stresses in Arabidopsis and grasses[J].Plant Physiology,2009,149(1):88-95.
[26]Coudert Y,Périn C,Courtois B,et al.Genetic control of root development in rice,the model cereal[J].Trends in Plant Science,2010,15(4):219-226.
[27]E Z,Ge L,Wang L.Molecular mechanism of adventitious root formation in rice[J].Plant Growth Regulation,2012,68(3):325-331.
[28]Preston J,Wheeler J,Heazlewood J,et al.AtMYB32is required for normal pollen development in Arabidopsis thaliana[J].The Plant Journal,2004,40(6):979-995.
[29]Baumann K,Perez-Rodriguez M,Bradley D,et al.Control of cell and petal morphogenesis by R2R3 MYB transcription factors[J].Development,2007,134(9):1691-1701.
