拟南芥CAS基因的生物信息学分析及超表达载体构建
2015-11-19余璐璐阳敦润曹中权刘龙山
余璐璐,阳敦润,曹中权,刘龙山,罗 璐,徐 飞*,
(武汉生物工程学院 a.应用生物技术研究中心;b.生命科学与技术学院,湖北 武汉 430415)
拟南芥CAS基因的生物信息学分析及超表达载体构建
余璐璐a,阳敦润b,曹中权b,刘龙山b,罗 璐b,徐 飞*a,b
(武汉生物工程学院 a.应用生物技术研究中心;b.生命科学与技术学院,湖北 武汉 430415)
对拟南芥氰丙氨酸合酶(cyanoalanine synthase,CAS)基因进行了生物信息学分析,并构建了CAS合酶基因的超表达载体,以期为其后续功能研究奠定基础。生物信息学分析结果表明,编码拟南芥CAS合酶的CYS-C1和CYS-D1基因均含有10个外显子和9个内含子,定位于3号染色体,而CYS-D2基因有9个外显子和8个内含子,定位于5号染色体;3个基因编码的蛋白氨基酸序列相似度较高,CYS-C1蛋白偏碱性且主要在线粒体中起作用,而CYS-D1和CYS-D2蛋白偏酸性,主要在细胞质中起作用。通过RT-PCR扩增了拟南芥CYS-C1、CYS-D1和CYS-D2基因片段,并构建了超表达载体pBI121-35S-CYS-C1、pBI121-35S-CYS-D1和pBI121-35S-CYS-D2,经检测重组质粒已转化到农杆菌GV3101中。
拟南芥;氰丙氨酸合酶(CAS);超表达载体;生物信息学
氰丙氨酸合酶(cyanoalanine synthase,CAS)是植物解氰作用的关键酶[1],其底物之一氰化氢(hydrogen cyanide,HCN)是植物体内广为存在的一种内源性小分子类代谢产物。HCN可抑制线粒体呼吸链中的细胞色素c氧化酶的活性,因而HCN对于生物体来说有很强的毒性[2-5]。但值得关注的是,植物具有产HCN并耐HCN的特性。以往的研究者分析一方面是因为植物体内存在一条由交替氧化酶(alternative oxidase,AOX)介导的抗氰呼吸途径(cyanide-resistance respiration pathway),可减轻HCN对呼吸链的抑制作用[3-4];另一方面,HCN会诱导CAS合酶的活性,从而可将HCN降低到安全浓度范围内[5-6]。
有研究表明拟南芥中存在CYS-C1(At3g61440)、CYS-D1(At3g04940)和CYS-D2(At5g28020)3个编码CAS合酶蛋白的基因,其中CYS-C1基因表达量最多[7]。从作用部位来看,CYS-C1蛋白在线粒体中表达,而CYS-D1和CYS-D2蛋白在细胞质中表达[8]。值得关注的是,HCN伴随乙烯的合成发生在细胞质中[5],但分解HCN的CAS合酶主要存在于线粒体,这一重要结论暗示CAS合酶的作用很可能是为了减轻HCN对线粒体呼吸链的抑制,而非彻底清除HCN。此外,近年来还有研究表明,植物细胞能利用内源HCN调控一些重要的生理过程,如种子萌发[9]、开花诱导[10]等,同时在植物抗虫抗病反应过程中也有重要作用[11-12]。因此,植物在解HCN与利用内源HCN存在一个平衡机制,关键在于对不同时期和部位CAS活性的调控。但是,植物调控CAS活性的机理仍不明确,尤其是在植物响应逆境胁迫反应的过程中。
因此,笔者试图通过生物信息学的方法分析拟南芥CAS基因的结构特点、氨基酸的组成、蛋白的亚细胞定位及时空表达模式,并构建CAS基因的超表达载体,为今后进一步研究CAS基因家族成员的功能及对植物细胞内源性HCN的调控机理奠定基础。
1 材料与方法
1.1 拟南芥CAS基因生物信息学分析
拟南芥CAS基因结构利用在线分析工具Gene Structure Display Server(GSDS,http://gsds1.cbi.pku.edu. cn/index.php)进行分析;基因染色体定位利用NCBI数据库的Mapviewer进行了在线分析;氨基酸序列分析及同源进化树构建分别利用Vector NTI 11.5和MEGA 5.2软件进行分析;CAS基因家族亚细胞定位和蛋白成员理化性质分析分别使用WolfPSORT(http://psort.hgc.jp/)和ProtParam(http://web.expasy.org/protparam/)进行预测分析;拟南芥CAS基因的时空表达模式则利用Genevestigator进行在线分析。
1.2 拟南芥CAS基因超表达载体构建
1.2.1 试验材料 拟南芥种子(野生型,Col)购自ABRC(Arabidopsis Biological Resource Center)种子库。拟南芥种子用清水浸种1 d,然后用0.1 mol/L KMnO4消毒5 min后播种在含营养土和蛭石(1:1)的培养基质上,同时施以1/2 Hoagland营养液。培养30 d后幼苗用于实验。
1.2.2 拟南芥总RNA的提取及质量检测 拟南芥总RNA的提取采用Trizol(Invitrogen公司)试剂。RNA的完整性及其纯度分别通过1%琼脂糖凝胶电泳和紫外分光光度计(TU-1800)测定OD260/OD280的光密度比值进行检测分析。
1.2.3 CAS基因的克隆及质粒DNA(pBI121)的提取 将mRNA通过反转录试剂盒(Fermentas公司)合成第一链cDNA后,利用设计的特异性引物(见表1)进行PCR扩增。PCR反应条件为:94℃预变性5 min;接下来是35个扩增循环;94℃变性50 s;49℃退火45 s;72℃引物延伸1 min 30 s;最后在72℃条件下反应10 min,终止反应。将产物纯化回收后送往上海生工生物工程有限公司进行基因测序。pBI121质粒DNA的提取参照质粒提取试剂盒(Takara公司)完成。提取后的质粒DNA保存于-20℃冰箱备用。
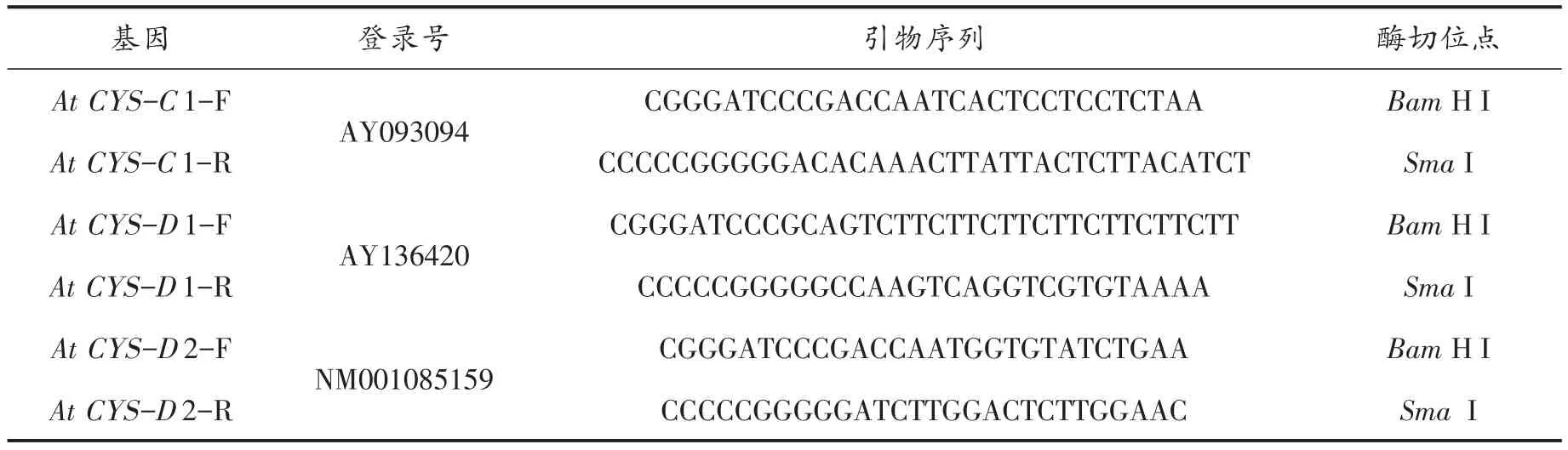
表1 基因扩增引物列表Tab.1 Primers used for genes amplification
1.2.4 重组质粒的构建 用BamH I和SmaI对目的基因和表达载体pBI121分别进行双酶切,回收目的片段后,用T4 DNA连接酶进行连接反应。连接后的载体分别命名为pBI121-35S-CYS-C1、pBI121-35SCYS-C2和pBI121-35S-CYS-D2。载体构建如图1所示。
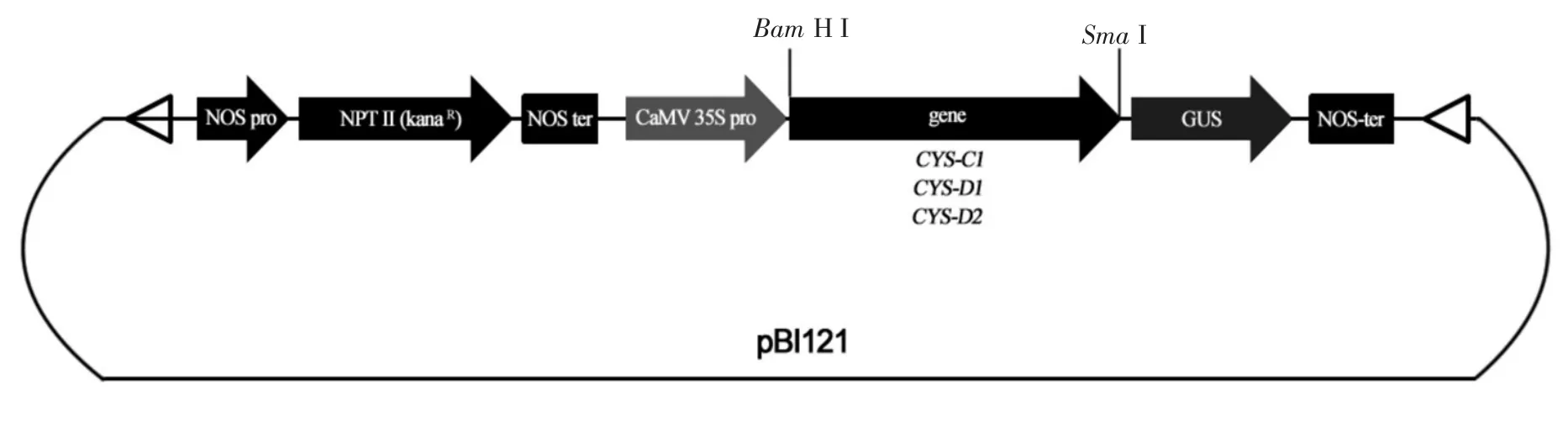
图1 CAS基因超表达载体构建示意图Fig.1 Schematic diagrams ofCASgenes over-expression vectors
1.2.5 重组质粒的转化与鉴定 将重组质粒转化到农杆菌GV3101感受态细胞中,并在含100 μg/mL Kana抗生素的平板上(28℃)培养2 d后筛选阳性克隆。挑选阳性单克隆菌落用YEB摇菌培养12 h后,取菌液并提取质粒进行PCR检测分析。
2 结果与分析
2.1 拟南芥CAS基因生物信息学分析
2.1.1 拟南芥CAS基因结构分析 利用在线分析工具Gene Structure Display Server(GSDS,http://gsds1. cbi.pku.edu.cn/index.php)对拟南芥CAS基因结构进行分析,结果如图2所示,CYS-C1和CYS-D1基因有10个外显子和9个内含子,CYS-D2基因有9个外显子和8个内含子。

图2 拟南芥CAS基因结构分析Fig.2 CASgenes structure analysis ofarabidopsis
2.1.2 拟南芥CAS基因的染色体定位分析 为进一步了解拟南芥CAS基因在染色体上的定位,利用NCBI数据库的Mapviewer进行了在线分析,结果如表2和图3所示。从图3中可以看出,拟南芥CYS-C1和CYS-D1基因定位于3号染色体,CYS-D2基因定位于5号染色体。

表2 拟南芥CAS基因的染色体定位信息Tab.2 Locus information ofCASgene family inarabidopsischromosome

图3 拟南芥CAS基因的染色体定位图谱Fig.3 Mapview ofCASgenes families inarabidopsischromosome
2.1.3 拟南芥CAS基因同源比对及进化树构建 利用Vector NTI 11.5软件对CYS-C1、CYS-D1和CYS-D2蛋白氨基酸序列进行了比对分析表明,CYS-C1、CYS-D1和CYS-D2的氨基酸序列相似度较高,尤其是在97~128、200~250和302~348区间(见图4)。

图4 拟南芥CAS基因家族氨基酸序列比对结果Fig.4 Blast results ofCASgenes inarabidopsis
此外,从NCBI找到已知CAS基因序列的物种,并与拟南芥CAS基因家族蛋白进行同源比对后,利用MEGA5.2软件构建的系统进化树(见图5)。由图5可以看出,拟南芥CYS-C1与黄瓜的亲缘关系较近,而CYS-D1和CYS-D2与盐芥的亲缘关系较近。
2.1.4 拟南芥CAS基因的亚细胞定位预测分析 拟南芥CAS基因家族亚细胞定位使用WolfPSORT(http://psort.hgc.jp/)进行预测。结果如图6所示,拟南芥CYS-C1蛋白定位于线粒体,而CYS-D1和CYS-D2蛋白主要定位于细胞质,其次是定位于过氧化物酶体。这些结果表明CYS-C1蛋白应该是参与保护线粒体呼吸链(减轻HCN对呼吸链的抑制),CYS-D1蛋白和CYS-D2蛋白可能是代谢HCN(使其降低至安全浓度范围内)。
2.1.5 拟南芥CAS家族成员蛋白的理化性质分析 使用ProtParam(http://web.expasy.org/protparam/)对拟南芥CAS家族成员蛋白进行了理化性质分析,结果见表3。从3表中可以看出,拟南芥CAS家族成员蛋白大小相差不大,其中最大的CYS-C1蛋白氨基酸长度为368,分子量为39.93 ku。从理论等电点数据来看,CYS-C1蛋白偏碱性(PI=8.71),而CYS-D1(PI=5.23)和CYS-D2(PI=5.74)蛋白偏酸性。此外,蛋白不稳定性分析显示,拟南芥CAS家族成员蛋白的不稳定指数在20~33之间,未超过临界值(大于40被认为不稳定),表明CAS家族成员蛋白稳定性较好。其次,从表3中所显示各成员的平均亲水性来看,CYS-C1和CYS-D1的亲水性为负值,表明均是亲水性蛋白,即可溶性蛋白。CYS-D2的亲水性值为0.079,表明其是疏水性蛋白,不过数值并不太高,推测其应是微溶于水。

图5 CAS基因的同源进化树分析Fig.5 Phylogenetic analysis ofCASgenes
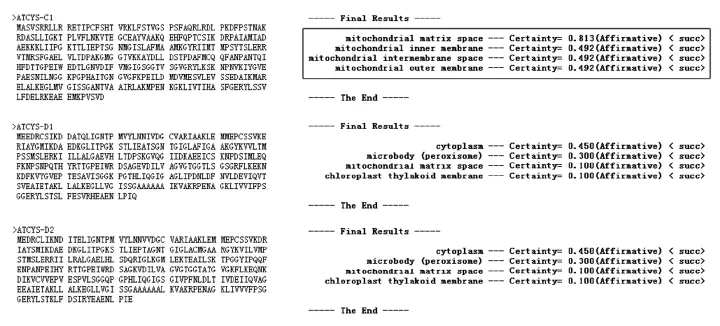
图6 拟南芥CAS基因的亚细胞定位分析Fig.6 Subcellular locus analysis ofCASgenes inarabidopsis
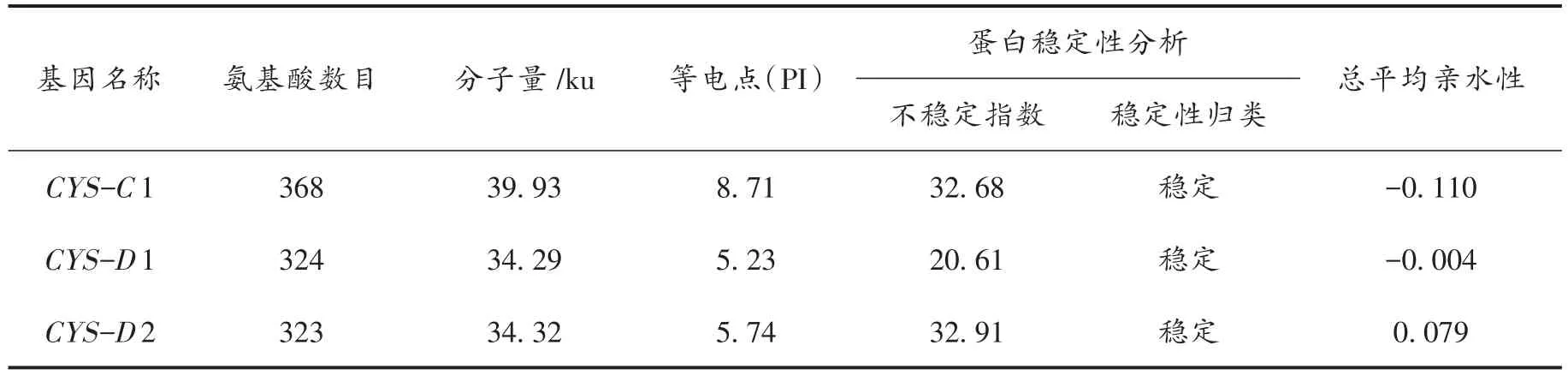
表3 拟南芥CAS家族成员蛋白理化性质分析Tab.3 Analysis on physical and chemical properties ofCASgenes families inarabidopsis
2.1.6 拟南芥CAS基因的时空表达模式分析 利用Genevestigator在线分析拟南芥CAS基因的时空表达模式。如图7所示,拟南芥CYS-C1基因在萌芽和生长、发育阶段表达量均较高。相比之下,CYS-D1和CYS-D2的表达量相当,且在拟南芥种子成熟以前均低于CYS-C1基因的表达。在种子成熟时期,3个基因的表达量均明显下降,且几乎处于同一水平。
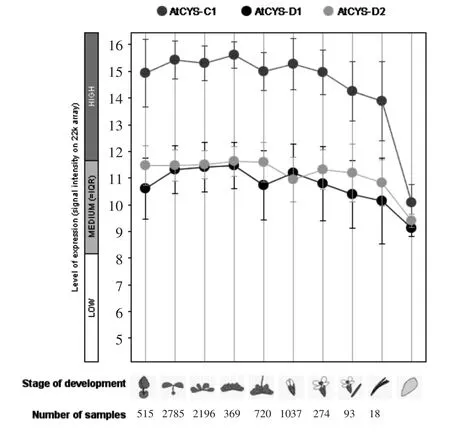
图7 拟南芥CAS基因的时空表达模式Fig.7 CASgenes expression of different stage inarabidopsis
2.2 拟南芥CAS基因的超表达载体构建
2.2.1 拟南芥CAS基因的克隆及pBI121质粒DNA的提取 结果见图8,从图8(a)可以看出,本实验提取的RNA质量较好,电泳条带清晰;紫外分光光度计测定后计算RNA的光密度比值OD260/OD280=1.92,表明提取的RNA无杂蛋白污染。图8(b)显示RT-PCR扩增的基因条带清晰,特异性强。PCR产物回收后进行基因检测可知CYS-C1、CYS-D1和CYS-D2基因分别为1 200、1 070和970 bp大小的片段。此外,从图8(c)可以看出,pBI121质粒DNA提取质量较好,无明显蛋白质等杂质污染。
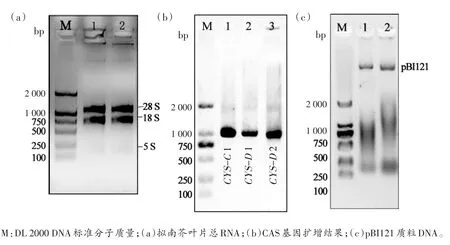
图8 拟南芥CAS基因的扩增及质粒DNA的提取Fig.8 CASgenes amplification and pBI121 plasmid DNA extraction inarabidopsis
2.2.2 重组质粒的构建及筛选鉴定 菌液用于重组质粒鉴定,检测结果如图9中(a)~(c)所示,重组质粒pBI121-35S-CYS-C1、pBI121-35S-CYS-D1和pBI121-35S-CYS-D1均扩增出了与目的基因相同大小的片段,表明挑选的菌斑均为阳性克隆。
此外,将重组质粒进行琼脂糖凝胶电泳后显示,重组质粒明显大于pBI121空质粒(见图9(d)),从而进一步表明CYS-C1、CYS-D1和CYS-D2基因已成功连接至pBI121表达载体中。

图9 重组质粒的鉴定Fig.9 Identification of recombinant plasmids
3 讨论
氰化物可抑制细胞色素氧化酶的活性,从而抑制线粒体呼吸作用。尽管植物线粒体呼吸链中存在一条抗氰呼吸途径,但植物细胞不能长期适应高浓度内源氰化物的存在,因此解氰作用对于植物细胞维持正常物质和能量代谢,有着重要的意义[3]。
近年来,国内外的研究发现氰化物在种子萌发[9]、植物抗病[12-14]等反应中起重要作用,这表明植物在解氰与利用内源氰化物之间存在着某种平衡机制,但植物调控CAS合酶活性的机理仍不明确。笔者通过生物信息学研究发现,拟南芥CAS基因家族成员表达量和亚细胞分布不尽相同。CYS-C1基因表达量最多,蛋白偏碱性(PI=8.71),为亲水性蛋白;CYS-D1和CYS-D2基因表达量较少,蛋白均偏酸性,其中CYS-D1为亲水性蛋白,CYS-D2为疏水性蛋白。从蛋白作用部位来看,CYS-C1作用部位为线粒体,而CYS-D1和CYS-D2作用部位主要为细胞质。这些结果表明,CYS-C1在减轻氰化物(尤其是HCN)对线粒体呼吸链的抑制作用中扮演主要角色。
HCN伴随乙烯的合成发生在细胞质[15],但解氰作用的CAS合酶主要存在于线粒体(CYS-C1),这也再次表明CAS的活性应是保护线粒体呼吸链的正常运转,而非彻底清除HCN(细胞质中的CYS-D1和CYS-D2表达量较少),细胞质中残留的低浓度HCN应该是促进种子萌发和增强植物抗病的关键因素之一。因此,笔者通过构建CAS基因超表达载体,以期进一步研究CAS基因的功能。经菌液PCR和质粒大小分析,本实验已成功构建了CYS-C1、CYS-D1和CYS-D2基因的超表达载体pBI121-35S-CYS-C1、pBI121-35S-CYS-D1和pBI121-35S-CYS-D2。实验中所用的质粒载体pBI121具有在真核生物中高表达的启动子CaM35S和易检测的报告基因GUS。将目的基因连接在GUS基因前面,使其在植物中整合表达,便于今后对基因进行准确的亚细胞定位,及时空表达研究检测分析。此外,拟南芥CAS家族3个基因的重组质粒已成功转化到农杆菌GV3101中,这为后续基因功能的相关研究奠定了基础。
(
)
[1]梁五生,毛碧增,李德葆.叶片中氰丙氨酸合成酶活性的测定[J].植物生理学通讯,2001,37(2):140-142.
[2]XU F,YUAN S,ZHANG D W,et al.The role of alternative oxidase in tomato fruit ripening and its regulatory interaction with ethylene[J].Journal of Experimental Botany,2012,63:5705-5716.
[3]XU F,ZHANG D W,ZHU F,et al.A novel role for cyanide in the control of cucumber(Cucumis sativus L.)seedlings response to environmental stress[J].Plant Cell and Environment,2012,35:1983-1997.
[4]ZHANG D W,XU F,ZHANG Z W,et al.Effects of light on cyanide-resistant respiration and alternative oxidase function in arabidopsis seedlings[J].Plant Cell and Environment,2010,33:2121-2131.
[5]YIP W K,YANG S F.Cyanide metabolism in relation to ethylene production in plant tissues[J].Plant Physiology,1988,88(2):473-476.
[6]HATZFLD Y,MARUYAMA A,SCHMIDT A,et al.β-cyanoalanine synthase is a mitochondrial cysteine synthase-like protein in spinach and Arabidopsis[J].Plant Physiology,2000,123(3):1163-1172.
[7]WATANBE M,KUSANO M,OIKAWA A,et al.Physiological roles of the beta-substituted alanine synthase gene family in Arabidopsis[J].Plant Physiology,2008,146(1):310-320.
[8]GARCIA I,CASTELLANO J M,VIOQUE B,et al.Mitochondrial β-cyanoalanine synthase is essential for root hair formation in Arabidopsis thaliana[J].Plant Cell,2010,22(10):3268-3279.
[9]GNIAZDOWSKA A,KRASUSKA U,BOGATEK R.Dormancy removal in apple embryos by nitric oxide or cyanide involves modifications in ethylene biosynthetic pathway[J].Planta,2010,232(6):1397-1407.
[10]GARCIA I,ROSAS T,BEJARANO E R,et al.Transient transcriptional regulation of theCYS-C1gene and cyanide accumulation upon pathogen infection in the plant immune response[J].Plant Physiology,2013,162(4):2015-2027.
[11]CHIVASA S,CARR J P.Cyanide restores N gene-mediated resistance to tobacco mosaic virus in transgenic tobacco expressing salicylic acid hydroxylase[J].Plant Cell,1998,10(9):1489-1498.
[12]SEO S,MITSUHARA I,FENG J,et al.Cyanide,a coproduct of plant hormone ethylene biosynthesis,contributes to the resistance of rice to blast fungus[J].Plant Physiology,2011,155(1):502-514.
[13]LIAO Y W K,SHI K,FU L J,et al.The reduction of reactive oxygen species formation by mitochondrial alternative respiration in tomato basal defense against TMV infection[J].Planta,2012,235:225-238.
[14]WONG CE,CARSON R A J,CARR J P.Chemically induced virus resistance inArabidopsis thalianais independent of pathogenesis-related protein expression and the NPR1 gene[J].Molecular Plant-Microbe Interactions,2002,15:75-81.
[15]SIEGIEN I,BOGATEK R.Cyanide action in plants-from toxic to regulatory[J].Acta Physiologiae Plantarum,2006,28(5):483-497.
(责任编辑:胡燕梅)
Bioinformatics Analysis and Over-Expression Vectors Construction ofCASGenes in Arabidopsis
YU Lulua,YANG Dunrunb,CAO Zhongquanb,LIU Longshanb,LUO Lub,XU Fei*a,b
(a.Center of Applied Biotechnology;b.College of Life Science and Biotechnology,Wuhan Bioengineering Institute,Wuhan 430415,Hubei,China)
TheCASgenes were analyzed by bioinformatics methods and over-expression vectors ofCAS genes were constructed.Bioinformatics analysis show thatCYS-C1andCYS-D1have ten exons and nine introns,whileCYS-D2has nine exons and eight intron.CYS-C1andCYS-D1locate at chromosome 3 whileCYS-D2locates at chromosome 5.Furthermore,the amino acid sequences ofCASgenes share a high similarity.However,CYS-C1is basic protein and functions at mitochondria,whereasCYS-D1and CYS-D2are acidic protein and function at cytoplasm.The over-expression vectors of pBI121-35SCYS-C1,pBI121-35S-CYS-D1and pBI121-35S-CYS-D2were constructed,and the recombinant plasmids were transformed into agrobacterium GV3101.
arabidopsis;cyanoalanine synthase(CAS);over-expression vector;bioinformatics
Q71;Q782
A
1673-0143(2015)02-0150-08
10.16389/j.cnki.cn42-1737/n.2015.02.010
2014-11-13
国家自然科学基金项目(31400242);武汉生物工程学院应用校本研究项目(2014K29)
余璐璐(1984—),女,助教,硕士,研究方向:植物生理生态。
*通讯作者:徐 飞(1985—),男,讲师,博士,研究方向:植物生理与分子生物学。Email∶feixu666@hotmail.com
