口服蛋氨酸造成的大鼠肾间质纤维化模型及其机制研究
2015-11-19福建医科大学实验动物中心福建师范大学南方生物医学研究中心福州铁路公安处刑事技术支队
1.福建医科大学实验动物中心 2.福建师范大学南方生物医学研究中心 3.福州铁路公安处刑事技术支队
王成艳1 赵东岳2 胡兴亚3
肾小管间质纤维化(Renal Interstitial Fibrosis, RIF)是由多种原因引起的细胞外基质(Extracellular matrix, ECM)成分在肾间质过度沉积,它几乎是各种肾脏疾病进展到终末期肾衰竭的共同途径和主要病理基础[1]。众多细胞因子及致纤维化介质参与了肾纤维化过程,但肾小管间质纤维化的具体发生机制目前尚不十分明确,研究证实小管上皮-肌成纤维细胞转化(Epithelial-Mesenchymal Transition, EMT)在肾间质纤维化中发挥重要作用[2-4],其中α-SMA是EMT的标志蛋白[5]。E-cad 是肾小管上皮细胞表型特异性标志物,研究证实,E-cad表达的下降在肾小管上皮转分化过程中起重要作用[6]。
同型半胱氨酸 (Homocysteine, Hcy)是蛋氨酸的中间代谢产物,是一种含硫氨基酸,Hcy在体内以蛋白结合型和游离型两种形式存在,通过肾脏代谢和排泄。目前Hcy在心血管疾病及神经病变中研究较多,在肾脏病领域主要集中于血液透析患者。体内体外的研究表明,Hcy与肾小球纤维化密切相关[7],Hcy能显著促进肾小球细胞的增殖[8],但 Hcy与肾间质纤维化有无关系却罕有报导。叶酸(Folic acid,FA)是B族维生素的一种,是蛋氨酸循环的重要辅助因子。研究发现,FA能下调肾脏病变患者体内Hcy的浓度[9]。
对于EMT是否参与Hcy诱导的肾间质损伤以及叶酸能否对这一损伤有治疗作用尚不可知。本研究通过口服蛋氨酸观察是否造成肾间质纤维化病变,并以肾小管上皮细胞HK-2为载体,观察Hcy对其短期增殖以及细胞活力的影响,并检测EMT相关蛋白的表达以研究EMT是否参与此过程,摸索建立新的大鼠肾间质纤维化模型。
1 材料与方法
1.1 实验动物
雄性SD大鼠24只,体重90 ~120g,清洁级,购于福建医科大学实验动物中心。随机分为control组8只,蛋氨酸组8只,蛋氨酸+叶酸组8只。
1.2 主要试剂
小鼠抗人α-平滑肌肌动蛋白单克隆抗体、小鼠抗人E-钙连接蛋白单克隆抗体及小鼠抗人β-actin单克隆抗体,购于Santa Cruz Biotechnology公司;辣根过氧化物酶标记抗小鼠抗体(Evision Two-Step™ Anti-mouse Detection Reagent,HRP),购自 Antibody Diagnostica Inc;二甲基亚砜(Dimethyl sulfoxide, DMSO),购于Sigma-Aldrich公司;Masson三色染色试剂盒,购自福州迈新生物技术开发有限公司。CellTiter 96RAqueous One Solution试剂盒购于Promega公司。
1.3 模型制备及样本留取
大鼠分为对照组、蛋氨酸组、蛋氨酸+叶酸组,每组8只。对照组:灭菌水溶液;蛋氨酸组、蛋氨酸+叶酸组分别按1 g/kg·d、1 g/ kg·d Met +100 mg/ kg·d FA的剂量,每日灌胃1次,共120天。造模结束后留取腹主动脉血,制备血浆,处死动物。切取一侧肾脏组织,称重,-80℃保存;切取另一侧肾脏的1/3用4%的中性甲醛固定,脱水,石蜡包埋,4℃保存备用。
1.4 血浆同型半胱氨酸浓度测定
全自动生化分析仪检测已制备的血浆中Hcy浓度。
1.5 Masson染色
石蜡切片4 μm厚,常规脱蜡,按Masson三色染色试剂盒完成染色。
1.6 MTT法测定细胞增殖
收集对数期生长细胞,调整细胞密度,以2×104/孔接种于96孔板,置于37℃,5% CO2培养箱培养使细胞贴壁,细胞汇合度达70%以上时,加入不同浓度的Hcy或Hcy+ FA,处理68 h,每孔加入MTS/PMS(20:1)混合液20 μL,继续培养4 h,终止培养,在酶联免疫检测仪490 nm处测量各孔的吸光值,绘制细胞生存曲线。
1.7 组织蛋白的提取
剪取一小块肾脏组织,放入研钵内,冰上研磨,加入适量RIPA裂解液裂解20 min,收集裂解液,4 ℃,14000 rpm × 10 min离心,取上清液。-80℃保存,Western blot法检测E-cad的表达。
1.8 Western blot法检测α-SMA、E-cad的表达
以2×105/mL的密度接种细胞,待细胞贴壁后,以Hcy200,Hcy400,Hcy400 +不同浓度FA处理细胞,24h后收集细胞,RIPA裂解液裂解,超声破碎,Bio-RAD蛋白检测试剂盒测定蛋白浓度,跑SDS-PAGE,250mA恒流湿转蛋白于NC膜上,5%脱脂奶粉封闭1 h,α-SMA一抗(1:200)或E-cad一抗(1:1000)孵育过夜后,回收一抗,PBST洗三次,二抗孵育1 h,PBS洗两次,PBST洗一次,曝光。
2 结果
2.1 三组大鼠的体重测定
随机分组后,每隔两周测定大鼠的体重,记录整理,发现蛋氨酸组大鼠的体重较对照组有所降低(见图1)。
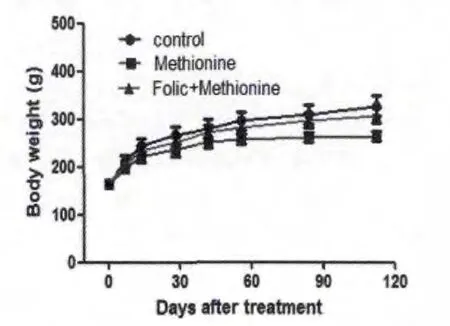
图1 各组大鼠体重变化图
2.2 对照组、蛋氨酸组、蛋氨酸+叶酸组血浆Hcy浓度测定
处死大鼠后,抽血制备血浆,通过生化分析仪检测发现,蛋氨酸组能引起高同型半胱氨酸血症,而蛋氨酸+叶酸组却能明显降低血Hcy的浓度,两组比较差异有统计学意义(p<0.05),见图2。
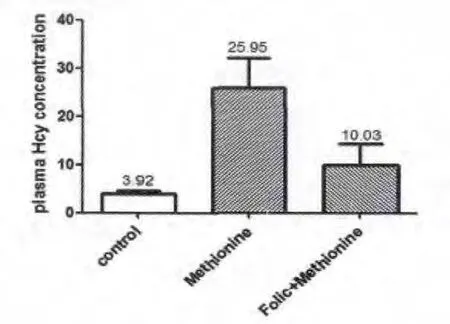
图2 血浆Hcy浓度测定
2.3 肾脏组织病理
造模结束后,行肾脏组织固定、切片,进行Masson染色。光镜下可见对照组大鼠肾组织无明显病理改变,蛋氨酸组可见间质明显的蓝色沉积,蛋氨酸+叶酸组可见较弱的间质蓝染。用Image-Pro Plus program 程序测定纤维化面积,以百分比表示,差异有统计学意义(见图3)。
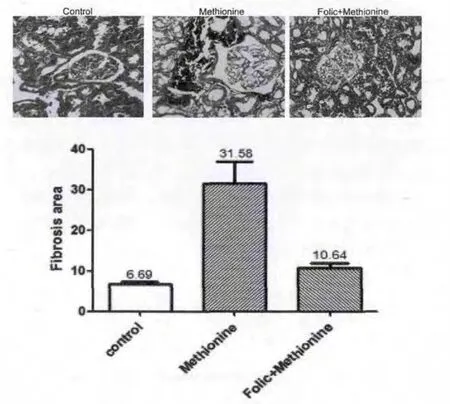
图3 造模结束后,各组大鼠光镜观察肾间质纤维化程度比较(×400)以及纤维化面积测定
2.4 E-cad在组织中的表达
Western blot结果显示,蛋氨酸组,蛋氨酸+叶酸组肾脏组织中E-cad的表达显著低于control组,见图4。
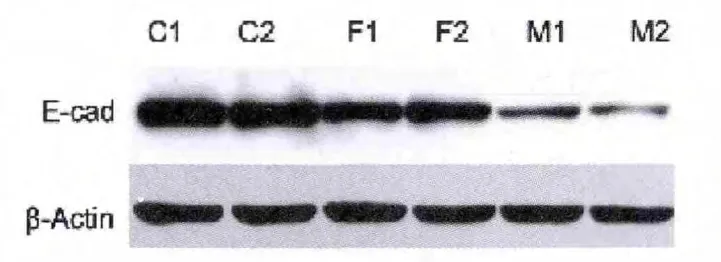
图4 组织中的表达
2.5 细胞活力的测定
MTS结果可见,Hcy能显著增强HK-2细胞的增殖,与对照组相比,细胞活力明显增强,呈现剂量依赖性(图5)。当Hcy浓度达到400 μmol/L时,细胞活力增强明显(p<0.01),故选此浓度为实验浓度。
在400 μmol/L Hcy处理下,联合不同浓度的FA处理,可见随着FA作用量的加大,细胞活力逐渐下调(图5)。
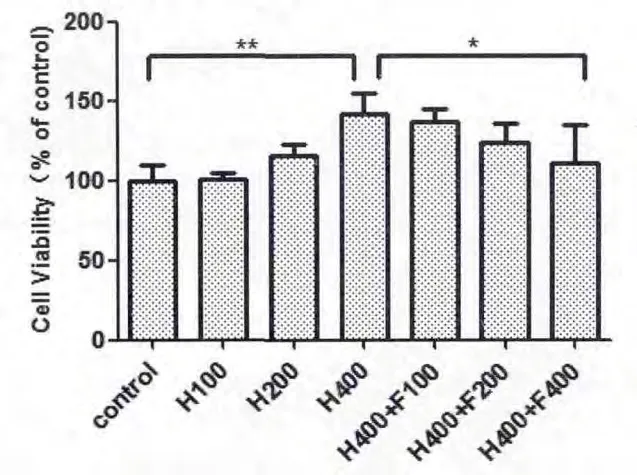
图5 MTS法检测细胞活力
H400组与control组相比,p< 0.05;H400+F400组与H400组相比,p< 0.05,差异有统计学意义。
2.6 Hcy浓度依赖性地下调E-cad、上调α-SMA的表达
Western blot结果显示,Hcy处理后,随着剂量的增加,E-cad的表达逐渐下调(图6);而单用Hcy时,α-SMA的表达显著增加,呈浓度依赖性(图6)。

图6 Western blot检测HK-2细胞中E-cad、α-SMA的表达
2.7 FA抑制Hcy诱导的E-cad、α-SMA的表达
Western blot结果显示,FA与Hcy联合处理下,与Hcy 400 μmol/L相比,E-cad的表达在不同浓度FA刺激下又重新上调(图6);α-SMA蛋白水平则随着FA浓度增加而不断下调(图6)。
3 讨论
Hcy是致动脉粥样硬化的独立危险因子,参与糖尿病肾病的发生发展过程[10],据文献报道,在慢性肾脏病患者中约80%存在不同程度的高半胱氨酸血症,大约是正常人群的39倍[11]。研究显示,口服蛋氨酸诱导的高同型半胱氨酸血症可诱导肾小球纤维化,血中半胱氨酸的浓度可升至约30 μmol/L,而补充叶酸治疗可减轻肾小球的损害,提示Hcy参与肾小球纤维化的过程[7]。Ingram等证实增加Hcy的水平最终能引起肾脏的硬化[12],这一结果提示我们Hcy可能参与肾间质损伤。我们给予口服蛋氨酸诱导的高同型半胱氨酸血症可诱导肾小管间质纤维化,血中同型半胱氨酸的浓度可升至约25.95 μmol/L,而补充叶酸治疗可减轻肾间质的损害,提示Hcy参与肾间质纤维化的过程。本实验中,我们观察到Hcy的水平与细胞活力的增强,α-SMA的表达增高以及E-cad的表达下调是一致的,而叶酸干预可以降低细胞活力和α-SMA的表达。故推测血浆Hcy参与肾小管间质纤维化的机制如下:(1)Hcy促进肾脏小管上皮细胞的不断增殖,上皮细胞的活化产生大量的细胞外基质(ECM),形成纤维化。(2)Hcy促进肾小管- 间质细胞转分化表达α-SMA且降低E-cad的表达,这是肾纤维化进行性发展的关键环节,α-SMA可作为评价肾小管-间质损伤的细胞表型标志和预后的标志。
叶酸(Folic Acid, FA)又称蝶酰谷氨酸,由喋啶核、对氨苯甲酸及谷氨酸三部分组成。叶酸是Hcy代谢途径中蛋氨酸合成酶的辅助因子,是最有效降低Hcy水平的单一抑制剂[13]。故本实验选择了叶酸作为干预药物。本实验观察到叶酸减低了血浆Hcy的水平,下调了α-SMA的表达,抑制了细胞增殖,减轻了肾纤维化的程度,进一步提示我们血浆Hcy水平与间质纤维化程度有关,其导致纤维化的机制与小管上皮细胞增殖及肾小管上皮-间充质转化有关。
本实验结果显示,口服蛋氨酸可以通过提高血浆Hcy水平来诱导肾间质纤维化,Hcy能诱导肾小管上皮细胞的增殖,推测Hcy导致肾损伤的一个可能的机制是α-SMA的过表达以及E-cad表达的进行性减低,提示肾小管上皮细胞的转分化,最终导致EMT的发生。叶酸能有效保护Hcy诱导的HK-2细胞增殖。
[1]Higgins D.F, Kimura K, Iwano M, et.al.Hypoxia-inducible factor signaling in the development of tissue fibrosis[J].Cell Cycle, 2008(7):1128-1132.
[2]Kriz W, Kaissling B, Le Hir M, Epithelial-mesenchymal transition (EMT) in kidney fibrosis: fact or fantasy? [J].J Clin Invest, 2011(121): 468-474.
[3]Yeh Y, Wei W,Wang Y, et.al.Transforming Growth Factor-β1 Induces Smad3-Dependent β1 Integrin Gene Expression in Epithelial-to-Mesenchymal Transition during Chronic Tubulointerstitial Fibrosis[J].Am J Pathol, 2010,177(4):1743-1754.
[4]Rosemarie M, Wang C, Phillip K.The role of EMT in renal fibrosis[J].Cell and Tissue Res, 2012 ,347(1):103-116.
[5]Steenvoorden M.M, Tolboom T.C, vander Pluijm G, et.al.Transition of healthy to diseased synovial tissue in rheumatoid arthritis is associated with gain of mesenchymal/fibrotic characteristics[J].Arthritis Res Ther, 2006(8):R165.
[6]陆海英, 张悦, 刘煜敏.a-平滑肌肌动蛋白和E-钙依赖性粘附素在肾间质纤维化大鼠肾组织中的表达[J].中国病理生理学杂志, 2009, 25(4): 795-798.
[7]Lu C, Lou X Y, Zou Z X, et,al.Folic acid attenuates hyperhomocyseinemiainduced glomerular damage in rats[J].Microvasc Res,2013(89): 146-152.
[8]曹露,娄晓盈,牟娜娜,等.叶酸抑制同型半胱氨酸诱导的人肾脏系膜细胞增殖[J].成都医学院学报,2013,8(2): 149-151.
[9]王会芹,郭宏,赵慧.叶酸、维生素B6和维生素B12对高同型半胱氨酸血症大鼠心室重构的影响[J].中国全科医学,2013(3): 275-279.
[10]Zoccali C and Jager K.J, Hyperhomocysteinemia: a renal and cardiovascular risk factor? [J].Nephrology,2010,6(12):695-696.
[11]Kumagai H, Katoh S, Hirosawa K., et.al.Renal tubulointerstitial injury in weanling rats with hyperhomocysteinemia[J].Kidney Int, 2002(62):1219-1228.
[12]Ingram AJ, Krepinsky JC, James L, et al.Activation of mesangial cell MAPK in response to homocysteine[J].Kidney International, 2004, 66(2):733-745.
[13]Arnadottir M, Gudnason V, Hultberg B, Treatment with different doses of folic acid in haemodialysis patients: effects on folate distribution and aminothiol concentrations[J].Nephrol Dial Transplant, 2000(15): 524-528.
