水质条件对膜-羧基官能团之间微观作用力的影响特征
2015-11-19王旭东吕永涛西安建筑科技大学环境与市政工程学院陕西西安710055
王 磊,田 莉,苗 瑞,王旭东,吕永涛 (西安建筑科技大学环境与市政工程学院,陕西 西安 710055)
水质条件对膜-羧基官能团之间微观作用力的影响特征
王 磊*,田 莉,苗 瑞,王旭东,吕永涛 (西安建筑科技大学环境与市政工程学院,陕西 西安 710055)
为了探讨pH值、离子强度及膜材料对膜-污染物间相互作用力的影响特征,利用自制的典型膜污染物羧基官能团胶体探针,结合原子力显微镜定量考察了羧基官能团与PVDF及EVOH超滤膜间的相互作用力随pH值及离子强度的变化特征.结果表明:带有羧基基体的污染物与PVDF及EVOH超滤膜之间的相互作用力皆随着pH值的增大而减小;但是上述作用力随着离子强度的增加呈现特殊的变化趋势:在离子强度为0~10mmol/L时,膜-带有羧基基体的污染物之间相互作用力随着离子强度的增加而增大;在离子强度为10~500mmol/L时,膜-羧基之间相互作用力随着离子强度的增大而减小.在特定的水质条件下,EVOH-羧基间的作用力远小于PVDF-羧基之间的作用力.
膜污染;胶体探针;相互作用力;膜材料;水质条件
随着超滤技术在水处理领域的日益推广应用,缓减水中的溶解性有机物引起的膜污染问题受到普遍关注[1-3].最近膜污染研究者发现,在超滤膜运行过程中,运行初期膜-污染物之间的作用力是决定膜污染的主导因素[4-6].因此揭示膜-污染物之间的相互作用机理对运行初期膜污染行为的预防控制及膜材料、预处理技术的选择至关重要.
研究表明,常见的水质条件pH值及离子强度和膜材料性能是影响超滤膜污染行为的重要因素[7-9],以往研究主要从宏观的膜过滤试验现象得出对膜污染行为的影响规律,而针对不同水质条件下或不同膜材料,定量测定膜-污染物之间作用力变化特征,揭示水质条件和膜材料性能对膜-污染物间作用力的影响机理的研究尚鲜有报导.
1998年,Bowen等[10]首次使用AFM结合聚合物探针定量测定聚合物与不同膜面之间的相互作用力,发现利用这种微观作用力的测定方法可以作为探讨和预测膜污染行为的有效技术手段.其后,基于实际废水中的溶解性有机物主要为腐殖类、蛋白及多糖类物质,且羧基是上述有机物中含量较多的典型官能团,因此Lee[11]、Ang[12]和Tang[13]等成功制备了羧基官能团探针并将其应用于膜污染解析领域.Elimelech研究团队使用-COOH官能团代表污染物主要研究了清洗条件、水质条件及二价离子等对污染物与污染物之间相互作用力的影响特征[14-15].其后Hiroshi等[16]也利用羧基探针对不同微滤膜表面的作用力规律进行了探讨.研究皆证明使用羧基探针代表污染物进行其对膜之间的微观作用力测定是解析膜污染机理及预测膜污染趋势的有效手段.
本研究利用自制的羧基官能团探针作为代表性膜污染物,定量测定了不同的离子强度及pH值条件下,污染物探针与两种典型膜材料——PVDF及EVOH超滤膜间的相互作用力变化规律.旨在探讨离子强度及pH值条件对超滤膜-污染物间作用力的影响机理,最终为膜污染防治、膜材料表面改性或预处理方式的选择提供理论依据.
1 实验材料与方法
1.1 材料
聚偏氟乙烯(PVDF,Solef 1015,美国);无水氯化锂(LiCl,天津化学试剂有限公司);N,N-二甲基乙酰胺(DMAc;天津市福晨化学试剂厂);乙烯-乙烯醇共聚物(EVOH,乙烯含量为32%,日本kurary公司);聚乙二醇20000(PEG20000,天津化学试剂有限公司);丙酮(CA,天津化学试剂有限公司);聚酯无纺布(PET,上海九骏新材料科技有限公司);氯化钠(NaCl,天津市科密欧化工有限公司);NaOH(天津市科密欧化工有限公司);使用0.1mol/LHCl及0.1mol/ LNaOH进行溶液pH值调节;使用1mol/L的NaCl溶液调节溶液离子强度.上述试剂皆为分析纯,试验过程所用皆为去离子水.
1.2 膜材料
本研究使用的PVDF及EVOH超滤膜皆是通过浸没沉淀相转化法制得.所制得超滤膜皆使用去离子水中充分漂洗,之后将其在去离子水中浸泡5d以上待用.基本制备方法及膜性能如下:
PVDF膜:将一定比例的PVDF、LiCl溶解于DMAc,在恒温条件下充分搅拌溶解形成均质铸膜液,静置脱泡后,刮制平板PVDF超滤膜.在25℃、0.1MPa下纯水通量为(300±50)L/(m2·h),切割分子量为48kDa,亲水性接触角为67.2°,表面平均粗糙度22.1nm.
EVOH膜:将一定比例的EVOH、PEG20000、CA、LiCl溶解于DMAc;形成均质铸膜液静置脱泡后将其涂覆于PET无纺布表面,置于凝胶浴中分相后得到EVOH平板超滤膜;在25℃、0.1MPa下纯水通量为(300±50)L/(m2·h),切割分子量为48kDa,亲水性接触角为56.4°,表面平均粗糙度15.6nm.
1.3 胶体探针的制备及测定方法
1.3.1 胶体探针的制备 本研究使用的羧基胶体探针是实验室通过自行搭建的装置制备,在AFM无针尖探针(NP-010,德国布鲁克)微悬臂自由端粘附一直径为5µm的羧基微颗粒(-COOH,Polysciences).制备过程通过微操作器控制AFM无针尖探针微悬臂的三维移动,在光学显微镜(奥林巴斯,TH4-200,日本)视野中实时监测制备过程.

图1 羧基胶体探针扫描电镜Fig.1 Scanning electron microscope image of a carboxyl colloidal probe
具体制备方法如下:首先将AFM无针尖探针及固定比例配置的双组分环氧树脂胶(Epo Tek公司)分别设置于微操作器及显微镜视野中,通过微操作器控制无针尖探针微悬臂的三维移动在微悬臂自由端粘附适量的环氧树脂,之后将至于云母片表面的羧基微颗粒引入到显微镜视野,再次采用微操作器控制无针尖探针微悬臂的三维移动,通过微悬臂自由端的环氧树脂的毛细管力将羧基颗粒粘附于悬臂自由端,最后将粘附有羧基微颗粒的AFM探针从微操作器取下,在红外灯照射下修复20min,接着将其置于4℃的冰箱中静置一周以上固化待用.图1所示为羧基官能团探针的扫描电镜(SEM)图.
1.3.2 作用力的测定 本文主要目的是考察不同pH值和离子强度下,对污染物羧基官能团与PVDF及EVOH超滤膜之间的相互作用力的影响特征.而粘附力(F)是分子间静电力、范德华力、氢键力等作用力的综合体现[17],所以本研究通过定量测定膜-羧基之间的粘附力进行定性作用力的分析.其计算公式见式(1)[18]:

式中:F是分子间的粘附力,N;R是微颗粒半径,m;W(∞)是将一无限接近于平面的微颗粒移走时每单位面积需要的能量,J/m2.在这里,粘附力可以理解为阻止污染物到达膜表面所需要的能量,显然,AFM胶体探针所测定的粘附力与胶体颗粒的半径成正比关系,所以本研究中将所测定的粘附力除以胶体颗粒探针的半径(F/R)[18],且为了减小作用力测定误差,对每组粘附力皆进行了多次测量,实验数据进行频率统计分析.
所有粘附力皆是在液相接触模式下,定量测定了离子强度为0、pH值分别为3,5,7,9及pH值为7、离子强度分别为0,1,10,100,300, 500mmol/L时羧基官能团与PVDF及EVOH之间的作用力.使用Multimode 8.0原子力显微镜(AFM,布鲁克,德国)结合羧基探针进行作用力测定.PVDF膜和EVOH膜使用前在超纯水中进行充分漂洗.
具体测试步骤如下:1)将所使用胶体探针安装于AFM上,在相应的液体环境中进行微悬臂弹性系数的校正确定;2)将对应超滤膜固定于样片台表面,连同胶体探针固定装置设置于AFM上形成液体环境的测试回路;3)用相应的液体测试溶液冲洗测试回路,润洗3次后在测试回路中充满测试溶液,封闭回路;4)设定参数后在“接触”模式下进行粘附力的测试.为了减小实验误差,每个样品在6个不同的局域点进行力测定,每个点进行10次重复测量,并对所得粘附力进行频率统计分析.探针使用前后皆要在显微镜下进行完整性检测.
1.4 Zeta电位测定
PVDF和EVOH超滤膜在不同pH值下的Zeta电位测量是通过奥地利安东帕公司(Anton Paar GmbH)的固体表面Zeta电位仪SurPASS进行分析的.测定时电解质溶液是1mmol/L KCl溶液,采用0.05mol/L的HCl和NaOH溶液来改变电解液的pH值,在pH值为2.6~9.6的范围内使用SurPASS测得膜表面的Zeta电位[19-20].表1为不同pH值条件下PVDF和EVOH膜面的Zeta电位值.

表1 在不同pH值下PVDF和EVOH膜表面的Zeta电位值(mV)Table 1 Zeta potential of PVDF and EVOH membrane surfaces at various pH(mV)
2 结果与讨论
2.1 pH值对膜-羧基间作用力影响特征
羧基是溶解性有机物中含量较多的典型官能团,本研究将羧基官能团探针作为代表性膜污染物,考察了测试溶液离子强度为0、pH值为3,5,7,9范围变化的情况下,羧基官能团与PVDF及EVOH膜之间的粘附力变化(表2),旨在探讨pH值变化对膜-污染物间微观作用力的影响特征.

表2 在不同pH值下羧基官能团与PVDF及EVOH膜之间的粘附力值Table 2 Adhesion forces of carboxyl microspheres to PVDF and EVOH membranes at various pH
2.1.1 不同pH值条件下PVDF-羧基之间作用力 试验证明,溶液pH值为3、5、7、9时,PVDF膜与羧基之间的平均粘附力分别为4.77、4.25、3.34、2.43mN/m.图2为不同pH值条件下PVDF-羧基官能团之间的典型粘附力曲线及相应粘附力的概率分布可以看出相应粘附力的平均值皆在其最大概率区间;且PVDF-羧基之间的相互作用力随着溶液pH值的增大而递减.羧基是典型的弱酸性官能团,随着溶液pH值的增大,羧基官能团的氢离子解离度亦逐渐增大,即羧基微颗粒所带负电荷数逐渐增加.而pH值为3、5、7、9时,PVDF膜表面的Zeta电位为-9,-42,-47,-47mV.由静电理论可知,带同种电荷物质间的静电排斥力会随着所带电荷数的增大而增大.显然,随着pH值的增大,羧基颗粒与PVDF膜面之间的静电排斥力逐渐增大,所以相应的羧基与PVDF之间的粘附力减小.
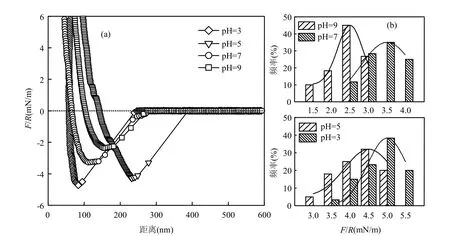
图2 不同pH值下PVDF-羧基之间的粘附力曲线与相应的粘附力概率分布Fig.2 Representative normalized adhesive force distance curves of the PVDF-carboxyl and the frequency distribution of the corresponding forces at various pH
2.1.2 pH值对EVOH-羧基之间作用力的影响 溶液pH值为3、5、7、9时,EVOH膜与羧基之间的平均粘附力分别为1.07、0.76、0.55、0.47mN/m.图3为不同pH值条件下羧基颗粒与EVOH超滤膜之间的典型粘附力曲线及相应粘附力的概率分布,可以看出,pH值为3时,羧基-EVOH之间作用力最大,pH值为9时,羧基-EVOH之间作用力最小;同样,羧基-膜之间的相互作用力随着溶液pH值的增大而减弱.这是因为,pH值为3、5、7、9时,EVOH膜表面的Zeta电位分别是-3,-13,-19,-21mV;显然,与PVDF膜一样,EVOH膜表面皆带负电荷且膜面净电荷随着pH值的增大而增大,所以相应羧基-EVOH之间的相互作用力随着pH值增大而减弱.
膜-污染物之间相互作用力越大,在分离膜运行初期,污染物在膜面或膜孔壁吸附累积的速率越快,膜污染越严重.综上发现,针对带负电的污染物而言,选用带负电的膜进行污染物分离,可有效降低分离膜运行初期膜-污染物之间的相互作用力.或者,通过调节水质pH值,使膜面及污染物带同种电荷,或增大膜面及污染物带电量,可有效增强膜与污染物间的静电排斥力,即降低膜与羧基有机污染物间的相互作用力,亦是缓减膜污染行为的有效策略之一.
2.2 离子强度对膜-羧基之间作用力影响特征
分离膜在海水净化、污水处理及回用或其他工业废水的处理过程中,水中普遍存在的离子条件是影响膜污染的关键因素之一.本研究分别测定了pH值为7时,不同离子强度条件下PVDF及EVOH超滤膜与羧基官能团之间的相互作用力,结果见图4.由图4可以看出:○1无论针对PVDF超滤膜还是EVOH超滤膜,膜-羧基之间作用力皆是随着离子强度的增加均呈现先增大后减小的趋势.○2当离子强度从0mmol/L逐渐增加到10mmol/L时,膜-羧基之间的相互作用力随着离子强度的增加而增大;根据经典的DLVO理论,随着溶液离子强度的增加,羧基官能团和膜表面电荷会产生双电层压缩效应及电荷屏蔽效应,膜面及羧基的静电量减小,致使膜与羧基官能团之间的静电排斥力随着离子强度的增加而减小,即膜-羧基之间的相互作用力随着离子强度的增加而增大.○3但是当离子强度持续增加到10mmol/L以上时,膜与羧基之间的粘附力是随着离子强度的增加而逐渐减小,这种现象和Lee[21]的研究结果一致.针对高离子强度条件下作用力减小的现象,Wang等[22]研究认为,在高离子强度条件下,随着水中的水合阳离子不断在带负电的有机物表面的吸附聚集,改变了有机物周围的水化层结构,致使短程水合排斥力的出现,降低了有机污染之间的相互作用力.在本研究中,PVDF、EVOH超滤膜及羧基颗粒皆带负电荷,同样随着离子强度的增大,水合钠离子会不断在膜面及羧基颗粒表面吸附,从而改变了二者周围的水分子层结构,水合排斥力不断增强.水合排斥力随着离子强度的增加而增加,而静电排斥力随着离子强度的增加而减小.而在低离子强度条件下,静电排斥力变化掩盖了水合力变化,致使羧基-膜之间作用力随着离子强度的增加而增大,但是,当离子强度增大到一定程度后,水合排斥力的作用超越了静电排斥力,此时,膜-羧基之间的作用力随着离子强度的增大而减小.

图4 PVDF/EVOH-羧基之间的粘附力随离子强度的变化Fig.4 Changes in adhesion force of carboxyl microspheres to PVDF and EVOH membranes with increasing ionic strength
综上发现,在高离子强度下,可以促进膜-污染物间的相互作用力下降,从而降低了污染物在膜面或膜孔壁的吸附几率,即缓减膜污染程度.Elimelech等[21]针对盐溶液清洗污染的膜进行的研究证实了这一点.他用100mmol/LNaCl溶液清洗污染的膜,清洗后测得污染物-污染物之间的作用力也减小了,使膜通量恢复90%以上.由此可见,使用适当的方式保持一定水合力的存在,也是有效减缓带有羧基基体的污染物对膜污染行为的策略之一.
2.3 不同膜材料对膜-羧基之间作用力的影响特征分析
膜与污染物间的作用力主要为范德华力、静电力及氢键力3种作用力的综合体现[23].其中范德华力和氢键力作为吸引力,而带同种电荷的膜与羧基间的静电力为排斥力.综合图2、图3及图4发现,在相同的水质条件(pH值、离子强度)下,EVOH-羧基之间的作用力远小于PVDF超滤膜与羧基之间的相互作用力.结合PVDF、EVOH膜及带有羧基基体的污染物的实际特点进行如下分析:
颗粒与固体界面间的范德华力与颗粒尺寸成正相关关系,本研究所有作用力测定过程中羧基颗粒的尺寸始终恒定,所以EVOH-羧基之间范德华力与PVDF-羧基之间的范德华力相当.羧基颗粒与膜面之间的静电排斥力与二者的带电量呈正相关,虽然特定水质条件下羧基颗粒的表面所带电荷恒定,但EVOH表面带电量远远小于PVDF膜面的带电量,所以PVDF-羧基之间的静电排斥力大于EVOH-羧基之间的静电排斥力.结合所测作用力结果可知,PVDF-羧基间的氢键定大于EVOH-羧基间的才使得PVDF与羧基间综合作用力明显大于EVOH-羧基间综合作用力.羧基官能团中与电负性氧原子相连的氢原子极易与另一电负性原子之间形成氢键作用,而PVDF及EVOH分别带有典型电负性原子氟原子和氧原子.但是,氟原子是电负性最强的原子,其电负性远大于氧原子,致使PVDF-羧基之间的氢键吸引力远远大于EVOH-羧基之间的氢键吸引力.上述现象说明针对含有电负性原子的膜材料,特定的膜面改性技术降低膜面-污染物之间的氢键作用力,可有效降低膜-污染物之间的相互作用力.
3 结论
3.1 随着pH值的增大,膜面及羧基颗粒所带电荷逐渐增加,致使膜-羧基之间的静电排斥力增大,相应的羧基与超滤膜之间的综合作用力减小.
3.2 无论针对PVDF超滤膜还是EVOH超滤膜,在pH值为7、离子强度为0~10mmol/L时,膜-羧基之间相互作用力遵循经典的DLVO理论,随着离子强度的增加而增大,但是在离子强度为10mmol/L以上时,水合排斥力不断增强,致使膜-羧基之间相互作用力减小.
3.3 在相同的水质条件下,EVOH-羧基之间的作用力远小于PVDF超滤膜与羧基之间的相互作用力.主要是源于PVDF与羧基之间较强的氢键相互作用力.
[1]Kimura K, Yamamura H, Watanabe Y. Irreversible fouling in MF /UF membranes caused by natural organic matters (NOMs)isolated from different origins [J]. Separation Science and Technology, 2006, 41:1331-1344.
[2]苗 瑞,王 磊,田 丽,等.海藻酸及腐殖酸共存对PVDF超滤膜的污染行为 [J]. 中国环境科学, 2014,34(10):2568-2574.
[3]彭 茜,冉德钦,王 平,等.不同pH值下腐殖酸反渗透膜污染中的界面相互作用解析 [J]. 中国环境科学, 2011,31(4):616-621.
[4]Hashino M, Hirami K, Maruyama T, et al. Effects of three natural organic matter types on cellulose acetate butyrate microfiltration membrane fouling [J]. Journal of Membrane Science, 2011,379(1/2):233-238.
[5]Basri H, Ismail A F, Aziz M. Microstructure and anti-adhesion properties of PES/TAP/Ag hybrid ultrafiltration membrane [J]. Desalination, 2012,287:71-77.
[6]Wang L, Miao R, Wang X D, et al. Fouling behavior of typical organic foulants in polyvinylidene fluoride ultrafiltration membranes: characterization from microforces [J]. Environmental Science Technology, 2013,47(8):3708-3714.
[7]Park C, Lee Y H, Lee S, et al. Effect of cake layer structure on colloidal fouling in reverse osmosis membranes [J]. Desalination,2008,220(1-3):335-344.
[8]Jones K L, O'melia C R. Protein and humic acid adsorption onto hydrophilic membrane surfaces: effects of pH and ionic strength[J]. Journal of Membrane Science, 2000,165(1):31-46.
[9]Singh G, Song L. Impact of feed water acidification with weak and strong acids on colloidal silica fouling in ultrafiltrationmembrane processes [J]. Water Research, 2008,42(3):707-713.
[10]Bowen W R, Hilal N, Lovitt R W, et al. A new technique for membrane characterisation: Direct measurement of the force of adhesion of a single particle using an atomic force microscope [J]. Journal of Membrane Science, 1998,139(2):269-274.
[11]Lee S, Elimelech M. Relating organic fouling of reverse osmosis membranes to intermolecular adhesion forces [J]. Environmental Science Technology, 2006,40:980-987.
[12]Ang W S, Elimelech M. Fatty acid fouling of reverse osmosis membranes: implications for wastewater reclamation [J]. Water Research, 2008,42(16):4393-4403.
[13]Tang C Y, Kwon Y-N, Leckie J O. The role of foulant-foulant electrostatic interaction on limiting flux for RO and NF membranes during humic acid fouling-theoretical basis,experimental evidence, and AFM interaction force measurement[J]. Journal of Membrane Science, 2009,326(2):526-532.
[14]Li Q, Elimelech M. Organic fouling and chemical cleaning of nanofiltration membranes: measurements and mechanisms [J]. Environmental Science Technology, 2004,38:4683-4693.
[15]Ang W S, Elimelech M. Protein (BSA) fouling of reverse osmosis membranes: implications for wastewater reclamation [J]. Journal of Membrane Science, 2007,296(1/2):83-92.
[16]Yamamura H, Kimura K, Okajima T, et al. Affinity of functional groups for membrane surfaces: Implications for physically irreversible fouling [J]. Environmental Science Technology, 2008,42:5310-5315.
[17]Butt H-J, Cappella B, Kappl M. Force measurements with the atomic force microscope: Technique, interpretation and applications [J]. Surface Science Reports, 2005,59(1-6):1-152.
[18]Costa A R, Pinho M N D, Elimelech M. Mechanisms of colloidal natural organic matter fouling in ultrafiltration [J]. Journal of Membrane Science, 2006,281(1/2):716-725.
[19]Antony A, Subhi N, Henderson R K, et al. Comparison of reverse osmosis membrane fouling profiles from Australian water recycling plants [J]. Journal of Membrane Science, 2012,407/408: 8-16.
[20]Setiawan L, Wang R, Li K, et al. Fabrication and characterization of forward osmosis hollow fiber membranes with antifouling NF-like selective layer [J]. Journal of Membrane Science, 2012,394-395:80-88.
[21]Lee S, Elimelech M. Salt cleaning of organic-fouled reverse osmosis membranes [J]. Water Research, 2007,41(5):1134-1142.[22]Wang L L, Wang L F, Ye X D, et al. Hydration interactions and stability of soluble microbial products in aqueous solutions [J]. Water Research, 2013,47(15):5921-5929.
[23]Israelachvili J N. Intermolecular and Surface Forces [M]. Third Edition, London: Academic Press, 2011:660.
Influence of solution chemistry on the interaction forces between membranes and carboxyl groups.
WANG Lei*,TIAN Li, MIAO Rui, WANG Xu-dong, LÜ Yong-tao (Environmental and Municipal Engineering, Xi'an University of Architecture and Technology, Xi'an 710055, China). China Environmental Science, 2015,35(5):1403~1409
To further clarify the effects of pH and ionic strength on the interaction forces between typical membrane materials and the carboxyl group, which is a typical functional group of membrane foulants, the interaction forces between the PVDF or EVOH membrane and carboxyl group were measured by atomic force microscopy in conjunction with a self-made carboxyl colloidal probe. Results show that the PVDF-carboxyl and EVOH-carboxyl adhesion forces weakened with increasing pH, whereas they firstly increased and then decreased with an increase in ionic strength. The interaction forces between membranes and carboxyl groups increased with an increase at low ionic strength (0~10mmol/L). However,the forces decreased with an increase at high ionic strength (10~500mmol/L). Moreover, the PVDF-carboxyl adhesion force was much stronger than the EVOH-carboxyl interaction force for given solution conditions.
membrane fouling;colloidal probe;interaction forces;membrane materials;solution chemistry
X703
A
1000-6923(2015)05-1403-07
王 磊(1971-),男,陕西铜川人,教授,博士,主要从事污水资源化再生利用及膜污染机理与控制对策研究.发表论文120余篇.
2014-09-23
国家自然科学基金(51178378; 51278408);陕西省科技创新项目(2012KTCL03-06; 2013KTCL03-16);西安建筑科技大学博士创新基金(DB03154)
* 责任作者, 教授, wl0178@126.com
