久效磷农药对金鱼肝细胞DNA的损伤及其机制研究
2015-11-19张晓娜汝少国中国海洋大学海洋生命学院山东青岛266003辽宁省海洋水产科学研究院辽宁大连6023
赵 飞,王 摆,2,张晓娜,田 华,王 蔚,汝少国*(.中国海洋大学海洋生命学院,山东 青岛 266003;2.辽宁省海洋水产科学研究院,辽宁 大连 6023)
久效磷农药对金鱼肝细胞DNA的损伤及其机制研究
赵 飞1,王 摆1,2,张晓娜1,田 华1,王 蔚1,汝少国1*(1.中国海洋大学海洋生命学院,山东 青岛 266003;2.辽宁省海洋水产科学研究院,辽宁 大连 116023)
以金鱼(Carassius auratus)为模式生物,研究了久效磷农药暴露导致的DNA损伤类型及其作用机制.结果表明:0.01,0.10,1.00mg/L的久效磷农药暴露24,48,96,168h均导致金鱼肝细胞DNA损伤程度显著升高,48h损伤最严重;暴露48h采用碱性、pH值12.1和中性彗星电泳发现DNA损伤类型主要为碱不稳定位点形成,其次为单/双链断裂;采用Endo Ⅲ酶和FPG酶处理的碱性彗星电泳,发现DNA出现氧化损伤;暴露24h肝脏谷胱甘肽过氧化物酶(GSH-Px)活性显著降低,丙二醛(MDA)含量显著升高达到峰值,96~168h超氧化物歧化酶(SOD)和GSH-Px活性显著升高,MDA含量与24h相比有所降低,表明活性氧自由基(ROS)含量在短期暴露升高(24h)、在96~168h暴露逐渐降低.影响抗氧化酶活性、干扰ROS清除过程是久效磷农药造成DNA损伤的主要机制.
久效磷;DNA损伤;金鱼;活性氧自由基
久效磷农药是一种防治农林业病虫害的有机磷农药,目前在某些非洲和亚洲国家仍在使用[1-2],并在农作物和水环境中残留,印度Andaman群岛茄子等蔬菜中的久效磷残留量在0.023~1.140mg/kg之间[3],印度Lucknow市的工业废水中久效磷的浓度达到(8.32±3.9)ng/mL[4].残留农药进入生物体后会作用于不同组织器官的遗传物质,导致DNA的损伤,Saleha等[5]首次报道了久效磷能够造成鱼类外周血细胞DNA链断裂,还可导致小鼠外周血细胞[6]、人淋巴细胞[7]以及淡水硬骨鱼Channa punctatus鳃、肾、淋巴细胞[8]的DNA链断裂.DNA的损伤主要包括DNA双链断裂(DSB)、单链断裂(SSB)、碱不稳定位点(ALS)形成、DNA碱基氧化损伤、DNA-蛋白交联和DNA-DNA交联等不同类型[9],但目前尚未证明久效磷农药导致的DNA断裂是单链还是双链断裂或者是碱基损伤等其他类型.研究发现有机磷农药主要通过增加组织内的氧化压力导致活性氧自由基过量产生,活性氧自由基攻击DNA造成DNA链断裂和碱基氧化[10].有机磷农药可通过两种途径诱导活性氧自由基的过量产生:一是在细胞色素P450酶系作用下,硫代磷酸酯类有机磷农药中由—P︰S键转化而来的—P︰O,或者磷酸酯类的—P︰O,在氧化还原循环中很容易获得一个电子并将电子转移给氧分子生成超氧阴离子自由基,或进一步转变为其他自由基如羟自由基[11-12];二是通过降低机体抗氧化能力而引起氧化-抗氧化稳态失衡,导致抗氧化系统对活性氧自由基的清除能力减弱.Yu等[13]研究发现毒死蜱可以造成鼠视网膜DNA损伤增加,脂质过氧化,超氧化物歧化酶(SOD)、过氧化氢酶和谷胱甘肽过氧化物酶(GSH-Px)活性降低,抗氧化酶活性的变化可能升高了组织内活性氧等自由基的含量引起DNA损伤,而抗氧化剂维生素C和维生素E可以减轻DNA损伤.Kashyap等[14]发现10-6~10-4mol/L的久效磷能够上调CYP1A1/1A2,2B1/2B2,2E1等酶的mRNA水平,并显著增加PC12细胞活性氧自由基含量,但目前尚不清楚久效磷能否通过干扰抗氧化系统从而影响活性氧自由基的清除过程来诱发DNA损伤.因此,本文在识别久效磷农药对DNA损伤类型的基础上,选取对超氧自由基和过氧化氢具有清除作用的SOD、GSH-Px以及丙二醛(MDA)含量为指标,探讨了久效磷农药对DNA氧化损伤的作用机制.
1 材料与方法
1.1 材料
金鱼(Carassius auratus)购自青岛市南山市场,金鱼体长(8.53±0.83)cm,体重(24.05±2.74)g,实验室驯养2周后进行久效磷暴露试验.
久效磷农药购自青岛农药厂,为40%水溶性制剂.其他药品试剂均为分析纯,购自Sigma公司(St. Louis, MO, USA)或国药集团化学试剂有限公司(Beijing, P.R. China).
1.2 久效磷农药暴露方法
采用半静态暴露实验,70L玻璃水族箱装入50L连续曝气24h的自来水,每组2个水族箱,每箱6条鱼,共12条鱼.根据急性毒性预试验,久效磷农药暴露金鱼的LC50约为100mg/L,本试验选择LC50的1/10000,1/1000,1/100,即0.01,0.10和1.00mg/L暴露金鱼24、48、96和168h,同时设对照组.为保持久效磷农药浓度每天换水50%,并补加农药至暴露浓度.试验条件: T(20±2)℃,ρ(DO)(7.0±0.1)mg/L,pH(7.6±0.2),光暗比14h:10h,试验期间不投饵.每组取3条鱼,75mg/L MS-222 (Sigma, St. Louis, MO, USA)麻醉后,取部分肝脏,用预冷的0.75%的NaCl漂洗去除血细胞,剪碎,过滤,0.75%的NaCl调整细胞密度为105个/mL,台盼兰染色法检测单细胞悬液的细胞存活率大于95%后,进行彗星电泳.剩余肝脏组织拭干后称重,加入9倍体积4℃预冷的匀浆缓冲液(PBS,pH 7.4)冰浴匀浆,4000g/min下离心10min,取上清液测定SOD、GSH-Px活性和MDA含量.
1.3 彗星电泳
彗星电泳操作在4℃避光条件下进行,参照Singh等[15]的方法略加改进.碱性彗星电泳,肝细胞固化在玻片上后,浸入裂解液(2.5mmol/L NaCl,100mmol/L Na2EDTA,10mmol/L Tris-base,pH=10,使用前加入1% TritonX-100和10% DMSO)裂解细胞1.5h,然后浸入电泳缓冲液(0.3mol/L NaOH,1mmol/L Na2EDTA, pH>13)解旋DNA 20min,CYY-Ⅲ型电泳仪(北京六一仪器厂,中国)在25V(300mA)电压下电泳20min.结束后向每张玻片滴加30µL溴化乙锭(20μg/mL)染色15min,在Olympus BX-51型荧光显微镜(Tokyo,Japan)200×下镜检计数,每张玻片随机选取50个彗星细胞观察并拍照,每条鱼制作2张玻片.pH值12.1的彗星电泳和中性彗星电泳的操作步骤同碱性彗星电泳,不同的是电泳缓冲液pH分别为12.1和8.2~8.5.
Endo Ⅲ酶和FPG酶处理的碱性彗星电泳,玻片在裂解液中裂解后,用酶反应缓冲液(10mmol/L三羟甲基氨基丙烷-盐酸,10mmol/L MgCl2,1mmol/L二硫苏糖醇,pH 7.0,0.1mg/mL胎牛血清)漂洗两次,每次8min,晾干后每个样品六张载玻片中,分别取两张滴加Endo Ⅲ酶识别和切除氧化的嘧啶、两张滴加FPG酶识别和切除氧化的嘌呤,剩余两张滴加酶反应缓冲液作为对照.37℃温浴45min后放入电泳缓冲液中进行电泳,后续步骤同碱性彗星电泳.
使用CASP软件(http://www.casp.of.pl/)对彗星细胞进行分析[16].以Olive尾矩(OTM值)评估DNA损伤程度.Olive尾矩(OTM值)=彗星头部重心和尾部重心之间的距离×尾部DNA含量.
1.4 SOD活性、GSH-Px活性和MDA含量测定
使用南京建成生物工程研究所生产的超氧化物歧化酶、谷胱甘肽过氧化物酶和丙二醛试剂盒,按照说明书测定肝脏组织SOD活性、GSH-Px活性和MDA含量.SOD活性:每mg组织蛋白在1mL反应液中INT还原抑制率达50%时所对应的SOD量为一个SOD活力单位(U).GSH-Px活性:每mg蛋白质,每分钟扣除非酶促反应作用,反应体系中GSH浓度降低1µmol/L为一个酶活力单位.MDA含量:每mg组织蛋白中MDA的摩尔数.肝脏组织匀浆中的蛋白含量采用考马斯亮蓝法,用小牛血清蛋白(BSA)作为标准.
1.5 统计学分析
所有试验数据以平均数±标准差形式表示,采用单因素方差分析和Tukey多重检验分析显著性,P<0.05为差异显著.
2 结果与讨论
2.1 结果
2.1.1 肝细胞DNA的损伤 久效磷农药暴露48h后,对照组金鱼肝细胞DNA完整,彗星细胞几乎无拖尾现象,0.01mg/L暴露浓度组彗星细胞可见明显拖尾,0.10和1.00mg/L暴露浓度组彗星细胞的尾部亮度逐渐增加、尾长逐渐延长(图1A).不同暴露时间和不同暴露浓度与对照组相比均能导致肝细胞OTM值显著升高(P<0.05,图1B);同一暴露浓度条件下,暴露24h即已出现损伤,48h时DNA损伤达到峰值,96h时损伤有所减轻,168h时的损伤明显降低(图1B).
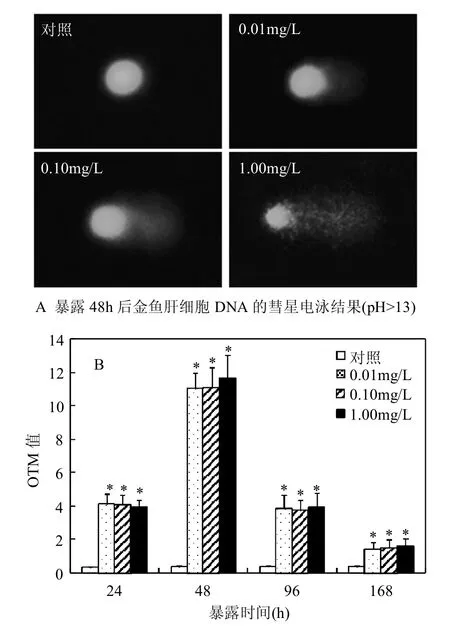
图1 不同浓度久效磷农药暴露对金鱼肝细胞DNA的损伤效应Fig.1 DNA-damaging effects of different concentrations of monocrotophos pesticide on hepatic cells of goldfish
2.1.2 肝细胞中DNA碱不稳定位点、单链断裂和双链断裂的形成 由图1可知,久效磷农药暴露金鱼48h后肝细胞DNA损伤最显著,以后的试验均选取48h暴露.由图2可见,对于碱性(pH>13)、pH值12.1和中性(pH值8.2~8.5)彗星电泳,各暴露浓度组的OTM值均显著高于对照组(P<0.05);碱性彗星电泳的OTM值均显著高于pH值12.1和中性彗星电泳的OTM值(P<0.05).

图2 久效磷农药暴露48h后金鱼肝细胞DNA不同pH值的彗星电泳条件下的OTM值Fig.2 Olive tail moment (OTM) values of DNA in hepatic cells of goldfish exposed to monocrotophos for 48h, assessed by comet assay under different pH conditions
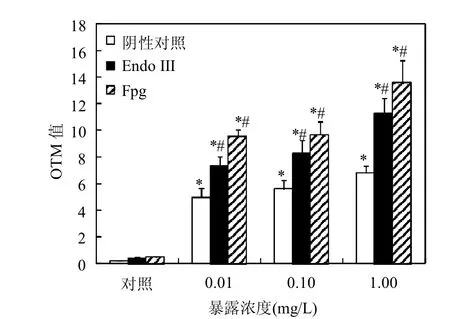
图3 久效磷农药暴露48h经Endo Ⅲ或FPG酶处理后金鱼肝细胞DNA的OTM值Fig.3 Olive tail moment (OTM) values of DNA in hepatic cells of goldfish exposed to monocrotophos for 48h,assessed by alkaline comet assay with the use of Endo III or FPG enzyme
2.1.3 肝细胞中DNA氧化损伤的形成 由图3可见,对于阴性对照、Endo Ⅲ酶和FPG酶处理,各暴露浓度组的OTM值均显著高于对照组(P<0.05);Endo Ⅲ酶和FPG酶处理后OTM值显著高于阴性对照(P<0.05),Endo Ⅲ酶处理后各暴露组OTM值是阴性对照的1.5~1.7倍,FPG酶处理后各暴露浓度组是阴性对照组的1.7~2.0倍.
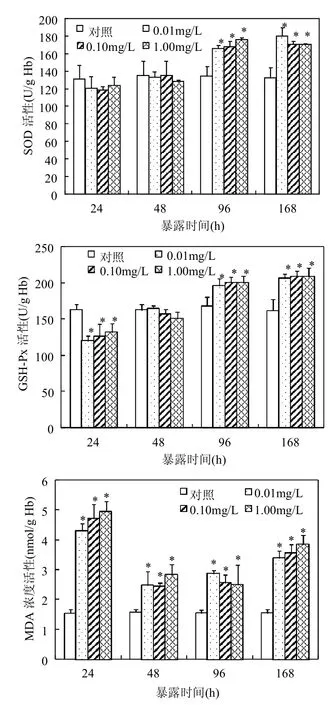
图4 久效磷农药暴露后金鱼肝脏组织超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)活性及丙二醛(MDA)含量的变化Fig.4 Activities of superoxide dismutase (SOD) and glutathione peroxidase (GSH-Px) and concentrations of malondialdehyde (MDA) in the liver tissues of goldfish exposed to monocrotophos
2.1.4 久效磷农药对肝脏组织SOD活性、GSH-Px活性和MDA含量的影响 由图4可见,久效磷农药暴露24h和48h,金鱼肝脏组织SOD活性变化与对照相比无显著差异,暴露96h和168h,SOD活性与对照相比显著升高(P<0.05,图4A);暴露24h各久效磷暴露组GSH-Px活性与对照相比均显著降低(P<0.05),暴露48h GSH-Px活性与对照相比无显著差异,暴露96h和168h时GSH-Px活性明显升高(P<0.05,图4B);暴露24h各久效磷暴露组肝脏组织MDA含量与对照相比均显著升高(P<0.05),暴露48h、96h和168h MDA含量与24h相比有所降低,但仍显著高于对照组(P<0.05,图4C).
2.2 讨论
诸多研究利用碱性彗星电泳技术,发现久效磷农药通过食物或水环境等介质暴露后可导致多种实验动物淋巴细胞、外周血细胞等循环系统组织细胞的DNA损伤[5-8].本研究的碱性彗星电泳结果表明暴露24,48,96和168h时,0.01、0.10和1.00mg/L久效磷农药均能导致金鱼肝细胞OTM值的显著升高,表明肝细胞是久效磷农药DNA损伤作用的靶点之一.Ali等[8]报道1.59~4.78mg/L久效磷农药(商标浓度为36%)暴露淡水硬骨鱼Channa punctatus 21d,发现暴露96h时对鳃、肾、淋巴细胞的DNA损伤均达到峰值,96h后损伤逐渐减低,鳃细胞更易产生DNA损伤,其损伤水平约为对照组的4~5倍.本研究0.01~1.00mg/L久效磷农药暴露金鱼48h时,肝细胞DNA损伤即达到峰值,各暴露浓度组损伤水平是对照组的30.6~32.3倍,表明金鱼肝细胞DNA对久效磷农药的暴露更敏感,暴露48h后OTM值逐渐降低,表明肝脏组织同时具有较强的DNA损伤修复能力.
采用不同条件的彗星电泳可以识别DNA链断裂的具体类型,在pH>13时碱不稳定位点能够全部转化成单链损伤,可利用pH>13的彗星电泳检测整体DNA损伤,即能够识别双链断裂、单链断裂和碱不稳定位点形成[17];pH≤12.1时碱不稳定位点能够稳定存在,可利用pH值12.1的彗星电泳检测单链断裂和双链断裂,但不能检测碱不稳定位点形成[18];pH8.2~8.5中性彗星电泳对双链断裂的检测具有更高的敏感性[19-20].本研究发现久效磷农药暴露后金鱼肝细胞碱性、pH12.1和中性彗星电泳的OTM值与对照相比均显著升高,表明久效磷农药暴露后肝细胞中DNA的碱不稳定位点和单/双链断裂均增加,对于不同的暴露浓度,碱性彗星电泳的OTM值是pH值12.1彗星电泳的32.7~241.5倍、中性彗星电泳的75.6~278.0倍,表明碱不稳定位点的形成是主要的DNA损伤类型.之前报道的久效磷农药对鱼类等实验生物的DNA损伤均是DNA链断裂[5-8],但是断裂的类型不明确,本研究首次识别了久效磷农药诱发的DNA链断裂包括碱不稳定位点形成、单链断裂和双链断裂等类型,其中碱不稳定位点的形成是DNA损伤的主要类型.碱不稳定位点主要包括无嘌呤或无嘧啶位点(AP位点)、半脱氧核糖位点和其他弱碱性条件下容易造成DNA断裂的位点[21],由于细胞内的AP位点主要在DNA糖基化酶切除氧化损伤碱基的过程中形成[22],因而久效磷农药暴露后金鱼肝细胞DNA中碱不稳定位点(AP位点)的增加可能与碱基的氧化损伤有关.采用Endo Ⅲ酶或FPG酶处理DNA,将DNA上氧化的嘧啶或嘌呤切除形成DNA链断裂再进行彗星电泳,通过DNA链断裂(OTM值)的变化能够判断DNA碱基是否发生氧化损伤[23].本研究结果发现与未加酶的对照组相比,两种酶处理后肝细胞OTM值显著升高,表明久效磷农药诱发了DNA碱基的氧化损伤.
DNA碱基氧化损伤与活性氧自由基,特别是羟自由基的产生直接相关[24-25],Kashyap等[14]的研究结果表明久效磷能够通过上调细胞色素P450酶的表达代谢生成过量的活性氧自由基.组织内过量活性氧自由基可通过抗氧化酶系统清除,但久效磷农药对活性氧自由基的清除过程是否产生影响尚不清楚.肝脏中富含多种抗氧化酶,是机体调节氧化还原代谢反应、清除过量活性氧自由基的重要器官,其中SOD能够将超氧自由基转化为过氧化氢,GSH-Px进一步将过氧化氢分解为水,从而减少由超氧自由基和过氧化氢转化的羟自由基的含量;而过量的活性氧自由基能够造成细胞内脂质发生过氧化反应,导致MDA含量升高.本研究中久效磷农药暴露24h时,肝脏组织SOD活性未发生显著性变化,GSH-Px活性受到显著抑制,机体对过氧化氢的分解受到干扰,导致过量羟自由基产生,羟自由基能够通过与嘌呤和嘧啶杂环的双键发生加成反应、与胸腺嘧啶的甲基基团和脱氧核糖发生抽氢反应[25],最终导致暴露24h时DNA损伤显著升高;此时,过量羟自由基的产生导致脂质过氧化水平达到峰值.暴露48h时久效磷农药对肝脏组织SOD和GSH-Px活性没有影响,活性氧的积累导致MDA含量显著升高,DNA损伤达到峰值.暴露96h至168h时,活性氧自由基诱导细胞引起SOD和GSH-Px活性显著升高,机体产生的过量活性氧自由基逐渐被消除,细胞对DNA损伤的修复使得DNA损伤逐渐降低.暴露24~168h肝脏组织SOD、GSH-Px活性以及MDA含量与DNA损伤的相应变化表明干扰活性氧自由基的清除过程导致活性氧自由基积累是久效磷农药诱发金鱼肝细胞DNA损伤的主要机制之一.
3 结论
3.1 碱性彗星电泳的结果表明,0.01~1.00mg/L的久效磷农药暴露24、48、96和168h均能够诱发金鱼肝细胞DNA损伤,暴露48h损伤最严重,随着暴露时间再延长损伤程度逐渐降低.
3.2 久效磷农药暴露能够导致肝细胞DNA中碱不稳定位点形成和单/双链断,其中碱不稳定位点形成是损伤的主要类型.碱不稳定位点形成与久效磷农药暴露后DNA碱基的氧化损伤正相关.
3.3 久效磷农药短期暴露(24h)能够降低肝脏组织GSH-Px活性,升高MDA含量,机体对活性氧自由基的清除能力减弱导致过量活性氧自由基产生,从而诱导了DNA损伤;96~168h暴露能够造成SOD和GSH-Px活性代偿性升高,肝脏组织对活性氧自由基的清除能力增强,使得DNA损伤逐渐降低,结果表明干扰肝脏活性氧自由基的清除过程导致活性氧自由基积累是久效磷农药诱发DNA损伤的主要机制之一.
[1]Tariq M I, Afzal S, Hussain I. Pesticides in shallow groundwater of bahawalnagar, Muzafargarh, DG Khan and Rajan Pur districts of Punjab, Pakistan [J]. Environment International, 2004,30(4): 471-479.
[2]Krause K H, van Thriel C, De Sousa P A, et al. Monocrotophos in Gandaman village: India school lunch deaths and need for improved toxicity testing [J]. Archives of Toxicology, 2013,87(10):1877-1881.
[3]Swarnam T P, Velmurugan A. Pesticide residues in vegetable samples from the Andaman Islands, India [J]. Environmental Monitoring and Assessment, 2013,185(7):6119-6127.
[4]Anjum R, Malik A. Evaluation of mutagenicity of wastewater in the vicinity of pesticide industry [J]. Environmental Toxicology and Pharmacology, 2013,35(2):284-291.
[5]Saleha Banu B, Danadevi K, Rahman M F, et al. Genotoxic effect of monocrotophos to sentinel species using comet assay [J]. Food and Chemical Toxicology, 2001,39(4):361-366.
[6]Mahboob M, Rahman M F, Danadevi K, et al. Detection of DNA damage in mouse peripheral blood leukocytes by the comet assay after oral administration of monocrotophos [J]. Drug and Chemical Toxicology, 2002,25(1):65-74.
[7]Jamil K, Shaik A P, Mahboob M, et al. Effect of organophosphorus and organochlorine pesticides(monochrotophos, chlorpyriphos, dimethoate, and endosulfan) on human lymphocytes in-vitro [J]. Drug and Chemical Toxicology,2004,27(2):133-144.
[8]Ali D, Kumar S. Long-term genotoxic effect of monocrotophos in different tissues of freshwater fish Channa punctatus (Bloch)using alkaline single cell gel electrophoresis [J]. Science of the Total Environment, 2008,405(1):345-350.
[9]Ribas-Maynou J, Garcia-Peiro A, Abad C, et al. Alkaline and neutral Comet assay profiles of sperm DNA damage in clinical groups [J]. Human Reproduction, 2012,27(3):652-658.
[10]Lu X T, Ma Y, Wang C, et al. Cytotoxicity and DNA damage of five organophosphorus pesticides mediated by oxidative stress in PC12cells and protection by vitamin E [J]. Journal of Environmental Science and Health Part B-Pesticides Food Contaminants and Agricultural Wastes, 2012,47(5):445-454.
[11]Bondy S C, Naderi S. Contribution of hepatic cytochrome P450systems to the generation of reactive oxygen species [J]. Biochemical Pharmacology, 1994,48(1):155-159.
[12]Kovacic P. Mechanism of organophosphates (nerve gases and pesticides) and antidotes: electron transfer and oxidative stress [J]. Current Medicinal Chemistry, 2003,10(24):2705-2709.
[13]Yu F, Wang Z, Ju B, et al. Apoptotic effect of organophosphorus insecticide chlorpyrifos on mouse retina in vivo via oxidativestress and protection of combination of vitamins C and E [J]. Experimental and Toxicologic Pathology, 2008,59(6):415-423.
[14]Kashyap M P, Singh A K, Kumar V, et al. Monocrotophos induced apoptosis in PC12cells: role of xenobiotic metabolizing cytochrome P450s [J]. PLoS One, 2011,6(3):e17757.
[15]Singh N P, McCoy M T, Tice R R, et al. A simple technique for quantitation of low levels of DNA damage in individual cells [J]. Experimental Cell Research, 1988,175(1):184-191.
[16]Końca K, Lankoff A, Banasik A, et al. A cross-platform public domain PC image-analysis program for the comet assay [J]. Mutation Research, 2003,534(1):15-20.
[17]Tice R R, Agurell E, Anderson D, et al. Single cell gel/comet assay: guidelines for in vitro and in vivo genetic toxicology testing [J]. Environmental and Molecular Mutagenesis, 2000,35(3):206-221.
[18]Wen Y, Zhang P P, An J, et al. Diepoxybutane induces the formation of DNA-DNA rather than DNA-protein cross-links,and single-strand breaks and alkali-labile sites in human hepatocyte L02cells [J]. Mutation Research, 2011,716(1):84-91.
[19]Shahidi M, Mozdarani H, Bryant P E. Radiation sensitivity of leukocytes from healthy individuals and breast cancer patients as measured by the alkaline and neutral comet assay [J]. Cancer Letters, 2007,257(2):263-273.
[20]Cortés-Gutiérrez E I, Hernández-Garza F, García-Pérez J O, et al. Evaluation of DNA single and double strand breaks in women with cervical neoplasia based on alkaline and neutral comet assay techniques [J]. Biomed Research International, 2012, doi: 10.1155/2012/385245.
[21]Cortés-Gutiérrez E I, Dávila-Rodríguez M I, López-Fernández C,et al. Localization of alkali-labile sites in donkey (Equus asinus)and stallion (Equus caballus) spermatozoa [J]. Theriogenology,2014,81(2):321-325.
[22]Jin J, Hwang B J, Chang P W, et al. Interaction of apurinic/apyrimidinic endonuclease 2 (Apn2) with Myh1DNA glycosylase in fission yeast [J]. DNA Repair, 2014,15:1-10.
[23]Thorne D, Wilson J, Kumaravel T S, et al. Measurement of oxidative DNA damage induced by mainstream cigarette smoke in cultured NCI-H292human pulmonary carcinoma cells [J]. Mutation Research, 2009,673(1):3-8.
[24]Cooke M S, Evans M D, Dizdaroglu M, et al. Oxidative DNA damage: mechanisms, mutation, and disease [J]. Faseb Journal,2003,17(10):1195-1214.
[25]解静芳,王学峰,孟紫强,等.SO2致小鼠肝蛋白质氧化损伤和DNA-蛋白质交联作用 [J]. 中国环境科学, 2007,27(2):400-403.
DNA damage induced by monocrotophos pesticide and the underlying mechanism in hepatic cells of goldfish (Carassius auratus).
ZHAO Fei1, WANG Bai1,2, ZHANG Xiao-na1, TIAN Hua1, WANG Wei1, RU Shao-guo1*(1.Marine Life Science College, Ocean University of China, Qingdao 266003, China;2.Liaoning Ocean and Fisheries Science Research Institute, Dalian 116023, China). China Environmental Science, 2015,35(5):1563~1569
Types of the DNA damage in hepatic cells and the underlying mechanism in goldfish (Carassius auratus)exposed to monocrotophos were investigated in this study. Results showed that DNA damage in hepatic cells of goldfish was significantly increased by exposure of 0.01, 0.10, and 1.00mg/L monocrotophos for 24, 48, 96, and 168h, and reached maximum at 48h. Alkali-labile sites rather than single- or double-strand breaks were found, by using the alkaline, pH 12.1,and neutral comet assay, to be the main type of DNA damage induced by monocrotophos at 48h. Further, oxidative damage in DNA bases was verified by using the alkaline comet assay combined with Endo III or FPG enzyme. At 24h,glutathione peroxidase (GSH-Px) activities significantly decreased and malondialdehyde (MDA) concentrations significantly increased and exhibited peak values, indicating an over-production of reactive oxygen species (ROS) at short exposure duration (24h). However, superoxide dismutase (SOD) activities and GSH-Px activities significantly increased at 96~168h, and MDA concentrations showed a decreasing trend compared with those at 24h, suggesting a gradually decrease of ROS at 96~168h in the liver tissues. Accordingly, our results suggest that DNA damage induced by monocrotophos in hepatic cells of goldfish is possibly due to the inhibition of antioxidant enzymes activities and ROS scavenging.
monocrotophos;DNA damage;goldfish;reactive oxygen species
X171.5
A
1000-6923(2015)05-1563-07
赵 飞(1988-),女,山东泰安人,中国海洋大学海洋生命学院博士研究生,研究方向为污染生态学.
2014-10-07
国家自然科学基金(31101905);高等学校博士学科点专项科研基金资助课题(博导类) (20120132110011)
* 责任作者, 教授, rusg@ouc.edu.cn
