附着剑菌对三氯联苯的吸附及降解机制研究
2015-11-19韦祎旸李辉信梁明祥南京农业大学资源与环境科学学院江苏南京210095
陈 雄,韦祎旸,李辉信,梁明祥,徐 莉(南京农业大学资源与环境科学学院,江苏 南京 210095)
附着剑菌对三氯联苯的吸附及降解机制研究
陈 雄,韦祎旸,李辉信,梁明祥,徐 莉*(南京农业大学资源与环境科学学院,江苏 南京 210095)
实验研究附着剑菌(Ensifer adhaerens.R2)对持久性有机污染物三氯联苯(2,4,4´-TCB,PCB28)的去除机制,探究菌株对2,4,4´-TCB的生物吸附和生物降解作用,以及其随时间、pH值、温度、菌体密度、金属离子(Ca2+、Mg2+)的变化.灭活菌体对PCBs的去除机制为生物吸附,吸附率在2h基本达到平衡,为85.97%;活体菌株可以通过生物吸附及生物降解作用去除2,4,4´-TCB,在本次实验周期内主要以吸附作用为主,2h吸附率为60.59%,明显高于降解率的12.90%.单因素条件下,pH值为6.0、35℃、OD为0.8、添加1mol/L的Ca2+、Mg2+处理可使活菌对2,4,4´-TCB的吸附达到最优;pH值为7.5,30℃,添加0.05mol/L的Ca2+、Mg2+处理可使活菌对2,4,4´-TCB的降解达到最优.
附着剑菌;三氯联苯;生物吸附;生物降解
多氯联苯(PCBs)是存在于环境中的一类具有“三致”效应的持久性有机污染物,由于广泛存在,且威胁着人类健康,引起各国政府、学术界、工业界和公众的关注.
我国大部分水体的PCBs污染水平较低,然而也有部分地区的水环境中存在严重的PCBs污染,如珠江、大连湾、松花江等均有较高的PCBs污染存在[1].常规净水工艺在应对水源中有机污染时,显得处理能力不足.生物修复以其环境破坏小、经济效益高、技术简便可行等优点,成为最具有潜力的污染修复方法之一[2].
目前已有许多利用微生物去除有机污染的研究,许多高效PCBs修复菌株被发现,真菌如白腐真菌(ligninolytic fungi);细菌如伯克霍尔德式菌(Burkholderia)、假单胞菌属(Pseudomonas)、红球菌属(Rhodococcus)[3-5].在剑菌(或称中华根瘤菌)方面,Bae等[6]报道了根瘤菌有耐受并转化广谱芳香烃化合物的能力,并且根瘤菌可与植物联合修复PCBs污染土壤[7-9],徐莉等[10]也发现苜蓿根瘤菌对低氯代多氯联苯及混合PCBs有较好的修复效果.但对于微生物去除PCBs的机制研究还不多[4],有对海洋青霉真菌去除PCBs的机制研究,得到菌体可通过吸附作用、共代谢降解作用,实现对PCBs的去除,其中吸附作用是有效去除的主导因素[11].而在微生物去除有机污染物机制中,除了吸附作用外,也有生物降解作用,有研究表明白腐真菌对多环芳烃的去除,在短期内主要为生物吸附作用,随着培养时间的延长,菌体的对多环芳烃的生物降解作用日益加强[12].
基于本实验室获得的具有2,4,4′-TCB单体去除能力的附着剑菌(Ensifer adhaerens. R2)作为主体,探究其去除机制,为进一步研发PCBs污染水体的修复技术提供理论依据.
1 材料与方法
1.1 材料与培养基
供试菌株:剑菌为本实验室所有,经鉴定为附着剑菌(Ensifer adhaerens),命名为R2,2h活菌和灭菌处理对20mg/L的2,4,4′-TCB去除率分别可达73.28%、91.47%.标准品2,4,4′-TCB购于北京百灵威化学技术有限公司.丙酮与正己烷为色谱纯,其他试剂均为分析纯.
甘露醇酵母汁琼脂培养基(YMA)组成:甘露醇10.0g,磷酸氢二钾(K2HPO4) 0.5g,硫酸镁(MgSO4·7H2O) 0.2g,氯化钠 (NaCl)0.1g,酵母汁(1%)100mL,蒸馏水900mL,固体培养基中加入15.0g/L琼脂粉.
磷酸缓冲液(PBS)母液组成:0.2mol/L磷酸氢二钠(Na2HPO4):71.6g溶于蒸馏水定容至1L;0.2mol/L磷酸二氢钠(NaH2PO4):31.2g溶于蒸馏水定容至1L.
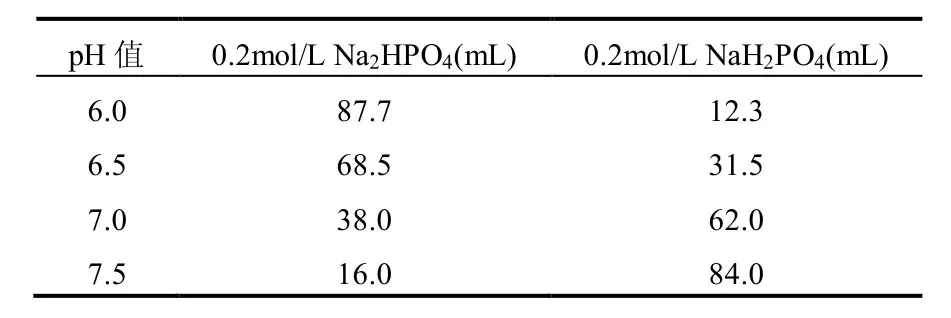
表1 不同pH值的PBS的配制Table 1 Preparation of PBS of different pH
1.2 附着剑菌的发酵培养
将菌种接种于YMA固体平板上30℃活化48h,挑取单菌落接入3mL液体种子YMA试管培养基中扩大培养,然后以1%的接种量(M/V)再次转接到50mL YMA液体培养基中30℃、180r/min培养24h.
1.3 附着剑菌去除2,4,4′-TCB的机制研究
将发酵培养的菌悬液(此时OD为1.3)离心(12000r/min、5min),收集菌体,用pH7.0的0.05mol/L 磷酸缓冲液(PBS)洗涤两次后重悬,将菌体转接入含有20mg/L的2,4,4′-TCB的PBS中,调整菌体OD值为0.8,30℃、180r/min摇床培养,设置活菌和灭菌两组处理.测定计算转化0.1、1、2、4、8、18、24h后2,4,4′-TCB的去除率、吸附率、降解率.
1.4 不同条件影响下附着剑菌对PCBs的生物吸附和生物降解作用
菌体离心、洗涤、用PBS重悬后,转接入以20mg/L的2,4,4′-TCB的PBS中,180r/min转化2h,选取pH值、温度、OD值、金属离子浓度四因素进行实验(如表2),考察其对菌株R2去除、吸附、降解2,4,4′-TCB的影响.
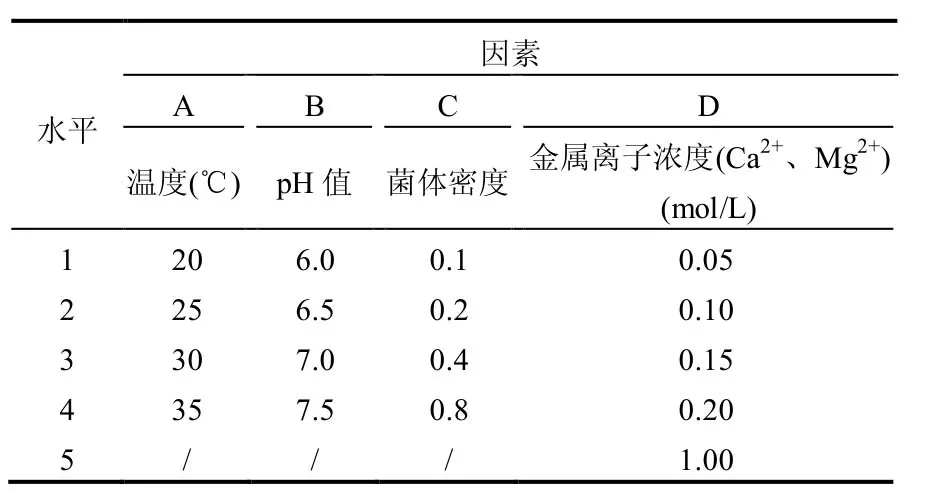
表2 实验因素与水平Table 2 Factors and levels of design
1.5 2,4,4′-TCB的提取和测定
菌株与2,4,4′-TCB加入到缓冲体系后,在设定的采样时间,全部菌液离心(3500r/min,10min),分别收集上清和菌体,用2倍体积的正己烷萃取,涡旋5min,静置1h,吸取两者上层清液,过0.22μm的滤膜,置于棕色进样瓶待测.
采用带有电子俘获检测器和自动进样的Thermo AS3000型气相色谱仪分析.色谱柱:DB-1701(30m × 0.25mm × 0.25μm),进样温度为260℃,检测器温度为300℃.程序升温:初始温度为120℃,0.5min,10℃/min梯度升温至180℃,持续1min,然后15℃/min梯度升温至250℃,持续25min.无分流进样1µL,载气为高纯氮,流速1.0mL/min.
1.6 数据处理方法
活菌去除率(%)=[(空白样中PCBs含量-上清中PCBs含量)/空白样中PCBs含量]×100%
活菌吸附率(%)=[菌体中PCBs含量/空白样中PCBs含量]×100%
活菌降解率(%)=活菌去除率(%)-活菌吸附率(%)
灭菌去除率(%)=[(空白样中PCBs含量-上清中PCBs含量)/空白样中PCBs含量]×100%
灭菌吸附率(%)=[(空白样中PCBs含量-上清中PCBs含量)/空白样中PCBs含量]×100%
采用SPSS 20.0统计分析软件进行数据分析及差异显著性检验;采用Origin8.0进行绘图.
2 结果与分析
2.1 附着剑菌对2,4,4′-TCB的生物吸附和生物降解作用
由图1可见在24h内,灭菌处理中去除率和菌体吸附率一致,并在实验时间范围内保持稳定,说明生物吸附是灭活菌体去除溶液2,4,4′-TCB的唯一途径.活菌处理下生物吸附和生物降解作用同时存在,且菌株的吸附率高于降解率,说明菌体在短期内主要发挥的是吸附作用[13].
灭菌处理的去除率明显高于活菌对照,这与Binupriya等[14]的研究结果相同,这主要可能是由于细胞经高温高压灭菌后,细胞壁破碎,使得更多的细胞表面官能团被暴露,出现更多的结合位点,显著提高了吸附性能[15-17].
随着时间的延长,2,4,4′-TCB去除率、菌体吸附率、2,4,4′-TCB降解率均呈先快速上升后平稳的趋势,在添加2,4,4′-TCB 6min后,活菌和灭菌处理的去除率分别达46.89%和82.14%,2h基本达到平衡,此时活菌处理的去除率、吸附率、降解率分别达73.28%、60.59%,16.09%,灭菌处理的去除率为91.47%,菌体吸附在短时间(2h)即可达到较高的吸附率与叶锦韶等[18]报道的菌体对有机物三苯基锡吸附的研究结果相似.推测菌体的吸附作用与根瘤菌细胞壁上的脂多糖(LPS)及一些胞外产物中的荚膜多糖(CPS),蛋白质和糖醛酸等聚复合体有关,这些物质表面存在丰富的官能团(羧基、氨基、羟基、磷酸基等),为PCBs提供了结合位点,使其易于吸附水体中的PCBs[17,19-22].
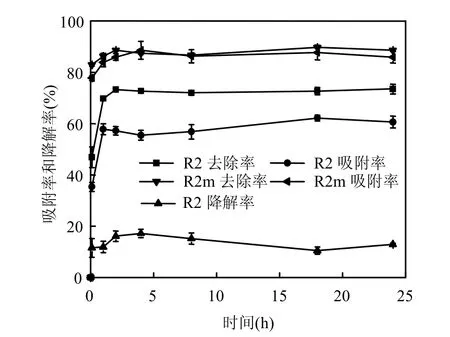
图1 附着剑菌R2对2,4,4′-TCB的生物吸附和生物降解随时间的变化Fig.1 Effect of time on the contributions of biosorption and biodegradation in removal of 2,4,4′-TCB by E. adhaerens
2.2 pH值影响下附着剑菌R2对2,4,4′-TCB的生物吸附和生物降解作用
由图2可见,不同pH值条件下R2活菌的吸附率总体高于降解率.其中吸附率随pH值升高呈先下降后逐渐平稳的趋势,6.0为最优pH值,此时吸附率为56.17%.这可能是由于pH值是影响生物吸附的重要因素之一,通常,它可以通过影响吸附剂及有机物的溶解性、电荷状况,对结合点位及静电作用为主要机制的吸附过程的影响尤为明显,pH 值对吸附的影响主要通过改变吸附质与吸附剂表面电性,进而影响二者间的静电作用来实现的[23],因为2,4,4′-TCB的分子结构与性质不会随pH值变化而明显变化,所以可能是pH6.0的环境更易于菌体表面的酸性多糖发挥活性从而促进吸附.Fu等[24]利用黑曲霉吸附刚果红的实验也出现了相同的结果,即在pH6.0时展现了最好的吸附效率.降解率随pH值升高呈上升趋势,最高可达19.45%,可能是中性环境更易于菌体的生长和相关的降解酶发挥活性的缘故.
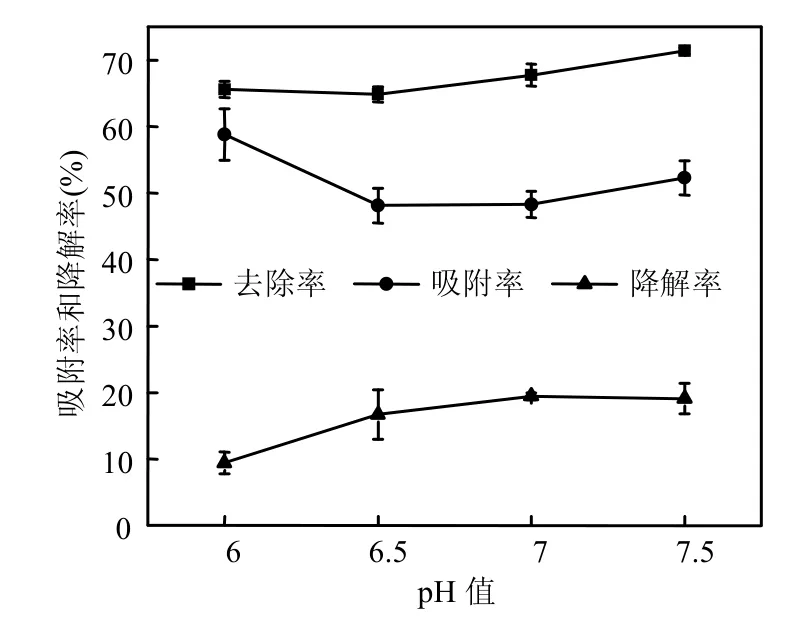
图2 pH值对附着剑菌R2对2,4,4′-TCB的生物吸附和生物降解的影响Fig.2 Effect of pH on the contributions of biosorption and biodegradation in removal of 2,4,4′-TCB by E. adhaerens
2.3 温度影响下附着剑菌对2,4,4′-TCB的生物吸附和生物降解作用
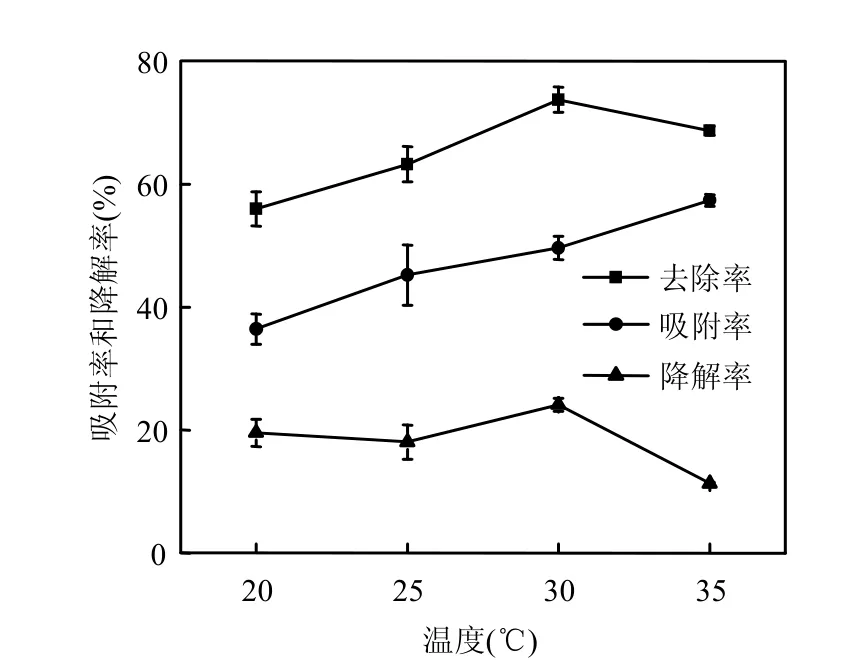
图3 温度对附着剑菌对2,4,4′-TCB的生物吸附和生物降解的影响Fig.3 Effect of temperature on the contributions of biosorption and biodegradation in removal of 2,4,4′-TCB by E. adhaerens
由图3可见,随着温度的升高,去除率呈先上升后略微降低的趋势,最高可达69.06%,吸附率同样明显高于降解率.吸附率随温度升高呈上升趋势,最高分别可达57.34%.这可能因为在此温度范围内菌体的吸附为吸热过程,温度升高更利于吸附反应的进行[16].降解率随温度升高呈下降趋势,可能是因为微生物对污染物的降解是一种酶促降解过程,温度的变化直接影响降解酶的活性,高温对酶活有一定的抑制作用.
2.4 OD值影响下附着剑菌对2,4,4′-TCB的生物吸附和生物降解作用
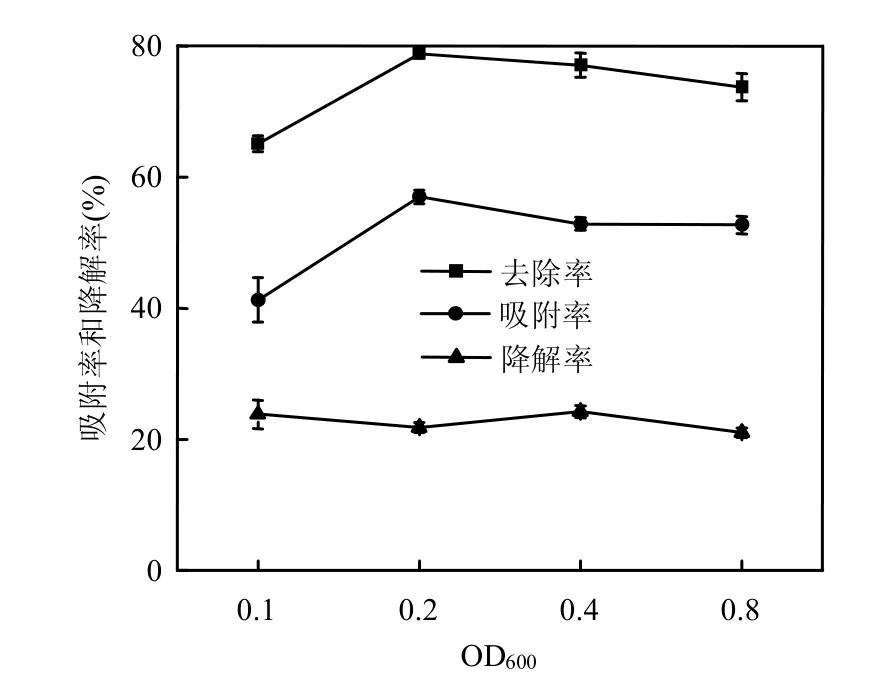
图4 OD对附着剑菌对2,4,4′-TCB的生物吸附和生物降解的影响Fig.4 Effect of OD on the contributions of biosorption and biodegradation in removal of 2,4,4′-TCB by E. adhaerens
由图4可见,随着菌体的增加,2,4,4′-TCB去除率呈上升而后逐渐平稳的趋势,活菌的吸附率高于降解率;吸附率及去除率均随OD值增加呈先升高后平稳的趋势,最高分别达56.99%、70.77%;说明一方面,菌量影响污染物的去除和吸附,这与Sreekumar等[25]的结论是一致的;但吸附作用是有限的,达到一定程度,吸附效率将不再提高,可能是由于吸附剂的浓度达到某一特定值后,菌体开始出现堆积,反而导致可用于吸附的净表面积减少,所以吸附效率没有上升,程林洁[26]关于木霉吸附废水中的铬的实验中也出现了类似的现象,实验所用附着剑菌能够产生丰富的多糖,多糖易使菌集结成团,影响了菌体有效吸附的面积,所以生物吸附效率在0.2~0.8OD没有明显变化.降解率随OD值增加没有明显变化,稳定在20%左右,PCBs的降解是酶促降解过程,菌体对污染物有一个适应过程和酶活的诱导激活过程,而本实验所设置的2h的时间周期可能相对来说较短,所以就是增加菌体密度,降解率也没有显著升高.
2.5 金属离子影响下附着剑菌对2,4,4′-TCB的生物吸附和生物降解作用
从图5可以看出,添加2种金属离子处理后,菌体的去除率呈上升趋势,菌体的吸附率依旧高于降解率,吸附率均随离子浓度的升高呈升高的趋势,Mg2+的处理效率高于Ca2+,Mg2+处理后吸附效率最高可达79.39%,Ca2+处理后吸附效率最高可达73.00%,这与漆叶琼等的研究结果相似[27],而降解率均随离子浓度升高呈降低趋势.可能是由于降解是酶促反应过程,有报道认为菌体的相关降解酶(如漆酶、木质素过氧化物酶、锰过氧化物酶、联苯双加氧酶等)的活性会受到Ca2+、Mg2+的调节,低浓度Ca2+、Mg2+会促进酶活性[28],而在高浓度情况下受到抑制,本实验条件设置的浓度可能相对较高,因此出现了抑制现象.关于钙镁对吸附的影响,有报道认为Ca2+、Mg2+处理后,菌体多糖的产量会得到提高,从而暴露更对的吸附位点,提高菌体的吸附能力[29].
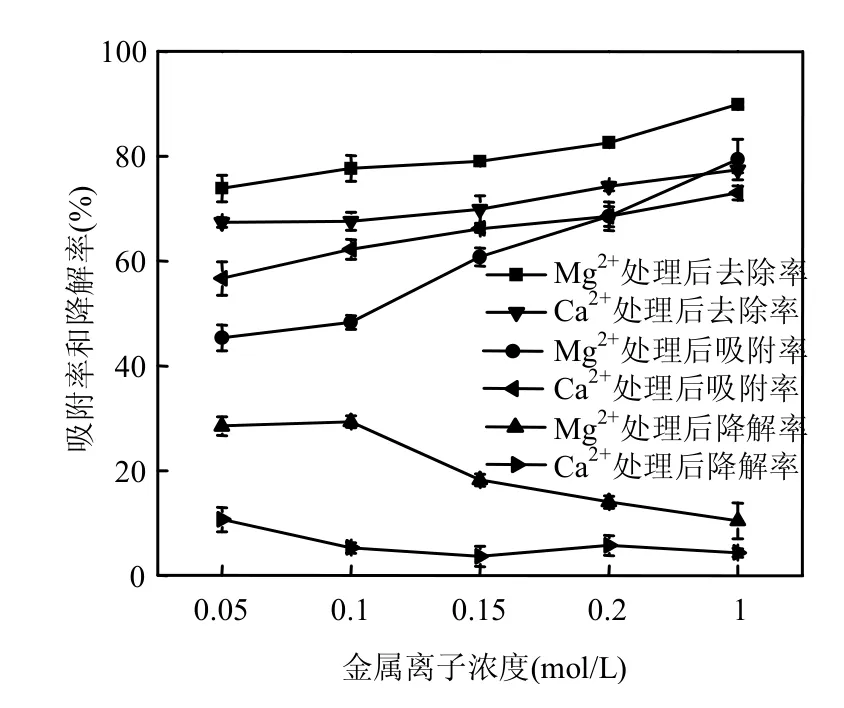
图5 不同浓度Mg2+、Ca2+对附着剑菌吸附2,4,4′-TCB和生物降解的影响Fig.5 Effect of metal ion on the contributions of biosorption and biodegradation in removal of 2,4,4′-TCB by E. adhaerens
3 结论
3.1 附着剑菌活菌对溶液中PCBs的去除包括生物吸附和生物降解作用,实验周期内生物吸附所占比列更大;剑菌的灭活处理对PCBs的去除机制为生物吸附,且吸附效率高于活菌处理.
3.2 附着剑菌对PCBs的去除在较短的时间内即可达到平衡,pH值、温度、OD值、金属离子处理均能不同程度地影响菌体对PCBs的吸附以及降解作用.活菌对PCBs的吸附效率随pH升高呈现先降低后平稳的趋势;随温度及Ca2+、Mg2+浓度升高呈增大的趋势,且Mg2+处理效率更高;随OD值增加呈先升高后平稳的趋势.活菌对PCBs的降解率随pH值呈先升高后平稳的趋势;随温度升高逐渐减小;随Ca2+、Mg2+浓度升高呈降低的趋势;降解率随菌体密度增加无明显变化.
[1]Xing Y, Lu Y L, Richard W D, et al.A spatial temporal assessment of pollution from PCBs in China [J]. Chemosphere,2005,60(6):731-739.
[2]Furukawa K, Fujihara H. Microbial degradation of polychlorinated biphenyls: Biochemical and molecular features[J]. Journal of Bioscience and Bioengineering, 2008,105(5):433-449.
[3]Monika C, Zdena K, Alena F, et al.Biodegradation of PCBs by ligninolytic fungi and characterization of the degradation products [J]. Chemosphere, 2012,88(11):1317-1323.
[4]Field J A, Sierra A R. Microbial transformation and degradation of polychlorinated biphenyls [J]. ENVIRONMENTAL POLLUTION, 2008,15(1):1-12.
[5]Seto M, Okita N, Hatta T, et al. Catabolic potential of multiple PCB transformation systems in Rhodococcus sp. Strain RHA1 [J]. Biotechnology Letters, 1996,18(11):1305-1308.
[6]Bae H S, Im W T, Suwa Y C, et a1.Characterization of diverse heterocyclic amine degrading denitrifying bacteria from various environments [J]. Archives of Microbiology, 2009,191(4):329-340.
[7]徐 莉,滕 应,张雪莲,等.多氯联苯污染土壤的植物-微生物联和田间原位修复 [J]. 中国环境科学, 2008,28(7):646-650.
[8]滕 应,骆永明,高 军,等.多氯联苯污染土壤菌根真菌-紫花苜蓿-根瘤菌联合修复效应 [J]. 环境科学, 2008,29(10):2925-2930.
[9]Veronika K, Petr S, et al. Plant-microorganism interactions in bioremediation of polychlorinated biphenyl-contaminated soil [J]. New Biotechnology, 2012,30(1):15-22.
[10]徐 莉,腾 应,骆永明,等.根瘤菌对多氯联苯降解转化特性研究 [J]. 环境科学, 2010,31(1):255-259.
[11]殷月芬.海洋青霉真菌对多氯联苯的移除效应研究 [D]. 青岛:中国海洋大学, 2011.
[12]丁 洁.白腐真菌对多环芳烃的生物吸附与生物降解及其修复作用 [D]. 杭州:浙江大学, 2012.
[13]丁 洁,陈宝梁,朱利中,等.黄孢原毛平革菌菌球对多环芳烃的生物吸附和生物降解作用 [J]. 科学通报, 2012,57(24):2276-2284.
[14]Binupriya A R, Sathishkumar M, Kavitha D, et al. Experimental and isothermal studies on sorption of Congo Red by modified mycelial biomass of wood-rotting fungus [J]. CLEAN-Soil Air Water, 2007,35:143-150.
[15]Zümriye Aksu.Application of biosorption for the removal of organic pollutants: A review [J]. Process Biochem., 2005,40:997-1026.
[16]Akkaya G, Ozer A. Biosorption of Acid Red274(AR274) on Dicranella varia: Determination of equilibrium and kinetie model Parameters [J]. Proeess Biochem., 2005,40:3559-3568.
[17]姜 晶,李 亮,李海鹏.等.蛋白核小球藻对Pb(Ⅱ)和Cd(Ⅱ)生物吸附及其影响因素 [J]. 生态学报, 2012,32(7):1995-2003.
[18]叶锦韶,史一枝,尹 华,等.三苯基锡吸附降解菌的分离及特性研究 [J]. 环境科学, 2009,30(8):2452-2457.
[19]Mameri N, Boudries N, Addour L, et al. Batch zinc biosorption by a bacterial nonliving Streptomyces rimosus biomass [J]. Water Research, 1999,33(6):1347-1354.
[20]方 堃.海洋微藻对多氯联苯的吸附作用研究 [D]. 大连:大连海事大学, 2006.
[21]张媛媛,杨朝晖,曾光明,等.微生物絮凝剂MBFGA1的结构鉴定及絮凝机理研究 [J]. 中国环境科学, 2013,33(2):278-285.
[22]胡学伟,李 姝,荣 烨,等.不同EPS组成生物膜对Cu2+吸附的研究 [J]. 中国环境科学, 2014,34(7):1749-1753.
[23]张海波.粉末活性炭对水中PCBs的吸附性能及主要影响因素研究 [D]. 哈尔滨:哈尔滨工业大学, 2011.
[24]Fu Y, Viraraghavan T. Removal of Congo Red from an aqueous solution by fungus Aspergillus niger [J]. Advances Environ. Res.,2002,7:239-247.
[25]Sreekumar O, Hosono A. The heterocyclic amine binding receptors of Lactobacillus gasseri cells [J]. Mutation Research, 1998,421:65-72.
[26]程林洁.拟康宁木霉处理含铬废水的机理研究 [D]. 厦门:集美大学, 2012.
[27]漆叶琼,张佳涛,潘向辉,等.乳杆菌吸附苯并芘的特性 [J]. 2011,51(7):956-964.
[28]任秀娟,范长征,鲁伦慧,等.农业废物堆肥中高产漆酶新菌株的分离鉴定及酶学性质研究 [J]. 环境科学, 2012,33(9):3220-3227.
[29]李 敏,田亚宾,闫 伟.金属离子对蒙古口蘑菌体及胞外多糖的影响 [J]. 中国食用菌, 2011,30(6):32-34.
Biosorption and biodegradation mechanisms of trichlorobiphenyl by Ensifer adhaerens.
CHEN Xiong, WEI Yi-yang,LI Hui-xin, LIANG Ming-xiang, XU Li*(College of Resources and Environmental Science, Nanjing Agricultural University, Nanjing 210095, China). China Environmental Science, 2015,25(5):1423~1428
This study was aimed to investigate the bio-dissipation mechanisms of 2,4,4´-trichlorobiphenyl (2,4,4´-TCB,PCB28) by Ensifer adhaerens, and explore the variation of the biosorption and biodegradation with the changes of time,pH, temperature, optical density, metal ions (Ca2+、Mg2+). The removal mechanism of 2,4,4´-TCB by dead E. adhaerens was biosorption, the adsorption efficiency reached a plateau after 2h incubation,which was 85.97%. Both biosorption and biodegradation contributed to the removal of 2,4,4´-TCB by live E. adhaerens in water, and in this experimental period biosorption was dominated. The adsorption efficiency and degradation efficiency were 60.59% and 12.90% respectively. The highest adsorption efficiency of live strain was occurring at pH of 6.0, temperature of 35℃, OD of 0.8, cell pretreated with 1mol/L metal ion. The optimal degradation efficient of live strain was under the condition of 7.5pH, 30℃, biomass pretreated with 0.05mol/L metal ion.
Ensifer adhaerens;2,4,4´-trichlorobiphenyl;biosorption;biodegradation
X52,X172
A
1000-6923(2015)05-1423-06
陈 雄(1989-),女,江苏高邮人,硕士研究生,主要从事土壤生态及生态修复技术研究.
2014-09-19
江苏省自然基金(BK2011655);中国科学院土壤环境与污染修复重点实验室(南京土壤研究所)开放基金;江苏省优势学科项目
* 责任作者, 副教授, xuli602@njau.edu.cn
