广州市流溪河河岸带土壤反硝化作用的多尺度影响因子
2015-11-19魏建兵吴志峰钟世锦何元庆吉冬青中国科学院广州地球化学研究所广东广州10640广东省生态环境与土壤研究所广东广州1060中国科学院大学北京100494沈阳大学区域污染环境生态修复教育部重点实验室辽宁沈阳110044广州大学地理科学学院广东广州10006
刘 庆,魏建兵,吴志峰,钟世锦,何元庆,吉冬青(1.中国科学院广州地球化学研究所,广东 广州10640;.广东省生态环境与土壤研究所,广东 广州 1060;3.中国科学院大学,北京 100494;4.沈阳大学区域污染环境生态修复教育部重点实验室,辽宁 沈阳 110044;.广州大学地理科学学院,广东 广州 10006)
广州市流溪河河岸带土壤反硝化作用的多尺度影响因子
刘 庆1,2,3,魏建兵4*,吴志峰5,钟世锦5,何元庆2,吉冬青2(1.中国科学院广州地球化学研究所,广东 广州510640;2.广东省生态环境与土壤研究所,广东 广州 510650;3.中国科学院大学,北京 100494;4.沈阳大学区域污染环境生态修复教育部重点实验室,辽宁 沈阳 110044;5.广州大学地理科学学院,广东 广州 510006)
以广州市水源地流溪河二级支流的河岸带为研究对象,分析嵌套结构的多尺度因素对河岸带土壤反硝化作用的影响,确定调节河岸带土壤反硝化酶活性的不同尺度控制因素.结果表明:以土壤反硝化酶活性表征的反硝化潜力,其在研究区内的剖面尺度空间变异性显著大于断面尺度和流域景观尺度;反硝化酶活性的空间变异受多尺度因子的作用,其中剖面尺度中土壤有机碳、全氮、硝态氮等因子对其空间分布起主要的直接控制作用,而断面尺度的景观位置、植被密度与流域景观尺度的地形指数、高程及土地利用类型等因子通过影响土壤性质而间接调控反硝化酶的空间分异性;研究区的反硝化酶活性在剖面尺度中表层最高,随着深度增加呈急剧减小的趋势;断面尺度中活性值最高位于河岸区中间的景观位置,因该位置具有良好的景观连接性和较高的植被密度;流域景观尺度中,除受人为扰动严重城市化地区外,河岸带土壤反硝化酶活性沿流域从上游至下游呈不断增加的趋势.
反硝化作用;河岸带土壤;多尺度;控制因素
河岸带作为陆地和水体之间的过渡缓冲带,在控制来自陆地非点源的氮素过程中发挥着重要的作用,是溪流生态系统健康维护研究的重点区域[1-2].该区域通过反硝化作用去除来自高地土地利用的硝态氮,是流域硝态氮的有效“汇”[3],也是截留转化陆地污染物防止其进入水生环境的最后一道屏障.河岸带土壤反硝化作用的终产物为气体,不同于起临时存储作用的植物吸收和微生物固氮过程,是一种永久去除氮污染物的生物过程[4],因此,通过保护或修复河岸带,可促进其经土壤反硝化过程对陆源过量氮素去除作用的发生,从而维护较好的水质质量,是一种有效的非点源污染控制途径,得到了广泛的应用.
不同层次结构因素对土壤微生物过程的影响和调控是河岸带缓冲功能研究的重点之一.该过程的空间格局与水文地貌和地形变化等具有密切相关性[5].如陆地生态系统中,高程[6]、地形位置[7]、水文路径[8]等的变化可通过间接影响土壤物理结构、植物生长等参数而作为土壤微生物过程空间变异的驱动力.作为河岸带土壤反硝化作用在剖面尺度上的主要影响因子,河岸带有机碳、总氮、水溶性碳、硝态氮、土壤质地、土壤湿度、温度及pH值等土壤环境参数的时空变异性可引起土壤反硝化作用的高度变异[9-11],而空间位置、地形条件、植物群落特征、人为干扰、水文格局、土壤管理制度等系列景观尺度因子也会引起剖面尺度上的这些参数的变化[12-13].因此,河岸带土壤反硝化能力的预测需要综合剖面、断面及景观特征等多尺度因子进行分析[14].目前,针对河岸带剖面和断面尺度因子的监测、分析较为多见[11,14-15],而考虑流域空间位置、地形特征、人为影响程度等中尺度景观因素的研究较为缺乏[14].
流溪河是珠江流域广州市北部的一条重要河流,担负着向广州市供应60%饮用水源的重要任务.近年来,由于该流域农业集约化发展、旅游设施开发和城镇化推进,河岸缓冲带受到了不同程度的破坏,水源的质量保障面临严峻的挑战,流溪河水体污染以氮磷为主,其中流域硝态氮含量不断增加,导致水环境质量下降的问题逐渐凸显[16].本研究根据研究区异质景观的流域特征,综合考虑景观尺度、横断面尺度及土壤剖面尺度因素设计了嵌套分层结构进行采样,以土壤反硝化酶活性为表征指标,分析其在流域空间中的变异性及影响因素,为探索河岸带土壤反硝化潜力的预测方法及河岸生态系统净化水质功能的修复和维护提供依据.
1 材料与方法
1.1 研究区概况
流溪河是北江下游的一条支流,位于珠江三角洲的中北部,是广州市的主要饮用水源.全长171km,流域总面积2300km2.属于华南亚热带湿润季风气候区,气候温和,雨量丰沛,流域多年平均降雨量为2104.4mm,雨量集中在4~9月,雨季降雨量占全年的81.3%.地貌主要为中上游河段的山地丘陵和下游的冲积平原;整体地势为东北高,西南低;土壤成土母岩多为花岗岩,部分为石英岩和页岩.土壤类型从上游至下游主要为高山地带的黄壤、上游的红壤、中游的赤红壤及位于下游冲积平原上的水稻土;土地利用类型上游地区主要为林地,中游地区主要为园地和旅游区,耕地、城市建设用地大部分分布在中下游低平地带,整体显示出上游到下游方向上自然景观的递减,农业景观、城镇景观递增的梯度变化[17],这种空间分布特征在珠三角乃至其他华南沿海地区中尺度流域中具有典型代表性.整个流域农业、旅游业和城镇化的扩张导致生态环境恶化,水质呈不断下降趋势[18].
1.2 实验设计
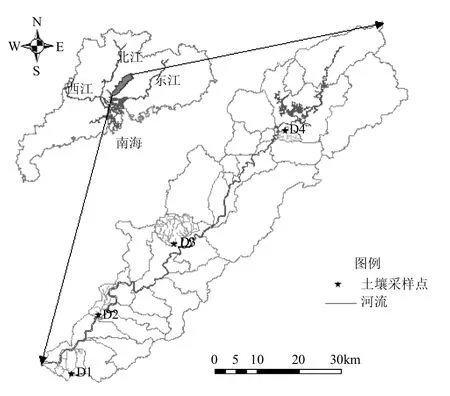
图1 流溪河流域位置、土壤采样点所在的支流流域Fig.1 Location of Liu Xi River Watershed,sub-watersheds of soil samples
2014年6月,沿流溪河从下游至上游的地形和土地利用异质性梯度,选择4个支流的河岸带(D1、D2、D3、D4,图1)为试验样地,每块样地根据距河流边缘远近选择3个不同景观位置(H、M、L)设置剖面,建筑用地为背景的样地根据下游流域高度城市化的实际情况,只设置了距河边最近位置的剖面L,具体描述如表1所示.每个剖面根据土壤发生层进行3个层次(h、m、l)的土样采集,采好的土样装入自封袋冷藏保存带回实验室,剔除杂物后,充分混匀分成3份,一份24h内进行鲜样土壤反硝化酶活性的测定,一份自然风干测定土壤理化指标,第3份进行冷冻保存,用于后期土壤生物学性质分析.考虑实验流域河岸带土壤空间差异性的主要控制因素为土地利用类型和地形高程,因此采样点和结果分析视角主要从剖面、断面、流域3个尺度展开.

表1 河岸带土壤采集样点描述Table 1 Descriptive of soil sampling sites in riparian zone
1.3 数据获取方法
土壤反硝化酶活性(DEA)的测定采用乙炔抑制法[19].称取等价于20g干土的鲜土放入6个150mL盐水瓶中,其中3个瓶中加入15ml含有10mg NO3/L溶液和5mL去离子水的溶液,另外3个瓶中只加入20mL去离子水,密闭后的试剂瓶充30min的无氧氮气,后充入使瓶内乙炔气体分压为10kPa( 10% V/V)的高纯乙炔,在25℃下以125r/min的转速进行无光振荡培养,分别于2、4h抽取顶空气体1mL取样分析,反硝化酶活性以2次取样N2O的浓度差计算,N2O浓度的测定采用岛津气相色谱仪GC7890A.
土壤有机质用重铬酸钾容量法-外加热氧化法测定;全氮用硫酸-过氧化氢消煮法,半微量开氏法测定;土壤溶解性碳的测定采用K2SO4浸提、重铬酸钾消化法测定;土壤铵态氮、硝态氮的测定采用2mol/LKCl溶液浸提,纳氏试剂比色法测定上清液铵态氮含量,紫外分光光度法测定上清液硝态氮含量;土壤含水率用105℃,24h烘干法测定;pH值选用pH计电位法(土水比1:10);土壤质地采用比重法[20].
利用广州市2009年1:1万土地调查变更数据和2012~2013年野外调查获取研究区的土地利用空间信息,将研究区域的土地利用类型分为林地、建筑用地、耕地、园地、水域和其他共6类.地形指数、高程、坡度等地形属性主要基于10m分辨率的数字化高程模型进行提取、运算;其中地形指数公式TI=ln(α/tanβ)可定量反映土壤蓄水和排水的综合状况,表征区域在流域尺度中土壤的相对湿度.
1.4 数据分析方法
使用Minitab17.0软件的嵌套方差分析对不同尺度中土壤反硝化酶活性进行方差分量估算及显著性检验,使用SAS9.0进行单因素多重比较检验不同土地利用间、不同景观位置间及不同深度土层间土壤反硝化酶活性的差异性,土壤反硝化酶活性与各尺度影响因素间的相关性主要通过SPSS22.0分析,同时利用CANOCO5.0软件实现偏冗余分析,Oringin9.1软件主要用于图表绘制.
土地利用类型、景观位置及土壤层次等定性变量先对其进行哑变量转化后再进入统计分析的数列中,方法主要是对其进行0/1赋值[21],具体为:4种不同的土地利用类型(建筑用地/耕地/园地/林地),可分解为相应的4个哑变量,均表示为0(不存在)和1(存在),景观位置(H/M/L)与土壤层次(h/m/l)用同样的方法进行哑变量化,最终把所有需统计分析的定性变量转化为多个哑变量.
2 结果分析
2.1 不同尺度下的河岸带土壤反硝化酶活性与土壤环境因子的空间差异性
河岸带土壤反硝化酶活性(DEA)的测定值为0.797~213.112μg N/(kg·h),存在明显的空间差异性.嵌套方差分析(表2)表明,DEA在剖面尺度中的空间变异性占总变异的方差贡献率为66.03%,显著高于断面尺度的9.06%和流域尺度的24.91%,说明河岸带土壤反硝化酶活性的空间变异性主要体现在剖面尺度上;单因素多重比较检验结果如图2所示:在剖面尺度中,土壤垂直剖面的表层与其他层次的DEA存在极显著差异水平(P<0.0001),明显高于其他2层.整体来看,随着土层深度增加,该活性值急剧减小.断面尺度中距河边不同距离间DEA呈显著差异水平(P=0.028),其中处于中间位置的M土壤反硝化酶活性显著高于远离河边位置的H点的数值,虽然也高于邻近河边位置的L点数值,但差异性不明显,其比H与L点分别高出43.12%和21.28%.流域尺度上中下游间的土壤反硝化酶活性存在极显著差异水平(P=0.001),其中位于流域下游偏上的D2点DEA显著高于下游偏下的D1点和流域上游的D4点,D2点虽然数值高于D3点,但两者间差异不明显;除最下游建筑用地为背景的D1点DEA偏低外,流域尺度的河岸带土壤反硝化酶活性呈沿流域从上游至下游逐渐增大的空间分布特征.
同时表2也显示了各主要土壤因子在不同尺度下的空间异质性情况.其中,剖面尺度的各土层间硝态氮、总氮、全碳及水溶性碳存在显著差异性;横断面尺度的各景观位置间除了上述因子外,pH值也呈现出显著差异水平;而景观尺度的各采样区除了上述所有因子外,土壤质地与其他指标一样均具有显著的空间异质性.
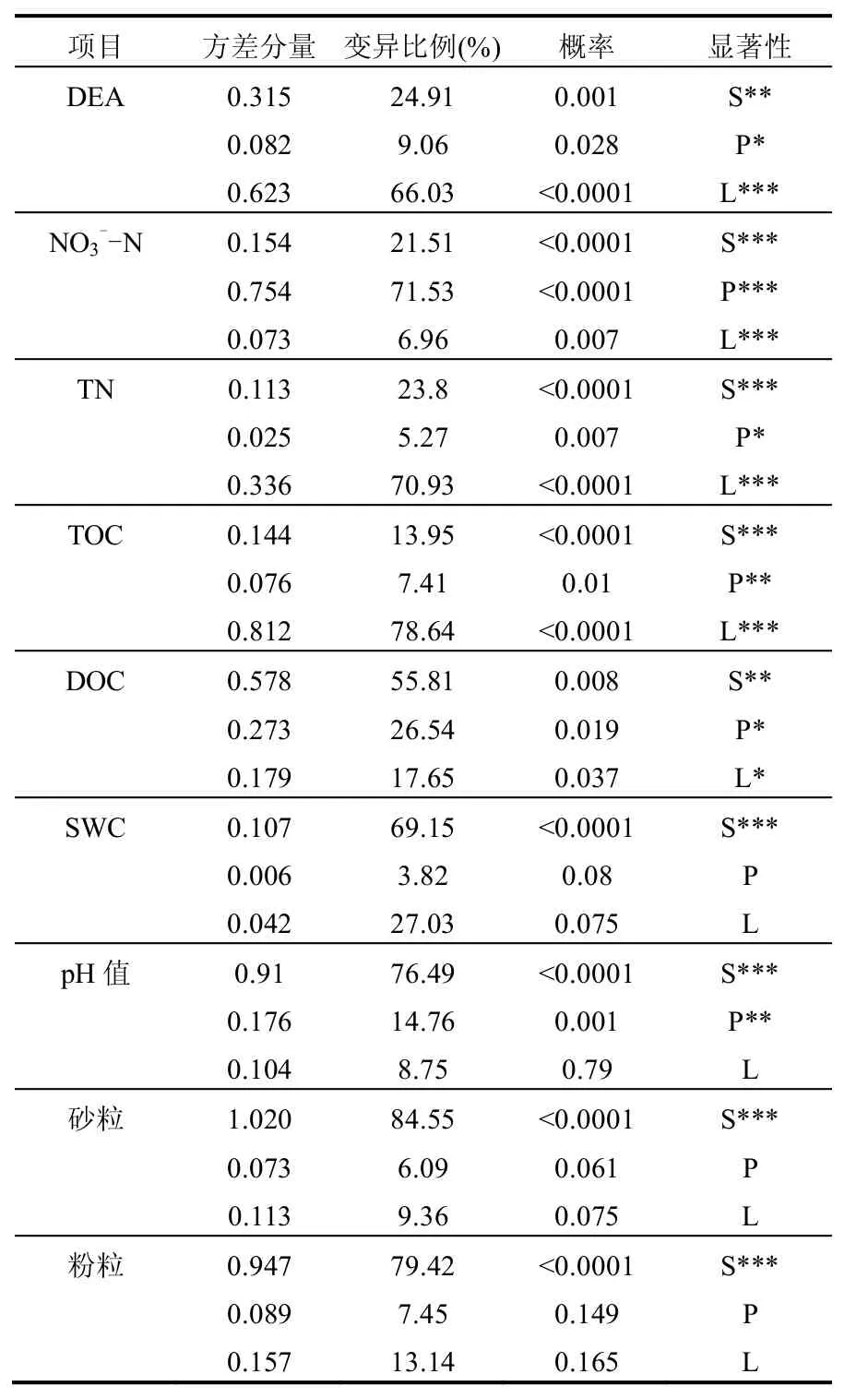
表2 多尺度河岸带土壤反硝化酶活性与土壤参数的嵌套方差分析Table 2 Nested ANOAVA of soil DEA and soil parameters among different scales in riparian zone
2.2 河岸带土壤反硝化酶活性与多尺度空间因素间的相关性
不同尺度的空间因素与河岸带土壤反硝化酶活性的相关矩阵结果表明(表3):在剖面尺度中,DEA与土壤氨氮、pH值及质地相关性不显著,与其他土壤环境参数呈显著正相关,其中与土壤有机碳和总氮呈极显著正相关,说明在剖面尺度中土壤碳氮元素是主要的DEA影响因子,且表层h与土壤中DEA、氨氮、全氮、总碳及水溶性碳呈极显著正相关,而底层l与之相反,与这些因子呈负相关关系;断面尺度中,DEA与景观位置M呈极显著正相关关系,与其他2个位置相关性不显著,同时M位置与土壤中硝态氮、有机碳及全氮含量也呈显著正相关关系,说明景观位置通过影响土壤中碳氮含量的空间分布间接影响DEA在断面尺度中的空间变异性;流域景观尺度中,DEA与地形指数、耕地比例及耕地用地类型呈显著正相关,而与坡度、林地比例、建筑用地类型呈显著负相关,说明高海拔地区的流域上游的林地土壤中DEA活性值较低,而位于平缓的流域下游的耕地土壤中DEA活性值较高.同时还可看出,地形指数、耕地比例及耕地类型与土壤水分、土壤粉粒含量呈极显著正相关,与土壤砂粒含量呈极显著负相关,而海拔高度、坡度及林地比例正好与此相反,说明在高海拔、高坡度及低地形指数的林地为主的流域上游土壤主要以排水性能良好的砂土为主,而居于平缓的耕地为主的流域下游土壤主要以蓄水能力较强的壤粘土为主,且耕地比例与硝态氮呈极显著正相关,说明耕地是硝态氮负荷的主要贡献源,为DEA反应时提供丰富的有效态氮;这些均表明居于流域下游的以耕地为主的土壤环境利于发生土壤反硝化作用,而上游以林地为主的土壤环境不利于土壤反硝化作用的发生.
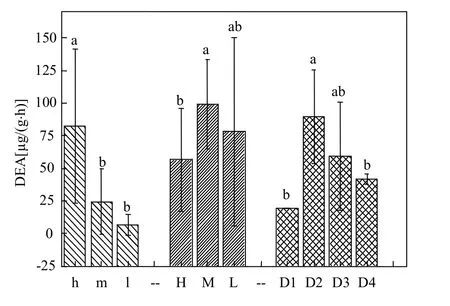
图2 不同空间尺度河岸带土壤反硝化酶活性的变异性Fig.2 Spatial variability of riparian soil DEA among different scales
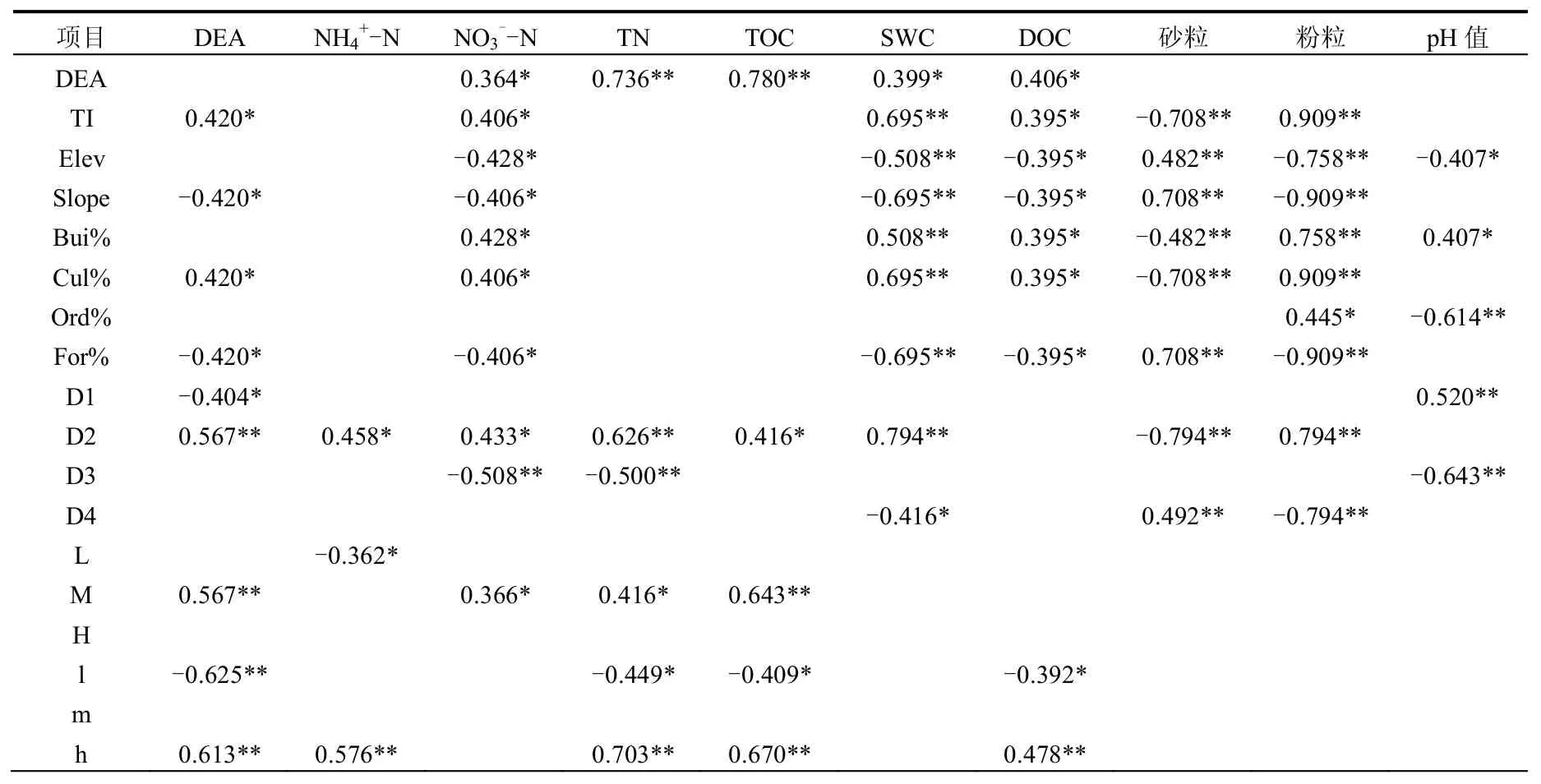
表3 河岸带土壤反硝化酶活性与环境因子的相关性分析Table 3 Correlation between soil DEA and environmental factors in riparian zone
2.3 多尺度空间因子对河岸带土壤反硝化酶活性空间分异的贡献大小分析
虽然上述结果可识别影响河岸带土壤反硝化酶活性的主要因子,但却难以从整体上区分各尺度影响因子对DEA变异贡献的大小.因此本研究采用偏冗余分析的方法,辨析各尺度因子对河岸带土壤DEA变异的解释能力.结果如图3所示,所选的3个尺度的所有影响因子可以解释河岸带土壤反硝化酶活性空间变异的84.7%,可见这些因子能够在很大程度上决定DEA在河岸带土壤中的空间分布情况;其中,剖面尺度中土壤碳氮等元素的空间分布情况是影响DEA变异的主要环境变量,其占到总解释变异的95.3%(0.807/0.847),断面尺度因子和流域景观尺度因子分别只占总解释变异的12.4%(0.105/0.847)和9.3%(0.079/ 0.847),而两两间组合后对DEA空间变异的解释性却起到了削减效果.总之,河岸带土壤反硝化酶活性的空间变异性主要受剖面尺度中具有空间差异性的土壤碳氮等因子直接调控,其效果远高于断面尺度、景观尺度因子对其的间接影响.
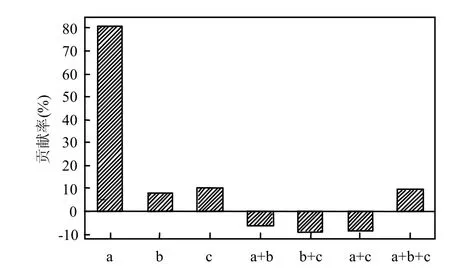
图3 各尺度因子及其相互作用对河岸带土壤反硝化酶活性变异解释的贡献率Fig.3 Contribution rate of all scale-factors and their interaction on soil DEA variation in riparian zone
3 讨论
3.1 剖面尺度土壤因子对反硝化酶活性的影响
嵌套方差分析结果表明,河岸带土壤反硝化酶活性的空间异质性主要发生在剖面尺度上(方差贡献值达66.03%),同时偏冗余分析结果显示,该尺度的影响因子对反硝化酶活性的空间分布情况起主要调节作用(占总解释度的95.3%),因为河岸带土壤中硝态氮、总氮、总碳及水溶性碳等参数在空间中呈现非匀质性其直接影响反硝化作用在剖面尺度中的空间变异性[10,22],表2的嵌套方差分析也显示了该结果.此结论与Groffman等[23]研究的结果相反,其报道认为景观尺度因子对土壤反硝化作用的影响大于微尺度因子对该作用的影响[28],因为该研究区域位于美国密歇根州北温带森林区,而本研究区域位于中国广东亚热带,且由于研究的土质和土壤排水级别均具有区域尺度的异质性,所以其选择的土壤质地和土壤排水级别作为景观尺度因子来分析土壤反硝化酶活性的空间异质性,而本研究区域的土壤质地在小范围内就存在高度异质性,基于此本研究界定为剖面尺度理化因子,因此可能是因为2个研究案例区的自然地理和景观特征等具有显著的不同而导致不一致的结果.
从土壤剖面垂直分异性上看,表层活性极显著高于其他层次(P<0.0001),这与前人研究得出的土壤反硝化作用对硝态氮去除能力主要发生土壤剖面表层的结果一致[13,22],其原因在于表层土壤根系密度、碳氮含量和微生物活性最高[23],且由于在深层土壤中可利用的有效碳氮基质含量较低,不利于反硝化作用的发生,而使表层下的土壤中DEA值较低[11],本研究的相关分析也证实了该论点.相关矩阵结果表明,土壤有机碳、水溶性碳、全氮、硝态氮及水分等土壤性质与DEA间呈显著正相关.因为土壤有机碳的矿化作用不仅提供还原所需的电子,而且提供反硝化酶生长的有机底物和能量,同时有机质的分解会消耗土壤中的氧气,有利于缺氧环境的形成[24-25];并且由于水溶性碳不是唯一的电子供体提供者,土壤有机碳含有的其他形态的碳也可能影响反硝化作用[26],因此土壤有机碳与DEA的相关系数值高于水溶性碳[15].而土壤总氮给反应基质库在矿化后提供足量的硝酸根和氨氮离子[27],硝态氮是反硝化作用发生的电子受体,因此可知土壤各形态氮含量也是影响DEA的重要微尺度因素.土壤水分含量通过影响土壤溶氧量而间接调控DEA的反应[28].本研究中DEA与土壤pH值相关性不显著,说明在剖面尺度中pH值不是重要的限制DEA的调控因子,可能因为该地区的土壤pH值均偏小(除D1点外),低于前人所研究的土壤DEA发生反应时的最佳pH(7.0~8.0)范围[25],但也有研究表明:土壤有机质、全氮、可溶性碳等与土壤反硝化作用不具有显著的相关性,反而pH值与之具有密切关系[29].
总之,在剖面尺度中,河岸带表层土壤是反硝化作用发生的热点区域,随着深度的增加而急剧下降,研究区的河岸带土壤碳氮、水分含量等因子对DEA变异的贡献值较大.这些研究结果可为河岸带土壤管理中剖面尺度反硝化作用重点区位和关键影响因子的识别提供指导.
3.2 河岸带断面尺度的调控因子对土壤反硝化酶活性的作用
嵌套方差分析表明,断面尺度的河岸带土壤DEA的空间变异性占总变异的9.06%,主要体现在河岸带土壤DEA在不同景观位置间呈差异显著水平(P=0.028),处于中间位置的M土壤反硝化酶活性显著高于远离河边位置的H点的数值,虽然也高于邻近河边位置的L点数值,但差异性不明显;偏冗余分析显示该尺度中的一些因子可解释DEA空间变异性10.5%之多,相关分析表明该尺度因子中只有景观位置M点与DEA呈极显著正相关,该点位于距河岸带中间位置,而近邻河边位置的L与远离河边位置的H与其相关性不显著.实地观察可知,由于景观位置M点植被密度较高,可给土壤提供丰富的利于发生反硝化作用的有效碳氮源[26,30],相关矩阵也表明,景观位置M与土壤硝态氮、全氮及总碳呈显著正相关关系;研究区所有横断面的H位置与M/L间隔有短距离的田间小道,阻断了植被景观连接,影响了土壤元素在横断面上的迁移转化;另外,由于在经过从M到L路径时发生了明显的反硝化作用,导致L位置硝态氮含量减少,制约了该位置发生土壤反硝化作用,而使L位置与土壤DEA及硝态氮含量均呈显著负相关,此结果也证实了有效植被的河岸带对硝态氮有显著的去除功能[29,33]; Ullah等[14]研究指出,河岸带土壤水分含量在景观位置间的差异性会引起DEA在横断面尺度的空间异质性,即不同景观位置河岸带土壤水分含量呈现出差异显著水平.但本研究相关分析结果却显示,景观位置与土壤水分含量间相关性不显著,同时嵌套方差分析结果也显示土壤水分在该尺度未出现显著差异水平,说明可能由于研究区河岸带宽度较窄,距河边从远至近的土壤水分含量空间差异性不明显,由此可知在该尺度下土壤水分含量不是主要的反硝化酶活性的间接影响因子.
总之,在较窄河岸带的断面尺度中,土壤反硝化作用主要发生在离开水域一定距离,且该位置具有良好的景观连接性和较高的植被密度,而邻近河边和离开水域较远距离处DEA值相对却较低.此结论与前人研究报道的结果一致,认为景观位置是DEA的一个重要调节因子;其中Groffman等[23]研究指出代表不同景观位置的土壤质地和排水性能通过影响土壤湿度、养分含量等来调控土壤反硝化作用,Florinsky等[13]与Ullah等[14]的研究也指出,不同的景观位置通过影响土壤中碳氮含量、土壤湿度等因子间接对DEA含量进行调节,在植被茂密、湿润的景观位置DEA值要明显高于稀疏植被、干旱土堆的景观位置上的DEA值,景观位置的不同可导致DEA值的显著差异性;该研究结果在河岸带生态修复断面宽度的选择和植被覆盖度的设计等方面具有指导价值.
3.3 流域尺度的景观因子对土壤反硝化酶活性的影响
嵌套方差分析结果表明,流域景观尺度的河岸带土壤DEA的空间变异性占总变异的24.91%,图2显示,该尺度DEA的空间差异性主要体现在耕地河岸带样区D2的值高于其他样区,偏冗余分析结果显示该尺度的影响因子只解释了DEA在空间变异性的7.9%之多,主要受土壤自然属性和人为干扰所影响,位于流域上游林地背景的河岸带D4样地,处于高海拔、低地形指数的山地地区,由于土壤发育不完全,该地类与土壤砂粒含量呈极显著正相关,与土壤水分呈负相关,表明土质主要以砂土或砂壤土等排水良好、蓄水较差的类型为主,该类土质水分含量较少,溶氧较高,这些特点不利于反硝化作用的发生,相关矩阵结果亦表明,D4点与DEA呈负相关;而居于流域下游以耕地类型为主的样地D2,地貌类型主要是海拔较低、坡度平缓的冲积平原,其土壤发育较完善,该地类与土壤粉粒和水分含量呈显著正相关,与土壤砂粒含量呈负相关,表明以壤土、粘壤土等排水较差、蓄水良好的土壤类型利于发生反硝化作用,该结论与前人研究报道内容一致,认为土壤质地和排水性能是影响反硝化酶活性的主要物理因素[28].以耕地为主的D2样地,人为施肥的干扰强度较大,土壤外源硝态氮含量较高,可供给反硝化作用发生时所需的有效氮,相关矩阵结果也表明,D2点与硝态氮含量和DEA均呈显著正相关,同时也说明耕地是硝态氮的主要负荷来源.
而处于高度城市化区域的D1点,由于其土壤受到严重的人为扰动,剖面没有呈现土壤学应有的发生规律,土壤质地以砂壤为主,含水性能较差,且由于植被密度较低,可提供给土壤反硝化作用所需的碳氮含量有限;同时由于城市流域地表径流主要通过城镇雨水管网直接输送至河流[31],使该点的河岸带地表硝态氮含量较少;整个剖面土壤中杂有大量的垃圾、砖石等,导致土壤pH值偏高,超过适于发生土壤反硝化酶活性的范围[31],综合这些因素可知,D1样地的河岸带反硝化作用较弱,该结果与相关分析一致,显示D1点与河岸带土壤反硝化酶活性呈负相关关系.
总之,流域景观尺度的中地形指数、坡度、海拔、土地利用类型等因子直接调控土壤水分、土壤质地及硝态氮含量等的空间分布,而间接影响河岸带土壤反硝化作用的空间变异性;而城市化等硬质地表的大量增加,严重影响了河岸带土壤反硝化酶活性在流域景观尺度上的分布规律.
4 结论
4.1 研究区域中,河岸带剖面尺度的反硝化酶活性空间异质性大于断面尺度和流域景观尺度,该尺度的土壤有机碳、全氮、水溶性碳等参数是河岸带土壤反硝化酶活性空间变异的主要影响因子;且在该尺度中反硝化酶活性主要发生在土壤表层,随深度的增加其值急剧下降.
4.2 河岸带断面尺度的反硝化酶活性主要发生在河岸区域的中间景观位置,且该位置具有良好的景观连接性和较高的植被密度.该尺度的景观位置、植被密度等因子通过影响土壤有机碳、总氮、硝态氮含量的空间分布而间接影响|DEA的空间变异性.
4.3 流域尺度中,除建筑用地背景的样点外,河岸带土壤反硝化酶活性从上游至下游逐渐增加,该尺度主要通过海拔高度、地形指数及土地利用类型等景观因子调控土壤质地、水分及硝态氮等土壤参数而间接影响其在空间中的分布.
4.4 研究区内河岸带土壤反硝化酶活性的空间分异性主要受剖面尺度因子的直接影响,受断面尺度和流域尺度上因子的间接影响.用多尺度因子嵌套分析河岸带土壤反硝化酶活性的空间异质性,应该是识别反消化作用潜力空间分布特征的有效途径之一.
[1]O'Driscoll C, O'Connor M, Asam Z Z, et al. Creation and functioning of a buffer zone in a blanket peat forested catchment[J]. Ecological Engineering, 2014,62:83-92.
[2]Shen Z, Hou X, Li W, et al. Impact of landscape pattern at multiple spatial scales on water quality: A case study in a typical urbanised watershed in China [J]. Ecological Indicators, 2015,48:417-427.
[3]Bettez N D, Groffman P M. Denitrification potential in stormwater control structures and natural riparian zones in an urban landscape [J]. Environmental Science and Technology,2012,46(20):10909-10917.
[4]Wang S, Cao Z, Li X, et al. Spatial-seasonal variation of soil denitrification under three riparian vegetation types around the Dianchi Lake in Yunnan, China [J]. Environmental Science:Processes Impacts, 2013,15(5):963-971.
[5]Hale R, Reich P, Daniel T, et al. Scales that matter: guiding effective monitoring of soil properties in restored riparian zones[J]. Geoderma, 2014,228:173-181.
[6]Tatariw C, Chapman E L, Sponseller R A, et al. Denitrification in a large river: consideration of geomorphic controls on microbial activity and community structure [J]. Ecology, 2013,94(10):2249-2262.
[7]Hook P B, Burke I C. Biogeochemistry in a shortgrass landscape:control by topography, soil texture, and microclimate [J]. Ecology,2000,81(10):2686-2703.
[8]Sponseller R A, Fisher S G. The influence of drainage networks on patterns of soil respiration in a desert catchment [J]. Ecology,2008,89(4):1089-1100.
[9]Jenerette G D, Chatterjee A. Soil metabolic pulses: water,substrate, and biological regulation [J]. Ecology, 2012,93(5):959-966.
[10]Groffman P M, Butterbach-Bahl K, Fulweiler R W, et al. Challenges to incorporating spatially and temporally explicit phenomena (hotspots and hot moments) in denitrification models[J]. Biogeochemistry, 2009,93(1/2):49-77.
[11]Wu X, Liu G, Butterbach-Bahl K, et al. Effects of land cover and soil properties on denitrification potential in soils of two semi-arid grasslands in Inner Mongolia, China[J]. Journal of Arid Environments, 2013,92:98-101.
[12]Lowrance R, Hubbard R K, Williams R G. Effects of a managed three zone riparian buffer system on shallow groundwater quality in the southeastern coastal plain [J]. Journal of Soil and Water Conservation, 2000,55(2):212-220.
[13]Florinsky I V, McMahon S, Burton D L. Topographic control of soil microbial activity: a case study of denitrifiers [J]. Geoderma,2004,119(1):33-53.
[14]Ullah S, Faulkner S P. Denitrification potential of different land-use types in an agricultural watershed, lower Mississippi valley [J]. Ecological Engineering, 2006,28(2):131-140.
[15]Hayakawa A, Nakata M, Jiang R, et al. Spatial variation of denitrification potential of grassland, windbreak forest, and riparian forest soils in an agricultural catchment in eastern Hokkaido, Japan [J]. Ecological Engineering, 2012,47:92-100.
[16]张贻科.流溪河从化段水质变化规律研究 [J]. 生态环境学报,2012,21(11):1902-1904.
[17]甘明超.广州市流溪河河岸带土地利用格局及其分异研究 [D].广州:中山大学, 2006.
[18]吉冬青,文 雅,魏建兵,等.流溪河流域土地利用景观生态安全动态分析 [J]. 热带地理, 2013,33(3):299-306.
[19]Hayakawa A, Nakata M, Jiang R, et al. Spatial variation of denitrification potential of grassland, windbreak forest, and riparian forest soils in an agricultural catchment in eastern Hokkaido, Japan [J]. Ecological Engineering, 2012,47:92-100.
[20]鲍士旦.土壤农化分析:第三版 [M]. 北京:中国农业出版社,2000.
[21]邱 扬,傅伯杰,王 军,等.黄土丘陵小流域土壤侵蚀的时空变异及其影响因子 [J]. 生态学报, 2004,24(9):1871-1877.
[22]Luo J, Tillman R W, Ball P R. Nitrogen loss through denitrification in a soil under pasture in New Zealand [J]. Soil Biology and Biochemistry, 2000,32(4):497-509.
[23]Parkin T B, Meisinger J J. Denitrification below the crop rooting zone as influenced by surface tillage [J]. Journal of environmental quality, 1989,18(1):12-16.
[24]Martin T L, Kaushik N K, Trevors J T, et al. Review:denitrification in temperate climate riparian zones [J]. Water, Air,and Soil Pollution, 1999,111(1-4):171-186.
[25]Ahn C, Peralta R M. Soil properties are useful to examine denitrification function development in created mitigation wetlands [J]. Ecological Engineering, 2012,49:130-136.
[26]Hill A R, Cardaci M. Denitrification and organic carbon availability in riparian wetland soils and subsurface sediments [J]. Soil Science Society of America Journal, 2004,68(1):320-325.
[27]Jahangir M M R, Khalil M I, Johnston P, et al. Denitrification potential in subsoils: a mechanism to reduce nitrate leaching to groundwater [J]. Agriculture, Ecosystems and Environment,2012,147:13-23.
[28]Groffman P M, Tiedje J M. Denitrification in north temperate forest soils: relationships between denitrification and environmental factors at the landscape scale [J]. Soil Biology and Biochemistry, 1989,21(5):621-626.
[29]牟晓杰,刘兴土,仝 川,等.人为干扰对闽江河口湿地土壤硝化-反硝化潜力的影响 [J]. 中国环境科学, 2013,33(8):1413-1419.
[30]Dodla S K, Wang J J, DeLaune R D, et al. Denitrification potential and its relation to organic carbon quality in three coastal wetland soils [J]. Science of the Total Environment, 2008,407(1):471-480.
[31]Groffman P M, Crawford M K. Denitrification potential in urban riparian zones [J]. Journal of Environmental Quality, 2003,32(3):1144-1149.
[32]Xu Y, Xu Z, Cai Z, et al. Review of denitrification in tropical and subtropical soils of terrestrial ecosystems [J]. Journal of Soils and Sediments, 2013,13(4):699-710.
Effects of multi-scale control factors on spatial heterogeneity of denitrification in riparian soil: a case study in Liu Xi River of Guangzhou city.
LIU Qing1,2,3, WEI Jian-bing4*, WU Zhi-feng5, ZHONG Shi-jin5, HE Yuan-qing2, JI Dong-qing2(1.Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, Guangzhou 510640, China;2.Guangdong Institute of Eco-environment and Soil Sciences, Guangzhou 510650, China;3.University of Chinese Academy of Science, Beijing 100049, China;4.Key Laboratory of Regional Environment and Eco-Remediation, (Ministry of Education), Shenyang University, Shenyang 110044, China;5.School of Geographical Sciences, Guangzhou University,Guangzhou 510006, China). China Environmental Science, 2015,35(10):3069~3077
Soil denitrification enzyme activity was measured by a hierarchical sampling approach within the riparian zone of the Liu Xi River tributary of Guangzhou city, and explored and identified multi-scale factors that influenced soil denitrification. The results showed that soil denitrification potential—represented by soil denitrification enzyme activity(DEA)—showed more heterogeneity on a profile-scale than on a cross-sectional scale and landscape-scale in riparian zones; multi-scale factors controlled the degree of spatial variation in soil denitrification. The profile-scale factors,including soil TOC (total organic carbon), TN (total nitrogen) and(nitrate nitrogen), were the major direct regulators of the spatial distribution of DEA. The cross-sectional scale factors, including landscape position and vegetation density, and the landscape-scale factors, including TI, elevation and land-use types, indirectly regulated the distribution of DEA. At the profile scale, the highest DEA occurred on the upper soil, but dramatically declined from the soil surface to the deeper layers. At the cross-sectional scale, the highest DEA was observed at the landscape position,with good landscape connectivity and high-density vegetation within the middle part of the riparian zone. At the watershed scale, DEA showed an increasing trend from upstream to downstream except for the sites in urbanized areas.
denitrification;riparian soils;multi-scale;control factors
X522
A
1000-6923(2015)10-3069-09
刘 庆(1982-),女,山西长治人,中国科学院广州地球与化学研究所博士研究生,主要从事流域景观生态相关研究.
2015-03-17
国家自然科学基金项目(41171399);国家科技支撑计划项目(2012BAH32B03-5)
* 责任作者, 教授, oliver1208@sina.com
