厨余发酵液作为中试A/O-MBR外增碳源的脱氮特性
2015-11-19唐嘉陵王晓昌夏四清西安建筑科技大学环境与市政工程学院陕西西安70055同济大学环境科学与工程学院上海200092
唐嘉陵,王晓昌*,夏四清,2(.西安建筑科技大学环境与市政工程学院,陕西 西安 70055;2.同济大学环境科学与工程学院,上海 200092)
厨余发酵液作为中试A/O-MBR外增碳源的脱氮特性
唐嘉陵1,王晓昌1*,夏四清1,2(1.西安建筑科技大学环境与市政工程学院,陕西 西安 710055;2.同济大学环境科学与工程学院,上海 200092)
利用厨余发酵液作为A/O-MBR的外增碳源,考察在不同发酵液投加量和水力停留时间(HRT)条件下的脱氮性能以及膜污染特点.结果表明,发酵液的反硝化速率和COD利用率与乙酸钠接近,比葡萄糖高.通过A/O-MBR的运行发现,厨余发酵液作为碳源能够增强微生物活性,强化反硝化过程,从而提高脱氮效率.TN的去除效率随着发酵液投加量的增加而增大.发酵液投加前后,反应器内的EPS并没有积累,膜污染速率变化较小.化学清洗可以有效地去除膜污染物质,恢复膜通量.同时,延长HRT有助于提高脱氮效率和缓解膜污染.
厨余发酵液;中试A/O-MBR;碳源;膜污染
生物脱氮除磷工艺具有费用低,技术成熟等[1]优点而被广泛应用.然而由于硝化菌、反硝化菌和聚磷菌等对基质和空间存在竞争,硝化过程常常成为脱氮的限制因素,其处理效率并不稳定[2-4].MBR作为一种新型污水处理技术,其高效的泥水分离能力,有利于保持反应系统内较高的污泥浓度,从而使污染物去除效率更高,系统更加稳定[5-6].此外,污泥停留时间(SRT)不再受水力停留时间(HRT)的影响,有利于世代周期较长的微生物(硝化菌)在系统内富集[7].A/O-MBR是传统脱氮工艺和MBR工艺的组合,弥补了MBR难以实现脱氮的缺点,同时强化了A/O系统的脱氮能力.
作为反硝化过程的电子供体,有机物的含量直接影响着反硝化进行的速率和程度[8].根据电子平衡原理,还原1g需要消耗2.86g COD,但由于存在其他方面(如微生物增殖、降低溶解氧等)的消耗,所需要的COD量更高[9].为提高脱氮效率,向低C/N的污水中投加碳源是较为常用的方法.碳源的选择需要考虑以下几点因素:费用、污泥产量、反硝化速率、动力学、存储和使用的安全性、有害成分等[10-11].葡萄糖和甲醇等易降解有机物可以作为碳源强化生物脱氮除磷效果[12-14],但是其价格昂贵,且控制难度较大[15-16],难以在实际工程中广泛应用.一些研究者利用污泥酸化液作为碳源,从而实现污泥减量和资源回用[17].然而,污泥的含水率较高,水解液中有机物的生物可利用性能较差.此外,水解液中N、P含量较高,将其作为外增碳源存在额外增加N、P负荷的问题[18-19].因此寻求一种经济可行、安全可靠的高效碳源十分关键[20].
餐厨垃圾常被作为废物处理,然而其有机质含量较高,处理难度和费用都较高.研究表明,厨余发酵液中含有大量的VFA、乳酸等易降解有机物[21],可以作为碳源强化生物脱氮.现有报道主要基于厨余发酵液的制备研究,而很少将其用于反应器中.因此,本文以厨余发酵液作为外增碳源,用于改善中试A/O-MBR反硝化条件,考察其脱氮性能以及对膜污染的影响.
1 材料和方法
1.1 A/O-MBR
如图1所示为中试A/O-MBR反应器,其有效体积为8m3,其中V厌氧:V好氧:V膜池=1:1:1.膜组件为PVDF中空纤维膜(MOTIMO, 中国),膜面积为8m2,孔径为0.1μm.好氧池与膜池之间采用穿孔墙隔开,其中膜池采用穿孔管曝气冲刷膜表面,气水比为20:1,好氧池采用微孔曝气头曝气供氧.好氧池中溶解氧保持在1~2mg/L,混合液从好氧池回流至厌氧池中,回流比(R)为2.运行期间MLSS为4500~5000mg/L,MLVSS/MLSS为0.68~0.75.反应器采用恒通量出水,为控制膜污染,采用间歇抽吸出水方式,每抽吸8min,间歇2min,每1h自动反洗一次,跨膜压差通过在线监测压力表实时监测记录.厨余发酵液通过厨余投加泵与原污水在管道混合后进入厌氧池,水质如表1所示.通过改变进出水流量来调节反应器的水力停留时间(HRT).
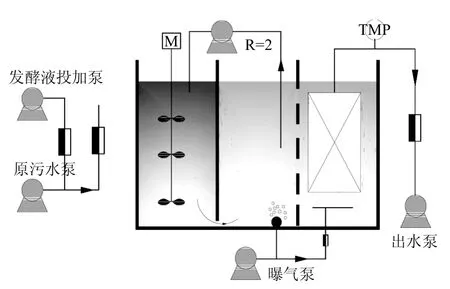
图1 中试A/O-MBR反应器Fig.1 Configuration of the pilot-scale A/O-MBR
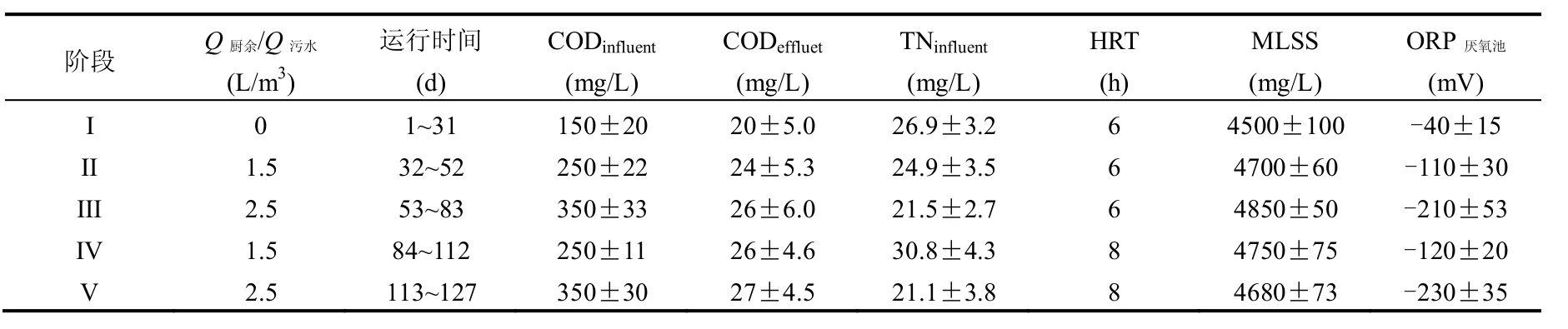
表1 反应器进出水水质和运行参数Table 1 Main influent and effluent characteristics and operation parameters of the A/O-MBR
1.2 厨余发酵液制备
餐厨垃圾取自于西安某校园食堂餐厅.收集的餐厨经过人工预处理 (检出骨头、废纸、肉等)后,加入热水并搅拌去除油脂,重复3次,油脂可基本去除.将处理后的厨余投入磨碎机内,打磨10min后经过筛网(筛孔为1mm)过滤,滤液加入自来水调节含水率至95%左右,后放入冰箱(4℃)保存(打磨液).厨余发酵罐有效容积为110L,以A/O-MBR厌氧池污泥(30L)为接种污泥,加入制备好的厨余液80L,于50℃(不调节pH值)下驯化污泥.经过1个月的驯化,发酵罐基本稳定.而后每日从发酵罐中取出30L厨余发酵液作为碳源投入A/O-MBR中,并向发酵罐投加30L预处理好的新鲜厨余打磨液.厨余打磨液和发酵液组分及性质如表2所示.
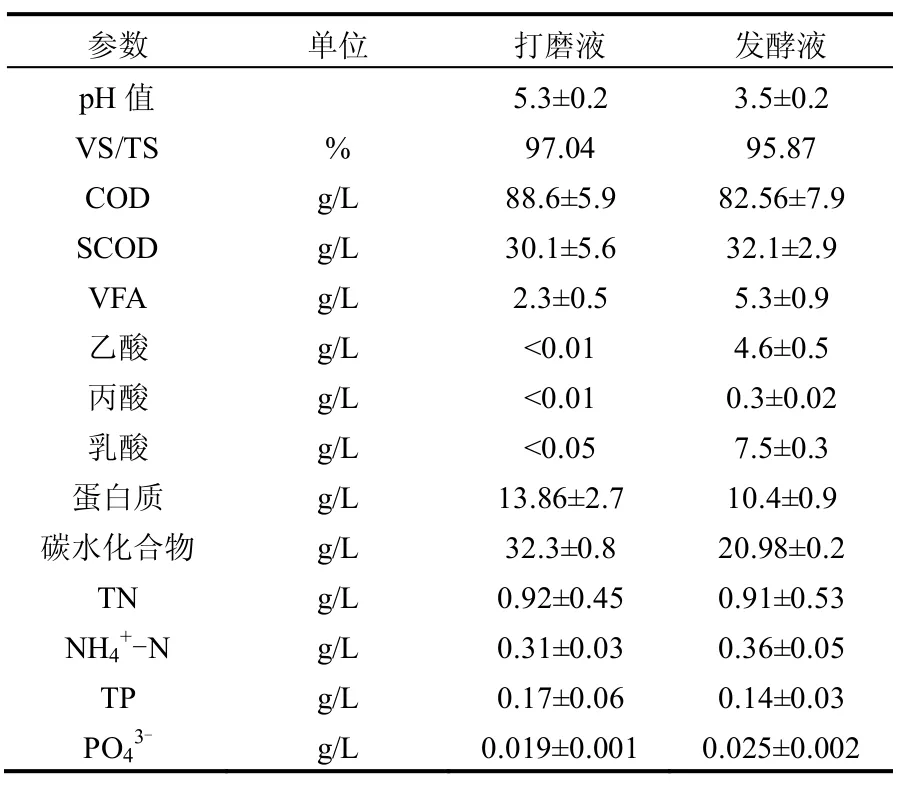
表2 厨余打磨液和发酵液的特性Table 2 Characteristics of pretreated food waste and FLFW
1.3 批式实验
为了探究厨余发酵液的特性,将其与葡萄糖、乙酸钠进行了反硝化速率比较.步骤如下:在反应器运行稳定的条件下,取厌氧池污泥,利用超纯水将污泥淘洗3次,去除其中的有机物、NOx-N,将污泥等分成3份于密封瓶中,并用超纯水定容至1.5L后通入N2去除溶液中的溶解氧(DO),加入NaNO3和碳源(葡萄糖、乙酸钠和厨余发酵液),使得和COD的最终浓度分别为(35± 5)mg/L和(300±20)mg/L,污泥浓度为3000mg/L左右.反应体系pH值保持在7.0~8.2之间.实验过程中,定时取样分析、和COD.比反硝化速率为:

1.4 COD利用效率
碳源作为反硝化电子供体的能力可以通过有机物用于脱氮的量与有机物的总消耗量的比值表征.根据电子平衡原理,在不考虑其他消耗的情况下,每去除1g需要消耗2.86gCOD.因此其利用效率可表示为:

1.5 EPS的测定
胞外聚合物(EPS)是主要的膜污染物质,其主要成分为溶解性EPS(SEPS)和结合型EPS(BEPS).提取步骤为:取25mL混合液于6000r/min离心后取上清液,用0.22μm过滤得SEPS.而后向离心管中加入缓冲溶液恢复至25mL,于60℃水浴30min后震荡2h,10000r/min离心20min,取上清液经0.22μm过滤得到BEPS.EPS主要含蛋白质和多糖,因此本研究利用蛋白质和多糖之和代替EPS[22].蛋白质的测定利用LOWRY法[23],多糖的测定采用蒽酮法.
1.6 膜表面观察
为观察膜丝污染程度,采用原子力显微镜观察膜丝表面膜孔的阻塞情况以及膜表面的污染物质.反应器运行至第71d时,化学清洗前,从反应器中提出膜组件截下膜丝(M1).化学清洗后,取出膜组件,截下膜丝(M2).将M1和M2于烘箱(50℃)烘干2d后,于原子力显微镜(Veeco,美国)下观察膜丝表面的形貌以及膜表面的污染物质.
1.7 污泥活性实验
MBR中污泥活性通过比好氧速率(SOUR)表征.操作步骤如下[24],取膜池混合液于密闭的容器中,曝气至溶解氧达到饱和后,停止曝气.加入标准体系溶液(葡萄糖,200mg/L,20mg/L, 20mg/L),利用溶解氧仪在线监测DO变化,测得污泥的总比好氧速率SOURT;当DO降低3mg/L时,投加NaClO3(最终浓度为2.13g/L),抑制亚硝氮氧化菌菌活性,测得氨氧化菌群与异养菌群的比好氧速率SOUR1;当溶解氧再降低2mg/L时投加ATU(最终浓度为5mg/L),抑制氨氧化菌活性,测得异养菌群比好氧速率SOURh.从而分别计算出,亚硝氮氧化菌比好氧速率SOURn=SOURT-SOUR1,氨氧化菌比好氧速率SOURa=SOUR1-SOURh.由此表征反应器中异养菌群、亚硝化菌群和硝化菌群的活性.
1.8 分析方法
好氧池的溶解氧(DO)和厌氧池的氧化还原电位(ORP)分别采用DO、ORP在线检测(SCAN,奥地利).pH值采用pH 计(pHSJ-4A, China)测定.COD、MLSS、总氮(TN)、、、、及总磷(TP)测定参考APHA[25].
2 结果与讨论
2.1 厨余发酵液的反硝化速率

图2 葡萄糖(glucose)、乙酸钠(SA)和厨余(FLFW)3种碳源的反硝化速率(a)和COD利用率比较(b)Fig.2 Comparison of specific denitrification rate (SDNR)(a) and COD utilization efficiency for denitrification (b)with glucose, sodium acetate and FLFW as external carbon
通过与葡萄糖、乙酸钠进行对比可以发现(图2a),厨余发酵液的比反硝化速率(SDNR)和乙酸钠的比反硝化速率(SDNR)接近,为10.53mg/(g-VSS·h),比葡萄糖(7.89mg/(g-VSS·h))高.比反硝化速率能够表征有机物质的生物可利用性能[26].其值越大表明该类物质越容易被微生物利用.由此说明,厨余发酵液的生物可利用性较高.这主要是因为厨余发酵液中含有大量VFA、乳酸等,这些物质基本都是小分子有机物,容易被微生物利用.此外,厨余发酵液中有机物组分较多,有利于微生物协同作用,强化反硝化能力[26].而乙酸钠通常被认为是快速降解的碳源,因此厨余发酵液也可以被归为快速降解的碳源.
此外,可以看出3种有机物作为碳源时(图2b),葡萄糖的利用效率最低,仅为(13.7±5.0)%,而乙酸钠和厨余发酵液比较接近,分别为(18.9± 5.3)%和(18.0±4.8)%.由此说明,厨余发酵液的脱氮能力较葡萄糖高,可以作为优质的碳源.
2.2 厨余发酵液在中试MBR中应用
在HRT为6h的条件下,厨余发酵液投加后,厌氧池中ORP由-40mV降至-110mV,同时由12.8mg/L逐渐降至6.3mg/L左右,说明厨余发酵液投加后改变了厌氧池的氧化还原条件,强化了反硝化过程.厌氧池中的降低保证了好氧池和出水中较低的含量,从而实现强化脱氮.厨余发酵液投加为反硝化菌群提供了更多的电子受体,有利于能量产生和物质传递,从而提高脱氮效率.同时加大厨余投加量,将进水COD从250mg/L提高至350mg/L时,厌氧池中的ORP下降至-210mV,反硝化过程被进一步强化由5mg/L降至1.5mg/L左右,同时出水中也由13.5mg/L降至8.5mg/L.由此说明厨余发酵液的投加能明显改善反应器厌氧区的环境,从而提高脱氮性能.
此外,HRT对反硝化过程影响也较为明显.当HRT由6h增加至8h时,在COD为250mg/L的条件下,ORP逐渐升高至-120mV,而含量也有所增加,这可能主要是因为进水中含量增加,使得回流液中含量升高.同时单位时间内进入反应器的有机物量减少未能及时消耗回流液中的溶解氧,同时不能为反硝化提供足够的电子受体.而当进水COD增加至350mg/L后,ORP又下降至-230mV,反硝化作用明显强化,厌氧池中降低至1mg/L以下.这可能主要是因为延长了混合液在厌氧池中的停留时间,同时较高的COD进水能够保证反硝化足够的碳源.
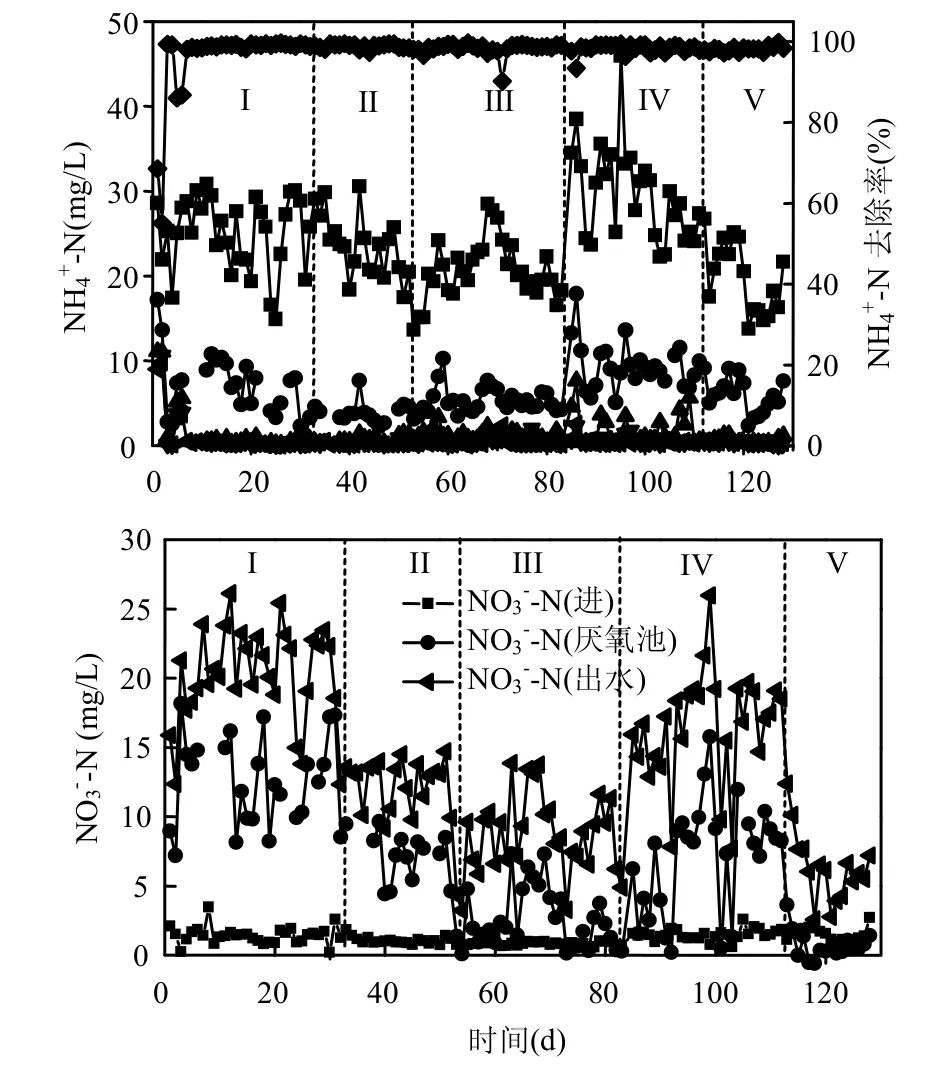
图3 运行期间反应器内NH4+-N(a)和NO3--N(b)变化情况Fig.3 Variations of NH4+-N (a) and NO3--N (b) in reactor during the operation period
2.2.2 对TN的去除 厨余发酵液投加后,反硝化过程得到强化,出水中TN的含量也逐渐降低.在未投加发酵液时,TN的去除效率仅为20%左右.碳源不足严重抑制了反硝化过程(图4),导致出水中TN含量达到20mg/L以上.发酵液投加后,出水中TN含量逐渐降低,去除效率也逐渐上升.TN的去除效率随进水COD升高而升高.在COD为250mg/L时,TN去除效率为50%左右,当COD提高至350mg/L时,去除效率提高至60%.
图4 运行期间进出水TN及去除效率的变化Fig.4 Variations of TN concentration and removal efficiency during the operation period
图5 运行期间A/O-MBR膜池中污泥SOUR变化Fig.5 Variations of SOUR of the activated sludge in membrane tank
2.2.3 微生物活性变化 活性污泥的比好氧速率可以间接反映污泥中不同微生物的活性和数量[27].由图5可以看出,厨余发酵液投加后,微生物的比好氧速率有所增加.第I期间3种微生物的比好氧速率较低,这是因为进水有机物含量较低,微生物的代谢活动受到抑制,活性较低.在运行初期,AOB和NOB在反应器内没能够大量富集,从而导致其好氧速率也较低.后几个运行期间的SOURh较高,这可能主要是因为厨余投加后,微生物具有足够的碳源,代谢活动加强.SOURa和SOURn则随着运行逐渐增加,这可能是因为反应器内AOB和NOB逐渐富集,数量逐渐增加所致.由此进一步说明厨余发酵液的投加能够强化微生物活性,同时不会对硝化过程产生影响.较强的微生物活性使反应系统更加稳定,去污能力更强.
2.3 膜污染
2.3.1 TMP变化 由图6可以看出,整个运行期间TMP逐渐增大,以此同时膜阻力(R)也在逐渐增加,渗透性(k)则在逐渐减小.这表明在运行过程中,膜组件受到污染.经分析,厨余发酵液投加前后,膜污染速率并没有较大变化(表3).HRT为6h的条件下,发酵液投加前,跨膜压差由10.4kPa增加至16.9kPa,膜污染速率(FR=dTMP/dt)为158Pa/d.而投加厨余后,跨膜压差增加至25.2kPa,此时膜污染速率为186Pa/d,当COD提高至350mg/L时膜污染速率为182Pa/d,这可能是因为厨余发酵液的投加并没有引入大量的膜污染物质,或者并没有改变微生物促使膜污染物质大量产生.
而当水力停留时间(HRT)延长至8h后,膜污染速率减小.这可能主要是因为延长水力停留时间,使得单位时间内过滤水量减少,污染物质在膜表面积累的速度减慢,从而使得膜污染速率降低.与未投加厨余发酵液条件下相比,HRT=8时的膜污染速率更低,由此说明厨余发酵液并不会造成膜污染,而HRT则是导致膜污染的关键因素.此外,经过2次化学清洗后,膜阻力下降较多,其恢复率达到93.3%,表明化学清洗能够有效控制膜污染.

图6 运行期间跨膜压差(TMP)、膜阻力(R)及渗透性(k)的变化Fig.6 Variations of TMP, membrane resistance (R) and permeability (k)

表3 厨余发酵液投加前后膜污染指标对比Table 3 Comparison of membrane fouling before and after FLFW application
2.3.2 EPS变化 由图7可以看出,在整个运行期间,EPS的含量并没有较大变化,由此说明在运行过程中,膜污染物质(蛋白质、多糖)并没有在反应器中大量积累,这可能是膜污染速率较慢的原因之一.另外,厌氧池中的EPS明显高于膜池,这可能是进水中含有蛋白质和多糖所致.蛋白质和多糖被微生物降解,使其在膜池中含量降低.
随着HRT延长,EPS的含量也逐渐降低.这可能基于2点原因.一是通过进水引入的蛋白质和多糖量减少;二是因为微生物在较长的HRT条件下能够有效降解蛋白质和多糖.这也可能是HRT为8h条件下的膜污染速率较6h条件下小的原因.
2.3.3 AFM 由图8所示,新膜的膜孔清晰可见,均匀分布在膜表面.经过70多天的运行,膜表面沉积了大量的污泥,膜孔被覆盖,这可能就是跨膜压差增加的主要原因.在运行过程中,污染物质进入膜孔,形成膜孔堵塞,或者沉积在膜丝表面形成泥饼层,这些污染都将导致膜污染并使跨膜压差增加[28].但经过化学清洗后,膜孔逐渐显现.膜表面的污染物质在化学清洗过程中,通过化学反应被去除,使污染的膜丝再生.这就是化学清洗后跨膜压差显著降低的原因之一.由此说明,运行过程中形成的膜污染,可以通过化学清洗有效降低.然而,化学清洗不可能全部去除膜表面的污染物质.膜表面还残留了部分污染物质,这就是膜阻不能完全恢复的原因.

图7 运行期反应器中EPS的变化Fig.7 Variations of EPS in reactors

3 结论
3.1 厨余发酵液的比反硝化速率(SNDR)与乙酸钠接近,且高于葡萄糖,可以将其认为是快速降解有机物.此外,厨余发酵液具有较高的脱氮能力,能够作为优质碳源利用.
3.2 在中试A/O-MBR中,利用厨余发酵液作为外增碳源能够强化微生物活性,且不会对硝化过程产生影响去除率均保持在99%以上.此外,厨余发酵液能够大大强化反硝化过程,有效提高脱氮效率.TN的去除效率随着发酵液投加量的增加而增加.相同的发酵液投加条件下,较长的HRT更有利于反硝化过程.

图8 膜丝表面原子力显微镜图Fig.8 Three-dimensional AFM images of membrane surface
3.3 厨余发酵液投加后,反应器中EPS没有大量积累,膜污染速率并没有显著增加.膜污染可以通过化学清洗有效控制.此外,延长HRT有助于缓解膜污染.
[1]Luostarinen S, Luste S, Valentín L, et al. Nitrogen removal from on-site treated anaerobic effluents using intermittently aerated moving bed biofilm reactors at low temperature [J]. WaterResearch, 2006,40(8):1607-1615.
[2]Baeza J A, Gabriel D, Lafuente J. Improving the nitrogen removal efficiency of an A2/O based WWTP by using an on-line Knowledge Based Expert System [J]. Water Research, 2002,36(8):2109-2123.
[3]Vaiopoulou E, Melidis P, Aivasidis A. An activated sludge treatment plant for integrated removal of carbon, nitrogen and phosphorus [J]. Desalination, 2007,211(1-3):192-199.
[4]Vaiopoulou E, Aivasidis A. A modified UCT method for biological nutrients removal: configuration and performance [J]. Chemosphere, 2008,72(7):1062-1068.
[5]Wu P, Ji X M, Song X K, et al. Nutrient removal performance and microbial community analysis of a combined ABR-MBR(CAMBR) process [J]. Chemical Engineering Journal, 2013,232:273-279.
[6]李 冬,何永平,张肖静,等.MBR系统CANON工艺的快速启动及微生物种群特征 [J]. 中国环境科学, 2014,34(11):2788-2795.
[7]de Silva D G V, Urbain V, Abeysinghe D H, et al. Advanced analysis of membrane bioreactor performance with aerobicanoxic cycling [J]. Water Science Technology, 1998,38(4/5):505-512.
[8]Fu Z M, Yang F L, Zhou F F, et al. Control of COD/N ratio for nutrient removal in a modified membrane bioreactor (MBR)treating high strength wastewater [J]. Bioresource Technology,2009,100(1):136-141.
[9]Carrera J, Vicent T, Lafuente J. Effect of influent COD/N ratio on biological nitrogen removal (BNR) from high-strength ammonium industrial wastewater [J]. Process Biochemistry, 2004,39(12):2035-2041.
[10]李梦露,蒋建国,张昊巍.餐厨垃圾水解酸化液作碳源的脱氮效果研究 [J]. 中国环境科学, 2014,34(4):917-923.
[11]杨飞飞,吴为中.以PHBV为碳源和生物膜载体的生物反硝化研究 [J]. 中国环境科学, 2014,34(7):1703-1708.
[12]Rittmann B E, McCarty P L. 2001. Environmental Biotechnology:Principles and Applications. McGraw-Hill, New York.
[13]Park S, Seon J, Byun I, Cho S, Park T, Lee T. Comparison of nitrogen removal and microbial distribution in wastewater treatment process under different electron donor conditions [J]. Bioresource Technology, 2010,101(9):2988-2995.
[14]Ahmed Z, Lim B R, Cho J, et al. Biological nitrogen and phosphorus removal and changes in microbial community structure in a membrane bioreactor: Effect of different carbon sources [J]. Water Research, 2008,42(1/2):198-210.
[15]Elefsiniotis P, Wareham D G. Utilization patterns of volatile fatty acids in the denitrification reaction [J]. Enzyme and Microbial Technology, 2007,41(1/2):92-97.
[16]Hiraishi A, Khan S T. Application of polyhydroxyalkanoates for denitrification in water and wastewater treatment [J]. Applied Microbiology and Biotechnology, 2003,61(2):103-109.
[17]Kim M, Gomec C Y, Ahn Y, et al. Hydrolysis and acidogenesis of particulate organic material in mesophilic and thermophilic anaerobic digestion [J]. Environmental Technology, 2003,24(9):1183-1190.
[18]Aravinthan V, Mino T, Takizawa S, et al. Sludge hydrolysate as a carbon source for denitrification [J]. Water Science Technology,2001,43(1):191-199.
[19]Cui R, Jahng D. Nitrogen control in A/O process with recirculation of solubilized excess sludge [J]. Water Research,2004,38(5):1159-1172.
[20]Fernández-Nava Y, Maranón E, Soons J, et al. Denitrification of high nitrate concentration wastewater using alternative carbon sources [J]. Journal of Hazardous Materials, 2010,173(1-3):682-688.
[21]Jiang J G, Zhang Y J, Li K M, et al. Volatile fatty acids production from food waste: Effects of pH, temperature, and organic loading rate [J]. Bioresource Technology, 2013,143(9):525-530.
[22]Liu H, Fang H. Extraction of extracellular polymeric substances(EPS) of sludges [J]. Journal of Biotechnology, 2002,95(3):249-256.
[23]Lowry O H, Rnsebrough N J, Farr A L, et al. Protein measurement with the folin phenol reagent [J]. Journal of Biology and Chemistry, 1951,193(1):265-275.
[24]Surmaca-Gorska J, Gernaey K, Demuynck C, et al. Nitrification monitoring in activated sludge by oxygen uptake rate (OUR)measurement [J]. Water Research, 1996,30(5):1228-1236.
[25]APHA, 2003. Standard Methods for the Examination of Water and Wastewater, 21st Edition [S]. American Public Health Association, American Water Works Association, Water Pollution and Control Federation, Washington, DC.
[26]Sage M, Daufin G, Gésan-Guiziou G. Denitrification potential and rates of complex carbon source from dairy effluents in activated sludge system [J]. Water Research, 2006,40(14):2747-2755.
[27]Garcia-Ochoa F, Gomez E, Santos V E, et al. Oxygen uptake rate in microbial processes: An overview [J]. Biochemical Engineering Journal, 2010,49(3):289-307.
[28]Meng F G, Chae S R, Drews A, et al. Recent advances in membrane bioreactors (MBRs): Membrane fouling and membrane material [J]. Water Research, 2009,43(6):1489-1512.
Characteristics of nitrogen removal in a pilot-scale A/O-MBR with Fermentation Liquid of Food Waste (FLFW) as external carbon sources.
TANG Jia-ling1, WANG Xiao-chang1*, XIA Si-qing1,2(1.School of Environmental and Municipal Engineering, Xi'an University of Architecture and Technology, Xi'an 710055, China;2.School of Environmental Science and Engineering, Tongji University, Shanghai 200092, China). China Environmental Science,2015,35(10):3018~3025
Fermentation liquid of food waste (FLFW) was applied as external carbon to a pilot-scale A/O-MBR to explore the characteristics of nitrogen removal and membrane fouling under different dosage and HRT. Results demonstrated that FLFW and sodium acetate characterized similar specific denitrification rate (SDNR) and COD utilization efficiency, but both of them are higher than that of glucose. It was also found that the FLFW can stimulate the activity of biomass and enhance denitrification processes significantly, which further improved nitrogen removal. The TN removal efficiencies increased with the addition of FLFW. In addition, after adding FLFW, the EPS did not accumulate in reactor and the membrane fouling rate (FR) increased slightly. Chemical clean can effectively remove membrane foulants and recover the permeability. Lengthening the HRT was more advantageous in nitrogen removal and membrane fouling control.
fermentation liquid of food (FLFW);pilot-scale A/O-MBR;carbon source;membrane fouling
X703
A
1000-6923(2015)10-3018-08
唐嘉陵(1988-),男,四川南充人,西安建筑科技大学博士研究生,主要从事废水深度处理及其资源化研究.发表论文10余篇.
2015-03-25
水体污染与治理科技重大专项(2013ZX07310);陕西省污水处理与资源化重点科技创新团队(2013KCT-13);陕西省“百人计划”
* 责任作者, 教授, xcwang@xauat.edu.cn
