污水厂二级出水溶解性有机物臭氧化特性研究
2015-11-19金鹏康章佳昕王晓昌西安建筑科技大学环境与市政工程学院陕西西安710055
金 鑫,金鹏康,孔 茜,章佳昕,王晓昌 (西安建筑科技大学环境与市政工程学院,陕西 西安 710055)
污水厂二级出水溶解性有机物臭氧化特性研究
金 鑫,金鹏康*,孔 茜,章佳昕,王晓昌 (西安建筑科技大学环境与市政工程学院,陕西 西安 710055)
采用液相色谱荧光检测器将三维荧光图谱与凝胶色谱分子量分布相结合,对污水处理厂二级出水溶解性有机物(EfOM)的臭氧化反应特性进行了研究.结果表明臭氧会使得二级出水溶解性有机物三维荧光强度明显降低.HPLC-SEC的结果表明臭氧不会改变腐殖质类物质的分子量分布,但臭氧会与小分子蛋白类物质发生反应.根据制备液相的分析结果,小分子蛋白类物质中含有大量苯环及其他共轭结果物质,因此臭氧会优先与小分子蛋白类物质发生反应.同时,XPS分析结果表明臭氧在低投加量下就会与苯环结构反应,提高脂肪类饱和有机物含量,随着投加量进一步升高,含氧官能团(羰基,羧基)数量有所升高.
臭氧氧化;二级出水有机物;分子量分布;光电子能谱
污水二级出水溶解性有机物(EfOM)主要有溶解性微生物代谢产物[1],上游饮用水水源中的天然有机物[2]及微量污染物[3].如果需要对二级出水进行深度处理,这类有机物通常难以生物降解.氧化工艺通常用来改变有机物特性,提高有机物可生化性,同时降低污水回用的风险[4].在氧化工艺中,由于臭氧的强氧化性及副产物较少,臭氧氧化经常应用于二级出水深度处理,改善后续处理工艺的处理效果[5].
目前,对于溶解性有机物臭氧化特性的研究主要集中在对常规指标与微量有机物的去除效果[5],消毒效果[6]及对后续联用工艺的改善情况[7-8].而涉及到溶解性有机物与臭氧作用机理的研究并不多,且主要集中在对水体中天然有机物[9-11]或特定有机物[12]与臭氧的反应特性上,对于二级出水溶解性有机物的臭氧化机理及特性研究较少.三维荧光及凝胶色谱技术通常用于溶解性有机物结构及反应特性中,但是这2种方法的使用相对独立,没有很好地结合起来.凝胶色谱与荧光检测器联用可以有效地将三维荧光图谱(EEM)与凝胶色谱分子量分布(HPLC-SEC)相结合[13-14],为溶解性有机物臭氧化特性研究提供了新的方法和思路.本文通过液相色谱荧光检测器将EEM图谱与HPLC-SEC结合,研究了西安市某污水处理厂二级出水溶解性有机物的臭氧化特性.同时,采用光电子能谱(XPS)对二级出水溶解性有机物臭氧化前后的官能团变化进行了分析,探究其臭氧化的反应机理,为臭氧氧化工艺在污水深度处理中的应用提供理论支撑.
1 材料与方法
1.1 污水处理厂二级出水及其臭氧化
水样取自西安市某A2O工艺污水处理厂二沉池出水,该污水处理厂进水主要来自城市生活污水,出水水质特征如表1所示.采用图1所示装置进行二级出水的臭氧化,该装置主体反应器有效体积为1.5L,臭氧发生器(南京沃环,WH-S-B2)出口流量通过气体流量计调节控制在40L/h,未反应的气体通入20%KI进行吸收.整个反应装置通过水浴调节使得反应温度在15℃,反应结束时,利用氮气将未反应的臭氧进行吹脱,该臭氧系统通过调节不同的反应时间来实现臭氧投加量的调节.

图1 臭氧化反应系统Fig.1 The setup of ozonation system
1.2 分析方法
1.2.1 水样预处理 污水处理厂沉淀池出水在进行进一步分析前均需进行0.45μm滤膜过滤处理,样品的后续分析均使用3~5个平行样.
1.2.2 臭氧投加量的确定 臭氧投加量为系统输入和未反应臭氧差值与水样TOC的比值,单位为mgO3/mgTOC,通过对反应时间的调节,进入反应器和未反应的臭氧含量通过碘量法进行测定,本研究确定了3个不同的臭氧投加量,即0.45,0.98,2.15mgO3/mgTOC.
1.2.3 有机物浓度测定 将水样酸化至pH<3,并用氮气吹脱3min,随后水样采用岛津公司生产的TOC-V CPH型总有机碳分析仪测定TOC含量.
1.2.4 UV254及SUVA测定 采用北京谱析通用仪器有限责任公司生产的TU-1901双光束紫外可见分光光度计测定UV254及SUVA(单位浓度TOC的紫外吸光度值).
1.2.5 色度的测定 色度的测定采用分光光度铂钴比色法[15].
1.2.6 三维荧光光谱 采用日本JASCO公司生产的FP6500型荧光分光光度计,对臭氧化前后样品进行分析.激发波长范围为220~480nm,发射波长范围为280~550nm.激发和发射扫描间隔分别为5nm和2nm,扫描速度为2000nm/min.
1.2.7 HPLC-SEC分子量分布及制备液相分析HPLC-SEC分析由岛津公司生产的LC-2010AHF型高效液相色谱测定,采用荧光检测器,检测波长分别设置为Ex/Em355/430nm, Ex/Em230/340nm,色谱柱为Zenix SEC-100凝胶色谱柱,流动相为150mmol/L PBS缓冲溶液,流速0.8mL/min.制备液相分析采用FRC-10A馏分收集器, LC-20AP液相泵及Zenix SEC-300凝胶色谱柱,流动相为150mmol/L PBS,流速5mL/min,检测器同样采用荧光检测器,波长设置为Ex/Em355/430nm,Ex/Em230/340nm.聚乙二醇(PEG)和牛血清蛋白(BSA)分别用于测定腐殖质类物质及蛋白类物质的标线.
1.2.8 光电子能谱(XPS)分析 利用光电子能谱(英国热电,K-Alpha)探明二级出水有机物臭氧化前后的碳元素的价键形式.分析前二级出水臭氧化前后的水样需在50℃下烘干成粉末状,高分辨扫描采用扫描间隔为0.1eV.
2 结果与讨论
2.1 臭氧化前后二级出水水质特性
由表1可以看出,臭氧化后UV254和UV280均有了明显去除,且随着臭氧投加量的增加UV254和UV280的值逐渐降低. 同时,臭氧化后二级出水的色度也随着投加量的增加而逐渐降低,当投加量为0.98mgO3/mgTOC时,色度的去除率已经达到75%左右,体现了臭氧良好的脱色性能.而氧化前后TOC变化不大,说明臭氧对有机物直接氧化的矿化能力较弱.SUVA是水样UV254与TOC的比值,是表示水中有机物的共轭不饱和及芳香程度的指标.表1的结果表明,臭氧化后SUVA随投加量的升高逐渐降低,经过臭氧化后有机物的不饱性和及芳香程度得以降低,臭氧起到了改变有机物结构的作用,而二级出水中的生色物质正是一些不饱和且具有较高芳香程度的有机物,因此SUVA的降低就可以表明臭氧化后水中色度的降低.

表1 二级出水臭氧化前后水质特性Table 1 The water quality variation before and after ozonation
2.2 臭氧化前后三维荧光EEM谱图
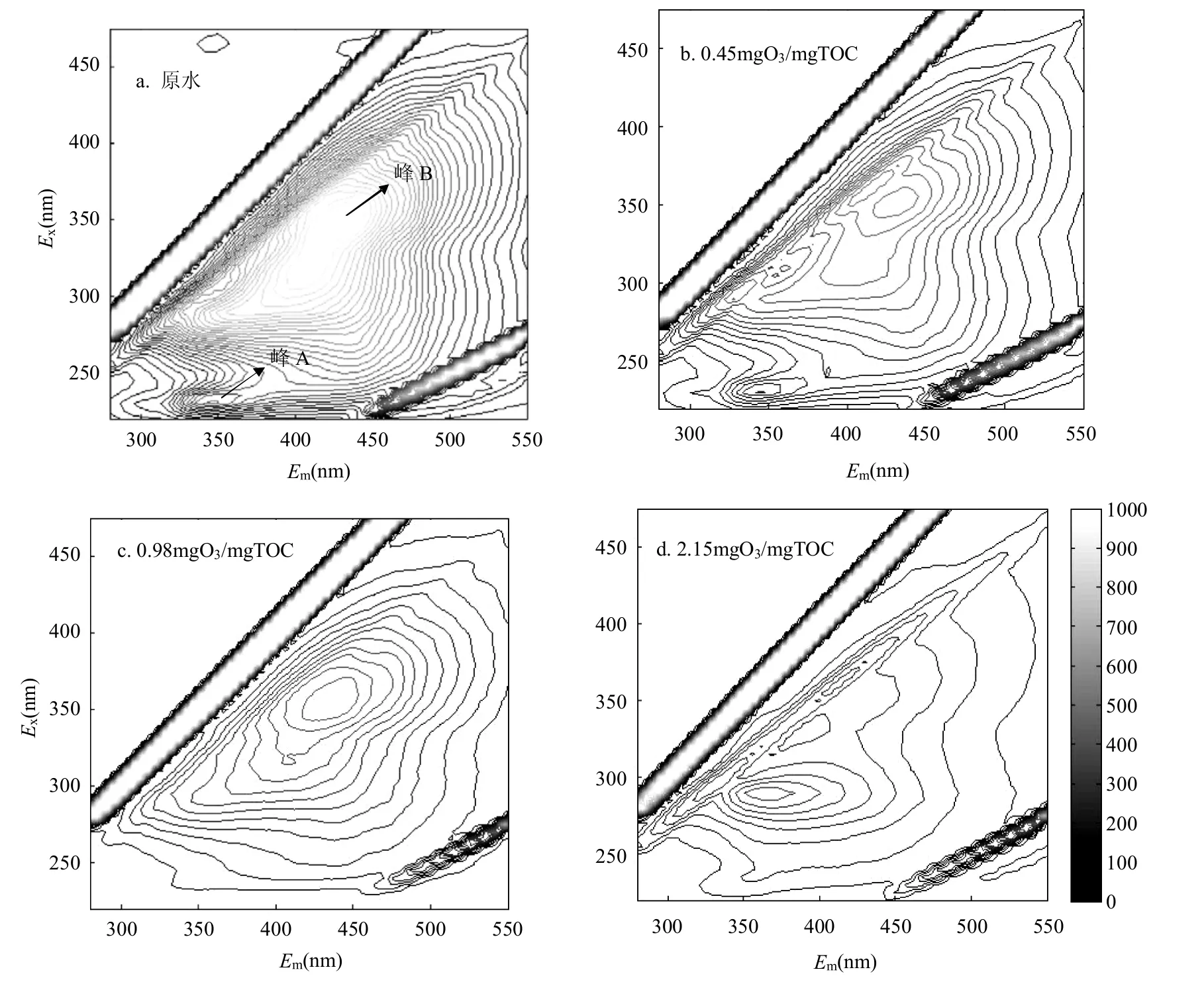
图2 二级出水臭氧化前后EEM图谱Fig.2 The EEM spectra of raw water before and after ozonation in three different ozone dosages
由图2可以看出,原水中主要存在2个峰,分别为Ex/Em225/340nm(峰A)和Ex/Em350/440nm(峰B).研究表明荧光峰在Ex/Em300~380/400~450nm范围内认为是腐殖质类物质,而在Ex/Em220~250/320~370nm范围内的荧光峰为蛋白类物质[16-20].经过臭氧化后,这2种荧光峰的峰强明显减弱.在臭氧投加量为0.45mgO3/mgTOC时,臭氧就与二级出水中有机物的荧光基团发生了反应,破坏了荧光基团的结构.当投加量升至0.98mgO3/mgTOC时,峰A消失,可以推测在此投加量下蛋白类荧光物质与臭氧发生了较为彻底的反应.当投加量为2.15mgO3/mgTOC时,峰B的位置发生了较为明显的蓝移,这是因为在臭氧投加量较大时,二级出水中有机物中苯环及共轭键的数量减少,导致峰A产生了一定程度的蓝移[16].
2.3 HPLC-SEC及制备液相分析
采用荧光检测器,根据图2所示EEM图谱,选择检测激发和发射波长分别为Ex/Em355/430nm及Ex/Em230/340nm来表示腐殖质类及蛋白类物质.由图3可以看出,腐殖质类物质的分子量分布较为集中,主要分布在分子量在500~1000Da,随着臭氧的投加量的升高,分子量分布并没有发生明显变化,只是强度逐渐降低,但是对于蛋白类物质而言,其分子量分布较为广泛,在18~3000kDa均有分布,当臭氧投加量提升至0.98,2.15mgO3/mgTOC时,小分子蛋白类物质在荧光检测器的响应明显降低,几乎没有分布,而大分子蛋白类物质的响应值变化较小.由此可知,臭氧会在较大投加量时会优先与蛋白类小分子物质发生反应,使其荧光强度降低.这与图2所示EEM图谱0.98mgO3/mgTOC时蛋白类荧光峰的消失相一致.
为了解释臭氧与蛋白类物质反应的这一现象,将二级出水原水进行凝胶色谱制备液相制备.根据图4所示,将制备区域选择在A,B,C3个区域,分别代表蛋白质类物质1000~3000kDa,150~900kDa,18~80kDa3个分子量分布区域,测定这3个分子量分布区域制备液的SUVA.分子量在18~80kDa范围的制备液其SUVA值最大(约为1.25L/(mg.m)),而分子量在1000~3000kDa的制备液其SUVA值最小(约为0.66L/(mg.m)).SUVA值越大,说明水中苯环及其他共轭结构的数量越多[21],而臭氧在与有机物的反应过程中会优先与苯环及其他一些共轭结构结合发生反应[22].根据不同分子量制备液SUVA结果,臭氧会优先与18~80kDa的小分子蛋白类物质发生反应,从而解释了图3所示的结果.
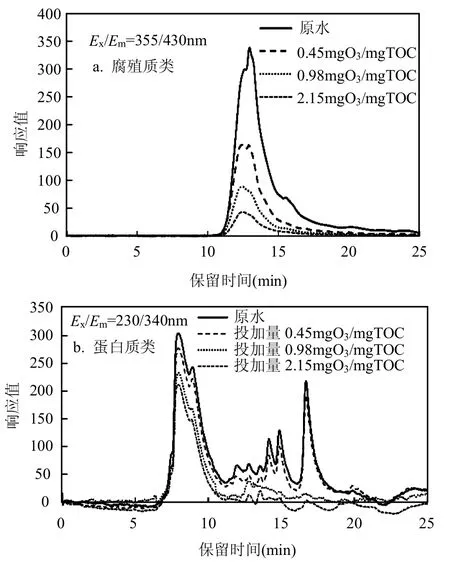
图3 腐殖质及蛋白类物质的HPLC-SEC图谱Fig.3 HPLC-SEC analysis results of humic-like and protein-like substances
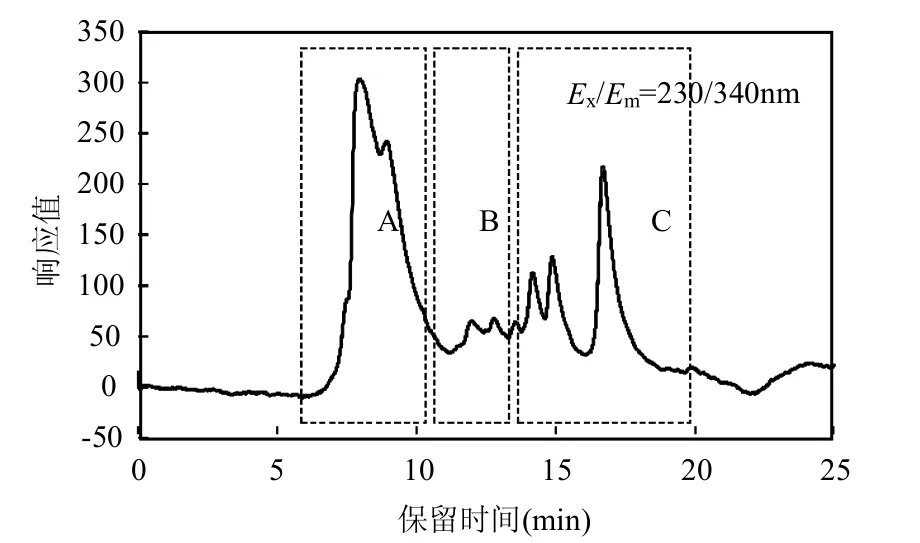
图4 制备液相制备区域分布Fig.4 Preparation region distribution for preparative HPLC
2.4 XPS分析
为了进一步明确臭氧对二级出水溶解性有机物官能团性状的改变,利用光电子能谱(XPS)得到了臭氧化前后碳元素C1s高分辨谱图(图5).随后,采用XPSpeak软件对原始C1s图谱进行高斯分峰拟合,结果如图5所示.由拟合结果中不同高斯峰的结合能可以看出,XPS图谱中显示了二级出水溶解性有机物臭氧化前后的4种官能团,分别为苯环碳、脂肪碳、羰基碳、羧基碳[23-24].根据高斯峰所占的比例,可以得到4种官能团的相对含量,结果如图6所示.二级出水原水中含有大量苯环结构,这也是二级出水UV254及SUVA值较大的原因.随着臭氧投加量的升高,水中苯环类物质逐渐减少,脂肪类饱和有机物含量逐渐升高.当臭氧投加量大于0.98mgO3/mgTOC时,含氧官能团的数量(羰基,羧基)有所升高.由图6还可以看出,苯环结构极易与臭氧结合,在低臭氧投加量(0.45mgO3/ mgTOC)时,苯环结构数量就有显著降低.

图5 臭氧化前后XPS C1s图谱Fig.5 C1s spectra of XPS before and after ozonation

图6 臭氧化前后碳元素价键形式Fig.6 Carbon species before and after ozonation
3 结论
3.1 臭氧会改变二级出水溶解性有机物荧光特性,使得三维荧光强度明显降低.当臭氧投加量增加至2.15mgO3/mgTOC时,由于共轭基团数量的降低,腐殖质类荧光峰位置发生了明显蓝移.
3.2 根据HPLC-SEC的结果,臭氧不会改变腐殖质类物质的分子量分布,但臭氧会改变蛋白类物质的分子量分布.由于小分子蛋白类物质的SUVA值较大,臭氧会优先与小分子蛋白类物质发生反应.
3.3 XPS分析结果表明,臭氧在低投加量下就会与苯环结构反应,降低共轭结构数量,提高脂肪类饱和有机物含量.随着投加量进一步升高,含氧官能团(羰基,羧基)数量有所升高.
[1]Barker D J, Stuckey D C. A review of soluble microbial products(SMP) in wastewater treatment systems [J]. Water Research, 1999, 33(14):3063-3082.
[2]Filloux E, Labanowski J, Croue J P. Understanding the fouling of UF/MF hollow fibres of biologically treated wastewaters using advanced EfOM characterization and statistical tools [J]. Bioresource Technology, 2012,118:460-468.
[3]Audenaert W T, Vandierendonck D, Van Hulle S W, et al. Comparison of ozone and HO. induced conversion of effluent organic matter (EfOM) using ozonation and UV/H2O2treatment[J]. Water Research, 2013,47(7):2387-2398.
[4]Jin P K, Jin X, Wang X C, et al. An analysis of the chemical safety of secondary effluent for reuse purposes and the requirement for advanced treatment [J]. Chemosphere, 2013,91(4):558-562.
[5]郑晓英,王俭龙,李鑫玮,等.臭氧氧化深度处理二级处理出水的研究 [J]. 中国环境科学, 2014,34(5):1159-1165.
[6]潘观连.臭氧投加量及进水水质对臭氧消毒特性的影响研究[D]. 上海:东华大学, 2014.
[7]Yan M Q, Wang D S, Shi B Y, et al. Effect of pre-ozonation on optimized coagulation of a typical North China source water [J]. Chemosphere, 2007,69:1695-1702.
[8]Jeong K, Lee D S, Kim D G, et al. Effects of ozonation and coagulation on effluent organic matter characteristics and ultrafiltration membrane fouling [J]. Journal of Environmental Sciences, 2014,26:1325-1331.
[9]Swietlik J, Sikorska E. Application of fluorescence spectroscopy in the studies of natural organic matter fractions reactivity with chlorine dioxide and ozone [J]. Water Research, 2004,38(17):3791-3799.
[10]Zhang T, Lu J, Ma J, et al. Comparative study of ozonation and synthetic goethite-catalyzed ozonation of individual NOM fractions isolated and fractionated from a filtered river water [J]. Water Research, 2008,42(6/7):1563-1570.
[11]刘 冰,古 励,余国忠,等.臭氧/活性炭协同作用去除二级出水中DON [J]. 中国环境科学, 2014,34(7):1740-1748.
[12]Xiao H, Liu R P, Zhao X, et al. Effect of manganese ion on the mineralization of 2,4-dichlorophenol by ozone [J]. Chemosphere, 2008,72:1006-1012.
[13]Nagao S, Matsunaga T, Suzuki Y, et al. Characteristics of humic substances in the Kuji River waters as determined by highperformance size exclusion chromatography with fluorescence detection [J]. Water Research, 2003,37(17):4159-4170.
[14]Bhatia D, Bourven I, Simon S, et al. Fluorescence detection to determine proteins and humic-like substances fingerprints of exopolymeric substances (EPS) from biological sludges performed by size exclusion chromatography (SEC) [J]. Bioresource Technology, 2013,131:159-165.
[15]曾凡亮,罗先桃.分光光度比色法测定水样色度 [J]. 工业水处理, 2006,26(9):69-77.
[16]Coble P G. Characterization of marine and terrestrial DOM in seawater using excitation-emission matrix spectroscopy [J]. Marine Chemistry, 1996,51(4):325-346.
[17]Leenheer J A. Systematic Approaches to Comprehensive Analyses of Natural Organic Matter [M]. Annals of Environmental Science, 2009,1-130.
[18]Chen J, LeBoeuf E J, Dai S, et al. Fluorescence spectroscopic studies of natural organic matter fractions [J]. Chemosphere, 2003, 50:639-647.
[19]Wang Z G, Cao J, Meng F G. Interactions between protein-like and humic-like components in dissolved organic matter revealed by fluorescence quenching [J]. Water Research, 2015,68(1):404-413.
[20]Chen W, Westerhoff P, Leenheer J A, et al. Fluorescence Excitation-Emission Matrix Regional Integration to Quantify Spectra for Dissolved Organic Matter [J]. Environmental Science and Technology, 2003,37:5701-5710.
[21]Gong J, Liu Y, Sun X. O3and UV/O3oxidation of organic constituents of biotreated municipal wastewater [J]. Water Research, 2008,42(4/5):1238-1244.
[22]Westerhoff P, Aiken G, Amy G, et al. Relationships between the structure of natural organic matter and its reactivity towards molecular ozone and hydroxyl radicals [J]. Water Research, 1999,33(10):2265-2276.
[23]Monteil R F, Brouwer E B, Masset S, et al. Combination of X-ray photoelectron and solid-state13C nuclear magnetic resonance spectroscopy in the structural characterisation of humic acids [J]. Analytica Chimica Acta, 2000,424(2):243-255.
[24]Lin J L, Huang C, Dempsey B, et al. (2014) Fate of hydrolyzed Al species in humic acid coagulation [J]. Water Research, 2014,56: 314-324.
Ozonation characteristics of dissolved effluent organic matter from the secondary effluent of WWTP.
JIN Xin, JIN Peng-kang*, KONG Qian, ZHANG Jia-xin, WANG Xiao-chang (Department of Environmental and Municipal Engineering, Xi'an University of Architecture and Technology, Xi'an 710055, China). China Environmental Science,2015,35(10):2985~2990
HPLC-SEC coupled with a fluorescence detector was combined with an EEM spectra to study the ozonation characteristics of EfOM. The findings showed that ozonation did not change the molecular weight distribution of the humic-like substances. Furthermore, the HPLC-SEC results indicated that the molecular weight distribution of the humic-like substances was not changed by ozonation. Nonetheless, ozone reacted with the low molecular weight protein-like substances. According to preparative HPLC analysis, the low molecular weight protein-like substances contained large amounts of aromatic or other conjugated structures, which were preferentially ozonated. In addition, XPS analysis revealed that the aromatic structure was oxidized at a low ozone dosage, and the amount of aliphatic organic matter increased correspondingly. With the increasing of ozone dosage, the amount of oxygen-containing functional groups (carbonyl and carboxyl group) increased.
ozonation;effluent organic matter;molecular weight distribution;X-ray photoelectron spectroscopy
X703
A
1000-6923(2015)10-2985-06
金 鑫(1987-),男,陕西兴平人,西安建筑科技大学博士研究生,主要从事水处理理论与技术研究.发表论文4篇.
2015-03-10
国家自然科学基金资助项目(51378414,51178376);国家科技支撑计划(2014BAC13B06);陕西省污水处理与资源化创新团队(IRT 2013KCT-13);教育部新世纪优秀人才支持计划(NCET-12-1043);陕西省教育厅科研计划项目(14JK1423)
* 责任作者, 教授, pkjin@xauat.edu.cn
