羊源长角血蜱吸血后中肠优势菌群分析
2015-11-19廖芷卉陈宏智程天印
廖芷卉,陈宏智,唐 昊,程天印
(1.湖南农业大学,长沙 410128;2.信阳农林学院,信阳 46400)
羊源长角血蜱吸血后中肠优势菌群分析
廖芷卉1,陈宏智2,唐 昊1,程天印1
(1.湖南农业大学,长沙 410128;2.信阳农林学院,信阳 46400)
本研究采用PCR-DGGE技术分析长角血蜱的中肠菌群结构。无菌条件下采集长角血蜱中肠内容物,以细菌基因组DNA提取试剂盒提取内容物细菌总DNA,以通用引物扩增制备16S rDNA V3区,DGGE电泳分离后,切胶回收、测定序列。结果表
PCR-DGGE;长角血蜱;肠道菌群
蜱是一类以吸血为生的体外寄生虫,可对宿主造成直接和间接的危害,大量寄生可导致宿主贫血、消瘦和感染疫病。越来越多的研究表明,蜱类的危害与其消化道菌群关系密切,一些病原微生物在蜱中肠内发育、繁殖[1],一些非致病微生物能合成蜱所需的营养物质[2],并影响病原微生物的生长与繁殖[3,4],故研究蜱中肠微生物菌群结构对防治蜱及蜱传病具有极大的潜在意义。
本研究采用PCR-DGGE技术分析长角血蜱中肠内容物的菌群结构。变形梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)创建于1983年,是一种专门分离长度相同或相近DNA片段的电泳技术。通过DGGE电泳,长度相同、组成不同的DNA片段停留在凝胶的不同位置,形成丰度不同的条带,切取条带即可克隆、测序。细菌16S rDNA具有种属保守性,而V3区扩增长度适于DGGE电泳,故已广泛应用于环境微生物、食品微生物等领域[5]。但是在蜱肠道微生物研究方面,DGGE电泳的报道鲜少。2003年,研究人员对澳大利亚篦子硬蜱肠道内细菌进行分析,发现了大量立克次氏体、巴尔通氏体及包柔氏螺旋体等蜱传病原菌[6]。2008年,van Overbeek等[7]运用DGGE技术在篦子硬蜱体内检测到米库尔新埃希体、澳洲立克次氏体、沃巴赫氏菌及许多包柔氏螺旋体。
1 材料与方法
1.1 材料
1.1.1 长角血蜱 2014年8月采自山东省泰安市放养山羊。饱血雌蜱、半饱血雌蜱、雄蜱各2只。采山羊血5 mL。
1.1.2 主要试剂与仪器 2×Easy Taq PCR SuperMix购自北京全式金生物技术有限公司;2×TransHifi SuperMixⅠ购自北京全式金生物技术有限公司;细菌基因组DNA提取试剂盒、DNA纯化回收试剂盒、高纯质粒小提试剂盒购自天根生化科技(北京)有限公司;EcoRⅠ和XhoⅠ双酶、pMD18-T载体、E.coli DH5α感受态细胞购自宝生物工程(大连)有限公司;DGGE变性梯度凝胶电泳仪系统购自北京君意东方电泳设备有限公司;PCR仪购自基因有限公司。
1.2 方法
1.2.1 细菌DNA提取 取饱血雌蜱、半饱血雌蜱、雄蜱各2只,用75%乙醇清洗表面,在超净工作台剪开蜱的后缘,用镊子挤出血液于1.5mL离心管;加入无菌生理盐水1 mL,轻轻摇匀,静置5 min,所得浑浊液200×g离心5min,取上清液12000×g离心5min。按照细菌基因组DNA提取试剂盒说明书操作,提取蜱中肠细菌基因组DNA。利用SDS-PK法提取山羊血液DNA,1.2%琼脂糖凝胶电泳检测片段。
1.2.3 细菌16S rDNA的PCR扩增与纯化 以341f (5'-CCTACGGGAGGCAGCAG-3')和907r 5'-CCCC GTCAATTCATTTGAGTTT-3')为引物,扩增细菌DNA。扩增体系:细菌DNA 2.0 µL、上下游引物(10 µmol/mL)各2.0 µL、2×EasyTaq PCR SuperMix 25.0µL、ddH2O 19.0µL。扩增条件:95℃预变性5 min;95℃变性30s,61.5℃退火30s,72℃延伸34s,33个循环;72℃延伸7 min。取产物5.0µL于1.5%琼脂糖凝胶电泳检测。
以341fGC(5'-CGCCCGCCGCGCGCGGCGGGC GGGGCGGGGGCACGGGGGGCCTACGGGA GGC AGCAG-3')和518r(5'-ATTACCGCGGCTGCTGG-3')为引物,扩增上述PCR产物。扩增体系:PCR产物1.0µL、上游引物(10µmol/mL)各2.0µL、2×TransHifi SuperMixⅠ25.0 µL、ddH2O 20.0 µL。扩增条件:95℃预变性5min;95℃变性30s,70℃退火30s,72℃延伸12s,20个循环,每个循环退火温度下降0.5℃;95℃变性30s,60℃退火30s,72℃延伸12s,14个循环;72℃终延伸7min。取产物5.0µL于1.5%琼脂糖凝胶电泳检测。
1.2.4 变性梯度凝胶电泳(DGGE) 以30%变性剂和60%变性剂制备30%~60%聚丙烯酰胺变性凝胶。将PCR纯化物加入预热的变性凝胶样品孔,每样7.0 µL,60℃、125V电泳4.0h。凝胶放入溴化乙锭染色液(纯净水400 mL、10 mg/mL溴化乙锭10.0µL)中染色20 min。
1.2.5 切胶回收与测序 切取DGGE凝胶中明显而清晰的条带,放入EP管中,以ddH2O冲洗3次,加入无菌生理盐水50µL,4℃过夜;12000×g离心5min,吸取上清液,供克隆以及测序用。
取上清液4µL与pMD18-T载体1µL、Solution I 5 µL混匀,16℃条件下连接1 h。取连接产物10µL,转化至DH5α感受态细胞。将感受态细胞涂布于含X-Gal、IPTG和氨苄青霉素的LB平板,37℃培养24h后,挑取白色菌落,扩大培养。高纯质粒小提试剂盒提取质粒。取质粒7µL、EcoRI和XhoI各1µL、10× Buffer H 2µL、ddH2O 9µL,37℃酶切1h。酶切鉴定为阳性质粒送生工生物工程股份有限公司测序,测定的序列通过BLAST进行比对分析。
2 结果与讨论
2.1 PCR检测结果 以341f和907r为引物,长角血蜱饱血雌成蜱、半饱血雌成蜱和雄成蜱肠道细菌基因组DNA为模板,扩增片段大小约650 bp,与预计大小一致。
以341fGC和518r为引物扩增PCR产物,得到长角血蜱的饱血雌成蜱、半饱血雌成蜱和雄成蜱肠道细菌16S rDNA V3区,片段大小约为220 bp,电泳结果见图1。
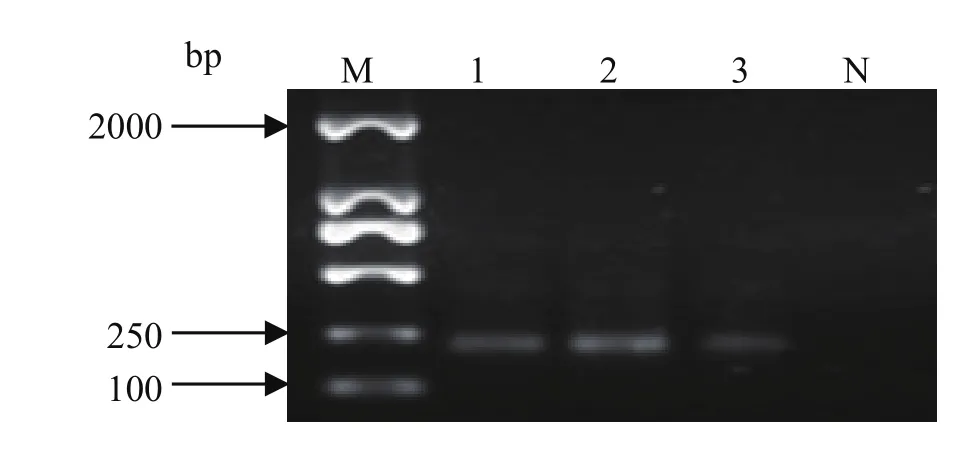
M: DNA 分子量标准(DL2000); 1:饱血雌蜱; 2:半饱血雌蜱;3: 雄蜱;N: 空白对照M: DNA Marker(DL2000); 1: Engorgement female ticks;2: Feding female ticks; 3: Feding male ticks; N: Negative control
2.2 DGGE检测结果 山羊血液、长角血蜱饱血雌成蜱、半饱血雌成蜱和雄成蜱肠道细菌16S rDNA V3区 DGGE电泳结果见图2,山羊血液中没有菌群,H1、H2、H3、H4、H5、H7为长角血蜱饱血雌成蜱、半饱血雌成蜱和雄成蜱所共有,H6是长角血蜱饱血雌蜱独有的优势条带。
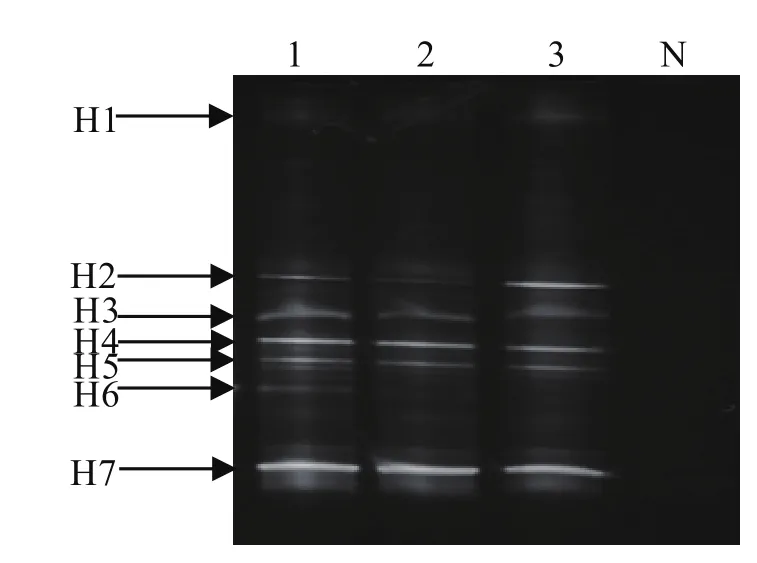
图2 长角血蜱肠道细菌16S rDNA V3区DGGE结果Fig.2 PCR-DGGE result of 16S rDNA V3of the bacteria in the midgut from H.Longicornis
2.3 DGGE 条带回收测序结果 长角血蜱优势条带序列及与GenBank数据库的比较结果如表1。

表 1 DGGE 胶中回收条带序列分析结果Table 1 The comparative results of DGGE bands recovered with the sequence from GenBank
长角血蜱广泛分布于我国鲁、豫、皖、苏、台、湘、鄂、晋、陕、黔、滇、川、藏、甘、黑、吉、辽等地,是莱姆病螺旋体、斑点热立克次体、巴贝西虫、蜱传脑炎病毒等疾病的传播媒介[6],故以长角血蜱为研究对象具有一定的代表性和实用意义。
本研究结果表明,长角血蜱中肠优势菌共7种,分别为泛菌(Pantoea)、柯克斯氏体属(Coxiella)、肠杆菌属(Enterobacter)、绿脓杆菌(Pseudomonas
aeruginosa)、假单胞菌属(Pseudomonas)、克雷伯氏菌属(Klebsiella)、欧文氏菌属(Erwinia)。李春红等[8]以细菌学方法分离到的显核菌、葡萄球菌、微杆菌、短杆菌、干酪白喉杆菌、芽孢杆菌属、不动杆菌属、嗜麦芽窄食单孢菌、鞘脂杆菌、产碱打菌、莫拉菌属、棒杆菌属、苍白杆菌属,本研究则未发现。
综合利用PCR-DGGE分析蜱类菌群结构的相关文献结果,笔者认为Coxiella、Enterobacter、Pseudomonas等是多种蜱的共有菌(见表2)。和长角血蜱半饱血雌成蜱和雄成蜱相比,长角血蜱饱血雌成蜱拥有更多的优势菌(如H6)。测序比对显示,H6序列属于柯克斯氏体属Coxiella。柯克斯氏体是Q热病的病原体,能长期在蜱体内存活,蜱既是传播媒介又是储存宿主。Node等[16]认为柯克斯氏体可以感染40多种蜱,能通过繁殖在种群内扩散。
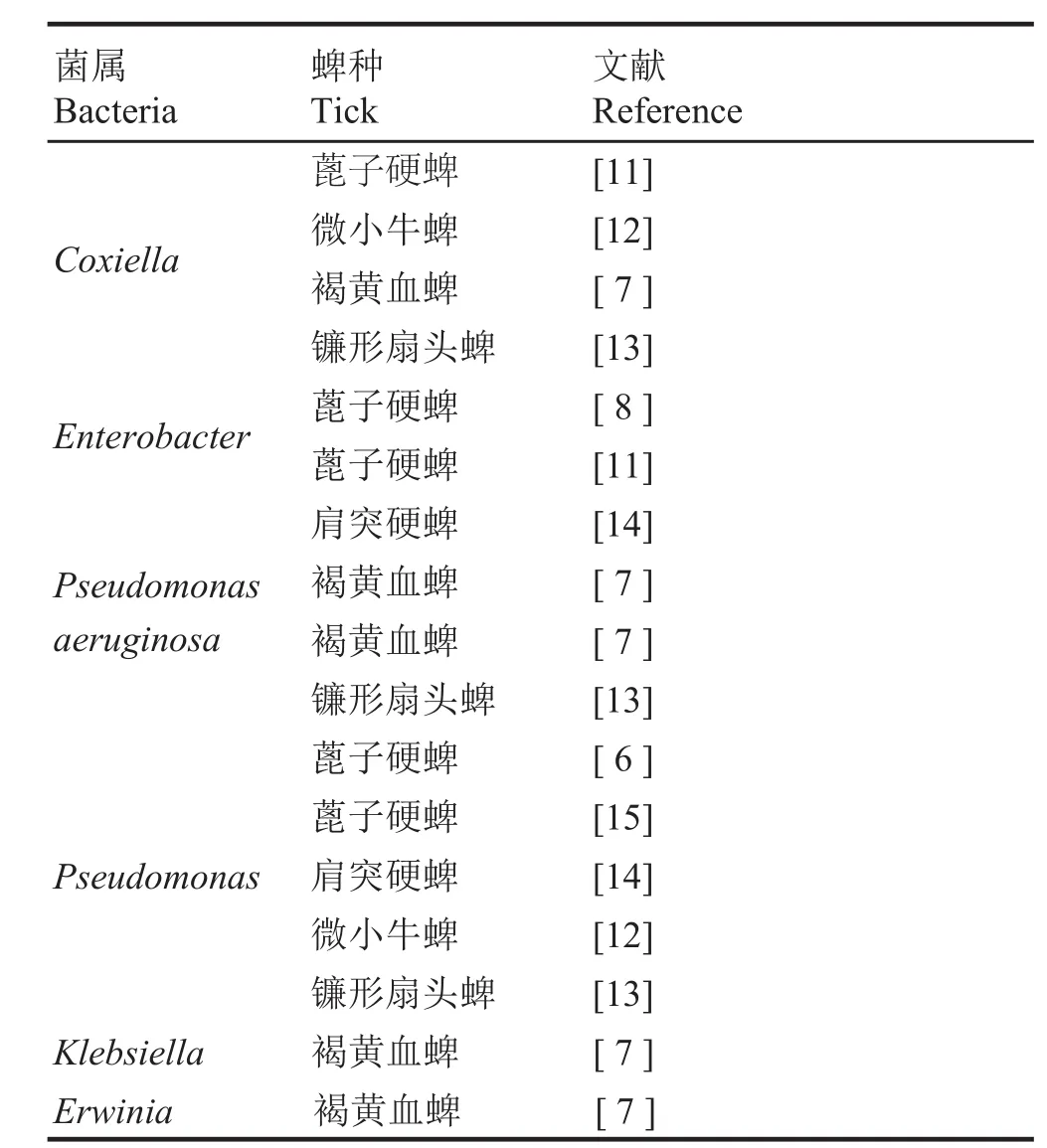
表 2 蜱种之间同种细菌的对照结果Table 2 Comparison of the same bacteria between different tick species
[1]朱振勤, 陈季武, 夏明仪. 吸血期蓖麻硬蝉雌虫体内周身性莱姆病螺旋体生长动态的组织学研究[J].中国人兽共患病杂志, 1998, 14(3): 16-20.
[2]Smith T A, Driscoll T, Gillespie J J, et al. A Coxiella-like endosymbiont is a potential vitamin source for the Lone Star Tick [J]. Genome Biol Evol, 2015, 7(3): 8311-838.
[3]Zimmer K R, Seixas A, Conceição J M, et al. Cattle tick-associated bacteria exert anti-biofilm and anti-Tritrichomonas foetus activities[J]. Vet Microbiol,2013,164(1-2): 171-176.
[4]Narasimhan S, Rajeevan N, Liu L, et al. Gut microbiota of the tick vector Ixodes Scapularis modulate colonization of the Lyme disease spirochete[J]. Cell Host Microbe,2014,15(1): 58-71.
[5]Rounds M A, Crowder C D, Matthews H E, et al. Identification of endosymbionts in ticks by broad-range polymerase chain reaction and electrospray ionization mass spectrometry[J]. J Med Entomol, 2012, 49(4): 843-850.
[6]陈泽, 杨晓军, 杨晓红,等. 中国蜱类地理分布及区系分析[J].四川动物, 2008, 27 (5): 820-823.
[7]van Overbeek L, Gassner F, van der Plas C L, et al. Diversity of Ixodes ricinus tick-associated bacterial communities from different forests[J]. FEMS Microbiol Ecol, 2008, 66(1): 72-84.
[8]李春红, 周勇志, 赵素华, 等.长角血蜱肠道细菌的分离与鉴定[J].中国预防兽医学报, 2011, 33 (8): 611-614.
[9]Halos L, Mavris M, Vourc'h G, et al. Broad-range PCRTTGE for the first-line detection of bacterial pathogen DNA in ticks[J]. Vet Res, 2006, 37(2): 245-253.
[10]Xu X L, Cheng T Y, Yang H, et al.Identification of intestinal bacterial flora in Rhipicephalus microplus ticks by conventional methods and PCR-DGGE analysis[J]. Exp Appl Acarol, 2015, 65(2): 257-268.
[11]杨亚, 严芬, 程天印, 等. 褐黄血蜱中肠内微生物种群研究[J].畜牧与兽医, 2014, 46 (7): 87-88.
[12]严芬, 徐兴莉, 程天印, 等. 镰形扇头蜱唾液腺、中肠和卵的菌群结构[J].中国兽医学报,2015,35(7): 1099-1102.
[13]Moreno C X, Moy F, Daniels T J, et al. Molecular analysis of microbial communities identified in different developmental stages of Ixodes scapularis ticks from Westchester and Dutchess Counties, New York[J]. Environ Microbiol, 2006, 8(5): 761-772.
[14]Schabereiter-Gurtner C, Lubitz W, Rölleke S. Application of broad-range 16S rRNA PCR amplification and DGGE fingerprinting for detection of tick-infecting bacteria[J]. J Microbiol Methods, 2003, 52(2): 251-260.
[15]Tveten A K, Sjåstad K K. Identification of bacteria infecting Ixodes ricinus ticks by 16S rDNA amplification and denaturing gradient gel electrophoresis[J]. Vector Borne Zoonotic Dis, 2011, 11(10): 1329-1334.
[16]Noda H, Munderloh U G, Kurtti T J. Endosymbionts of Ticks and Their Relationship to Wolbachia spp.and Tick-Borne Pathogens of Humans and Animals[J]. Appl Environ Microbiol, 1997, 63(10): 3926-3932.
ANALYSIS OF THE BACTERIA IN THE MIDGUT OF HAEMAPHYSALIS LONGICORNIS
LIAO Zhi-hui1,CHEN Hong-zhi2,TANG Hao1,CHENG Tian-yin1
(1. Hunan Agricultural University, Changsha 410128, China; 2. Xinyang College of Agriculture and Forestry, Xinyang 46400, China)
The bacteria in the midgut of H.longicornis were detected with PCR-DGGE. The midgut's contents were collected under sterile conditions, and the bacterial total genomic DNA was extracted. Then the 16S rDNA V3 was amplified with universal primers, and the DNA fragements were separated with DGGE electrophoresis. The result showed that Pantoea sp, Coxiella sp, Enterobacter sp, Pseudomonas aeruginosa sp, Pseudomonas sp, Klebsiella sp, Erwinia sp were dominant bacterial groups in the midgut from engorgement female ticks,but Coxiella sp was not found in the feding female and male H.longicornis.
PCR-DGGE; Haemaphysalis longicornis; intestinal microbiota
S852.746
B
1674-6422(2015)04-0061-04
2015-03-31
国家自然科学基金面上项目(31372431)
廖芷卉,女,硕士研究生,预防兽医学专业
程天印,E-mail:hn5368@163.com
明,长角血蜱饱血雌成蜱中肠优势菌为泛菌属、柯克斯氏体属、肠杆菌属、绿脓杆菌属、假单胞菌属、克雷伯氏菌属、欧文氏菌属,但半饱血雌成蜱和雄成蜱中肠未检测到柯克斯氏体属(Coxiella)。
