喜鹊和山斑鸠体内棘口科吸虫的种类鉴定
2015-11-19梁思婷朱顺海韩红玉赵其平杨斯涵裴恩乐
梁思婷,董 辉,朱顺海,韩红玉,赵其平,吴 迪,翟 颀,李 莎,杨斯涵,4,裴恩乐,黄 兵,5
(1.上海师范大学生命与环境科学学院,上海 200234;2.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海 200241;3.上海市野生动植物保护管理站,上海 200023;4.云南农业大学动物科学技术学院,昆明 650201;5.江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
喜鹊和山斑鸠体内棘口科吸虫的种类鉴定
梁思婷1,2,董 辉2,朱顺海2,韩红玉2,赵其平2,吴 迪3,翟 颀2,李 莎2,杨斯涵2,4,裴恩乐3,黄 兵2,5
(1.上海师范大学生命与环境科学学院,上海 200234;2.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海 200241;3.上海市野生动植物保护管理站,上海 200023;4.云南农业大学动物科学技术学院,昆明 650201;5.江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
为鉴定喜鹊和山斑鸠体内棘口吸虫种类,本文采用形态学结合分子生物学方法对其进行了种类鉴定。分子生物学结果显示,来源于喜鹊和山斑鸠虫体的线粒体NADH脱氢酶1(ND1)基因同源性为99%,在构建的系统发育树中,两种鸟的虫体ND1序列归类在同一分支,与其亲缘关系最近的是强壮棘口吸虫(Echinostoma robustum)和弗氏棘口吸虫(E. friedi)。形态学观测结果显示,来自同一种鸟的虫体具有相似的形态结构,而两种鸟之间的虫体形态存在一定差异;通过比较所获得虫体与强壮棘口吸虫、弗氏棘口吸虫之间的形态特征,发现这两种鸟体内检出的棘口吸虫均与弗氏棘口吸虫的的形态特征更为相符。结合分子生物学和形态学鉴定的结果,确定感染喜鹊和山斑鸠的棘口科吸虫均为弗氏棘口吸虫,这是弗氏棘口吸虫在国内的首次报道,喜鹊和山斑鸠应为弗氏棘口吸虫的新宿主。
棘口属;NADH脱氢酶1;弗氏棘口吸虫;喜鹊;山斑鸠
棘口科吸虫(Echinostomatidae Dietz,1909)是主要寄生于鸟类和哺乳类动物肠道的小型寄生虫,种类多,呈世界性分布[1]。已记录的棘口科吸虫有600多种,其中400多种寄生于鸟禽类,近70种寄生于哺乳动物,20余种寄生于人体[2]。我国已报道了棘口科吸虫100多种[3],寄生于家畜家禽的有78种[4],寄生于人体的有15种,其中12种为人兽共患寄生虫[2]。感染棘口科吸虫,不仅可造成幼鸟禽的生长发育迟缓[5,6],还可造成幼儿全身衰竭而死亡[7]。随着人类生活水平的提高,人与鸟类的接触越来越频繁,人类感染棘口科吸虫的机会大大增高。因此,对棘口科吸虫的研究,不仅有利于鸟类寄生虫病的防控,而且有利于提高人们防范人兽共患寄生虫病的意识,具有重要的公共卫生学意义。
本课题组于2012年对来源于曹家渡花鸟市场和龙川北路花鸟市场的103只鸟进行了寄生虫感染情况调查,共检出吸虫268条[8]。随后,我们对来源于喜鹊(Pica pica)和山斑鸠(Streptopelia orientalis)肠道吸虫进行了初步形态学鉴定,其中有17条为棘口科吸虫。为了明确上海市鸟类感染的棘口科吸虫虫种,本文采用分子生物学与形态学结合的方法对所获得的棘口科吸虫进行了鉴定。
1 材料与方法
1.1 虫体来源 17条棘口科吸虫中有14条虫体来自上海曹家渡花鸟市场的喜鹊,3条来自龙川北路花鸟市场的山斑鸠。将虫体自肠道取出后,70%酒精保存。分别从喜鹊源和山斑鸠源虫体中随机选取3条和1条用于分子生物学鉴定,其余13条用于形态学鉴定。
1.2 分子生物学检测
1.2.1 虫体DNA提取 剪取2~3 mm虫体,置于研磨器内研磨破碎,使用TIANamp Genomic DNA Kit提取虫体DNA,-20℃保存。
1.2.2 线粒体NADH脱氢酶1(ND1)基因克隆和序列测定 根据文献[9]报道的棘口科吸虫ND1基因序列设计并合成引物,ND1-UP-JB11(5'-AGA TTC GTA AGG GGC CTA ATA-3')和ND1-LOW-JB12(5'-ACC ACT AAC TAA TTC ACT TTC-3'),以提取的虫体DNA为模板,进行常规PCR扩增ND1基因。反应体系20 μL,反应参数:94℃预变性2 min;94℃变性30 s,48℃退火20 s,72℃延伸1 min,共39个循环;72℃延伸10 min。用1%琼脂糖凝胶电泳检测PCR产物,并用TIANgel Midi Purification Kit对目的基因进行纯化,保存于-20℃。将胶回收产物与pGEM-T-easy vector连接后,转化TOP10感受态细胞,挑取单克隆培养,经PCR鉴定为阳性后,送上海桑尼生物技术有限公司进行测序。
1.2.3 ND1序列分析和系统发育树构建 将测序结果通过NCBI上的Vector Contamination工具去除载体序列后,用BLAST程序进行同源比对。从GenBank下载相关的棘口科吸虫ND1序列21条,其中棘口属(Echinostoma)的强壮棘口吸虫(E. robustum)4条,弗氏棘口吸虫(E. friedi)1条,卷棘口吸虫(E. revolutum)7条,E. trivolvis 2条,E.paraensei 2条,凯氏棘口吸虫(E.caproni)2条,棘缘属(Echinoparyphium)的曲领棘缘吸虫(E. recurvatum)1条,低颈属(Hypoderaeum)的似锥低颈吸虫(H. conoideum)1条,似颈属的(Isthmiophora)獾似颈吸虫(I. melis)1条,选取片形科(Fasciolidae)原片属(Protofasciola)的强壮原片吸虫(P. robusta)作为外群(表1),用MEGA 6.06中的邻接法(Neighbour-joining,NJ),基于Kimura 2-parameter模型构建系统发育树,自展检验1000次,以估计可靠性。
1.3 形态学观测
1.3.1 虫体封片标本制备 将虫体从70%酒精保存液中取出,置于EP管内,42℃水浴2 h,使虫体变柔软。用两片载玻片压住虫体,放入70%酒精中固定3~5d后,按照文献[10]的方法进行冲洗、染色、脱水、脱色、再脱水、透明、封片,制备封片标本。

表 1 构建进化树所用的棘口科吸虫种株及相关信息Table 1 Species of Echinostomatidae analyzed phylogenetically using ND1 gene sequences and related information
1.3.2 标本的观察、拍照、测量与绘图 将制作好的虫体标本置于生物显微镜(型号:Nikon Eclipse 50i)和体视显微镜(型号:Olympus SZX16)下观察,拍照并测量虫体的长宽和头襟、头棘、口吸盘、前咽、咽、食道、腹吸盘、卵巢、睾丸等器官的大小,根据标本描绘虫体的形态结构图。
1.4 虫种的判定 综合分子生物学检测和形态学观测结果,并与近缘虫种进行形态特征的比较,最终确定喜鹊源和山斑鸠源棘口吸虫的种类。
2 结果
2.1 分子生物学检测结果 用于分子生物学检测的4个虫体均成功扩增出棘口科吸虫的ND1基因,大小均为530 bp(图1)。将喜鹊源虫体的序列命名为N06-1、N06-2和N10,山斑鸠源虫体序列命名为N65。N06-1、N06-2和N10之间的同源性为99%,他们与N65的同源性均为99%。通过BLAST同源性比对,4条ND1基因序列与已报道的强壮棘口吸虫(E. robustum)(GenBank登录号:AF025832)和弗氏棘口吸虫(E.friedi)(GenBank登录号:AJ564379)的同源性最高,分别为91%和90%。构建的进化树见图2,所获得的4条序列归类在同一分支,自展支持率为100,此单源支在棘口属吸虫的大分支内,与强壮棘口吸虫和弗氏棘口吸虫的亲缘关系最近,且有较高的自展支持率;与同属的卷棘口吸虫、凯氏棘口吸虫、E.trivolvis、E.paraensei的亲缘关系较远,与不同属的似锥低颈吸虫、曲领棘缘吸虫、獾似颈吸虫的亲缘关系更远,位于不同的分支上。
2.2 形态学观测结果 13个虫体封片标本的形态学观察显示,来自同一种鸟的虫体具有相似的形态结构,而两种鸟之间的虫体形态存在一定的差异(图3A、图4A)。虫体测量结果也存在差异,13条虫体各器官大小相关数据见表2。因喜鹊源棘口吸虫数量多,其形态学特征更具代表性,将其重点描述,而对山斑鸠源棘口吸虫的形态特征主要简述其与喜鹊源棘口吸虫的差别。

图 1 棘口科吸虫 ND1 基因 PCR 扩增结果Fig.1 PCR-amplified results of ND1 gene of Echinostomatidae

图 2 基于 ND1 基因序列构建的 NJ 树Fig.2 Construction of NJ tree based on ND1 gene sequences
2.2.1 喜鹊源棘口吸虫的形态特征 虫体呈长叶状,向腹面卷曲,检测11个虫体,长宽为(6.470~9.319)mm×(1.718~1.987) mm,虫体最宽处位于腹吸盘与卵巢间(图3A、B)。头冠发达呈肾形,大小为(0.275~0.401) mm×(0.504~0.727) mm。具有头棘37枚,其中左右腹角棘各5枚,排成两列,上列3枚、下列2枚;左右侧棘各6枚,呈单列排列;背棘15枚,前后两排相互排列;头棘平均大小为(0.065~0.112)mm×(0.016~0.031)mm(图3C、3D)。体表被有三角状体棘,自头冠开始分布至后睾,体前部密集,腹吸盘后逐渐稀疏(图3E)。口吸盘位于虫体前端腹面,扁圆形,大小为(0.229 ~ 0.283)mm×(0.236~0.345)mm。腹吸盘位于虫体前1/5,肌质,似球状,大小为(0.802~0.961)mm×(0.791~0.918) mm。前咽长0mm~0.160mm,个别标本的前咽不明显。咽较发达,短椭圆形,大小为(0.240~0.320)mm×(0.190~0.227)mm。食道长(0.459~0.633)mm,向后伸至腹吸盘前,形成肠叉,两肠管沿虫体两侧向后延伸至虫体亚末端。睾丸2枚,位于虫体3/4处,两肠管之间,前后排列或略有重叠,边缘凹陷呈2~3个浅裂瓣,前睾大小为(0.486~0.755)mm×(0.654~0.928)mm,后睾大小为(0.589~0.866)mm×(0.653~0.855)mm。雄茎囊呈椭圆形,位于肠叉与腹吸盘中部之间,其始端常与腹吸盘的中部相重叠,大小为(0.414~0.629)mm×(0.293~0.390)mm。雄茎囊内有长卵形储精囊、前列腺和弯曲的射精管,生殖孔位于腹吸盘前缘,开口于生殖腔。卵巢1个,横椭圆形,位于虫体中部或稍后,前睾之前,大小为(0.220~0.416)mm×(0.485~0.682)mm。从卵巢后缘伸出输卵管,后接卵模,外周有发达的卵壳腺。卵黄腺发达,呈滤泡状,排列致密,自腹吸盘后缘开始,沿虫体两侧向后延伸,直至虫体亚末端,并将两侧的肠管覆盖,睾丸后方的左右卵黄腺接近虫体中央,大部分虫体中央汇合。卵黄管在前睾前缘汇合,形成三角形的卵黄囊。子宫很长,横向弯曲于卵巢与腹吸盘之间,内含大量虫卵,最终形成肌质的子宫末段,开口于生殖腔。排泄管呈Y形,于后睾后缘汇合形成排泄囊,排泄孔开口于虫体末端。虫卵呈长卵形,金黄色或黄褐色,前端具卵盖,后端皱褶(图3F),大小为(67~112)µm×(44~82)µm。

表 2 喜鹊源和山斑鸠源棘口吸虫各器官的大小(μm)Table 2 The dimension of organs of parasite from Pica pica and Streptopelia orientalis (μm)
2.2.2 山斑鸠源和喜鹊源棘口吸虫的形态特征差异来自山斑鸠的棘口吸虫的形态特征(图4)与来自喜鹊的存在一定差异。主要表现:虫体各器官均较小,头颈部弯曲(图4A、B),出现头棘不全或丢失,其中一条虫体的头棘无法观察,而另一条仅观察到34枚,且腹角棘分布不规则(图4C、D)。睾丸位于虫体中部至后1/2,边缘略微凹陷,前睾稍宽呈类圆形,后睾稍长呈纵椭圆形。雄茎囊为长椭圆形,位于腹吸盘中部,其始端常与腹吸盘的后半部相重叠,雄茎囊的长度占腹吸盘长度的89%。卵巢位于体中部稍前,卵黄腺于体末端不汇合。其余特征与喜鹊的相似。

图 3 喜鹊腓氏棘口吸虫形态Fig. 3 The morphology of Echinostoma friedi from Pica pica
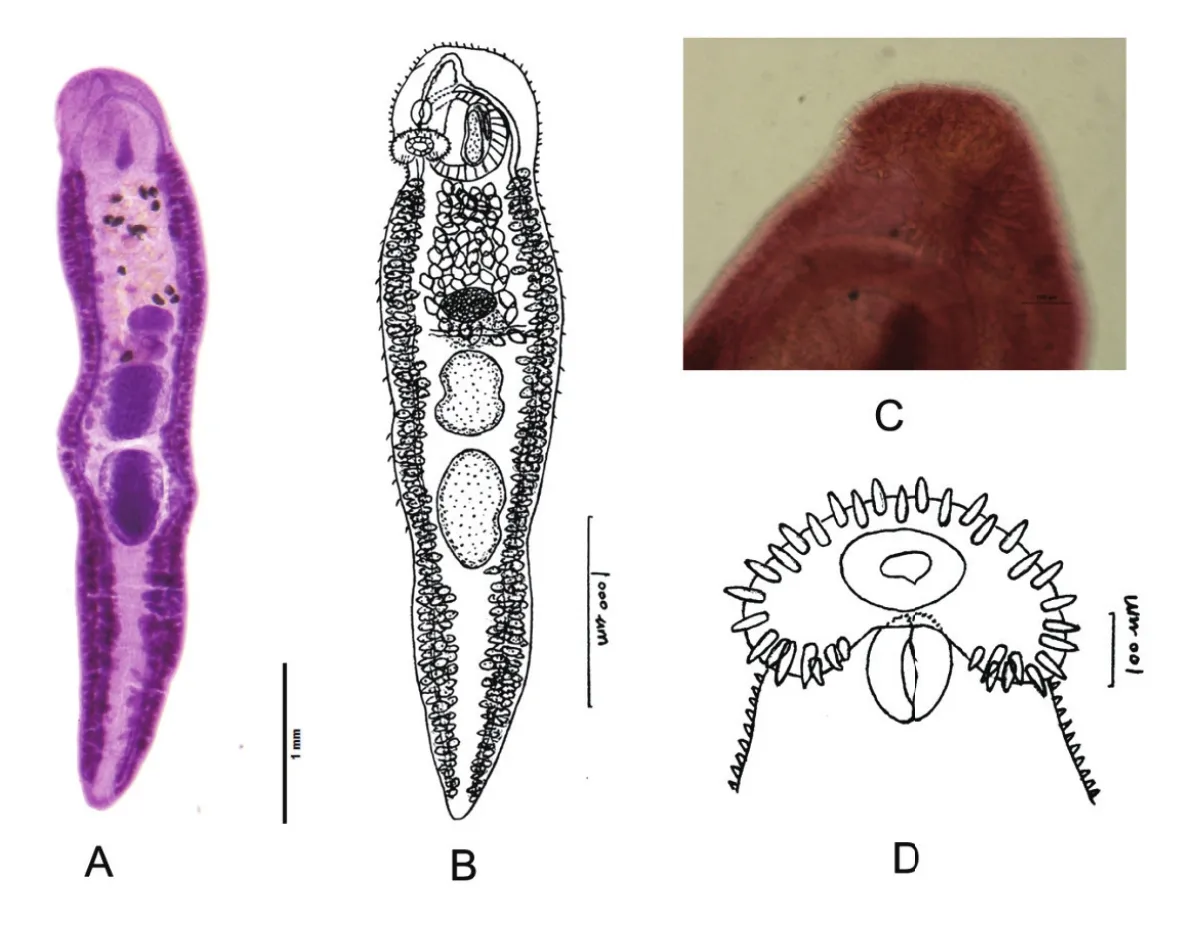
图 4 山斑鸠腓氏棘口吸虫形态Fig. 4 The morphology of Echinostoma friedi from Streptopelia orientalis
2.3 鉴定结果 序列分析和进化树结果表明,喜鹊源和山斑鸠源棘口吸虫为棘口属的同一种吸虫,该种吸虫与强壮棘口吸虫和弗氏棘口吸虫的同源性最高。将形态学的观测结果分别与文献报道的弗氏棘口吸虫[16]、强壮棘口吸虫[17]进行比较(表3),发现在食道长度、体棘分布、睾丸形态和位置等方面所获虫体与强壮棘口吸虫存在明显差异,而与弗氏棘口吸虫的特征基本相符。综合两方面的信息,确定喜鹊源和山斑鸠源棘口吸虫均为弗氏棘口吸虫(Echinostoma friedi)。
2.4 中文译名依据 Toledo等[16]为赞扬美国宾夕法尼亚德·弗里德(Bernard Fried)教授在37枚头棘的棘口吸虫生物学研究方面所作出的杰出贡献,将他们发现的棘口属吸虫新种以该教授的姓氏命名为Echinostoma friedi,其中文译名为弗氏棘口吸虫。

表 3 喜鹊和山斑鸠体内与弗氏棘口吸虫和强壮棘口吸虫的形态特征比较Table 3 Mophological comparison between E. friedior and E. robustum from Pica pica and Streptopelia orientalis
3 讨论
本文应用分子生物学与形态学相结合的方法,鉴定了寄生于喜鹊和山斑鸠的棘口科吸虫均为弗氏棘口吸虫。进化树结果表明,来源于棘口科的棘口属、棘缘属、低颈属和似颈属形成一个大分支,而片形科的原片属形成另一分支。在同一个科内,所有22条棘口属序列形成一个单系群,而棘缘属和低颈属序列形成另一个单系群,两个单系群形成一个大分支,似颈属吸虫形成另一分支,与Detwiler等[13,18]的结果一致。在37枚头棘的棘口属吸虫的大支内,本文所获的4条序列归类为一个分支,与来源于强壮棘口吸虫/弗氏棘口吸虫的序列形成姐妹分支,说明来源于喜鹊和山斑鸠的棘口属吸虫具有相似的进化关系,均与强壮棘口吸虫/弗氏棘口吸虫的亲缘关系最近。这2种棘口吸虫的形态特征相似,亲缘关系近,进化距离仅为0.9%[13,16]。Toledo等[16]认为二者的区别在于食道长度的差异,强壮棘口吸虫的食道长度占体长的百分比要比弗氏棘口吸虫的大(前者占9%,后者占5%)。本文中检测的喜鹊源棘口吸虫食道长度约占体长的7%,山斑鸠源约为6%,与Toledo等[16]的记录基本一致。查阅相关专著和文献,发现除了食道长度外,二者在体棘的分布(弗氏棘口吸虫的体棘至后睾,强壮棘口吸虫的体棘至前睾)、睾丸的位置(弗氏棘口吸虫为体后3/4,强壮棘口吸虫为体后1/3)、睾丸的形态(弗氏棘口吸虫分为3个裂瓣,强壮棘口吸虫分为3~4个深裂瓣,呈“不”字形)等方面也存在明显差异[17,19-23]。经形态学观测,发现来源于喜鹊和山斑鸠棘口吸虫的形态特征与强壮棘口吸虫存在明显的差异,而与弗氏棘口吸虫基本相符。
来源于喜鹊和山斑鸠的弗氏棘口吸虫,在虫体及器官的大小、睾丸形态、雄茎囊位置及其长度占腹吸盘长度百分比、卵黄腺汇合程度等方面都存在一定差异,我们推测这种差异与虫体对宿主的适应性有关。通常虫体在适宜宿主比非适宜宿主发育的更好,相对于山斑鸠,喜鹊也许是弗氏棘口吸虫较为适宜的宿主。Kinsella[24]认为终末宿主不同,吸虫成虫的形态、器官的大小会出现差异,在较为适宜的宿主中虫体较大,而虫卵的长度差异不明显。杨健美等[25]把来源相同的日本血吸虫尾蚴感染不同宿主,比较相同日龄虫体的发育情况,结果在不同宿主的虫体长度、宽度和发育情况存在差异,适宜宿主体内的虫体长度要明显长于非适宜宿主体内的虫体长度。
吸虫的传统分类是以成虫和幼虫各阶段的形态特征为主,由于虫体的形态特征易受环境、宿主等因素影响,使得形态学分类的准确性和可靠性受到一定的限制[26]。这在具有37枚头棘的棘口属吸虫的分类中更为典型[27]。相对于传统的形态学技术,分子生物学技术更灵敏、准确可靠,可用于虫种的分类鉴定和遗传多样性研究。目前,棘口科吸虫常用的分类分子标记有核糖体DNA的ITS和线粒体DNA的CO1、ND1。Morgan和Blair[11]比较了具有37枚头棘的棘口属吸虫ITS、CO1和ND1之间的差异,发现ITS平均种间差异为2.2%,CO1为8%,ND1为14%,表明三者中ND1进化速度快,种间差异显著,更适用于亲缘关系较近的物种(如具有37枚头棘的棘口属吸虫)的种系发生关系研究[11,15]。本文中来自喜鹊和山斑鸠的4个虫体均成功克隆出ND1基因,4条序列的同源性为99%,平均种内差异仅为0.4%,远远小于种间的14%,因此,这2种鸟的棘口吸虫尽管在形态上存在一些差异,我们仍确定为同一种吸虫。
弗氏棘口吸虫是由Toledo等[16]在西班牙的褐家鼠肠道中发现并命名,通过实验感染证明该吸虫可在禽类肠道寄生。本研究在喜鹊和山斑鸠的肠道检出弗氏棘口吸虫,这是该吸虫在国内的首次报道,喜鹊和山斑鸠应为其新宿主。由于弗氏棘口吸虫可感染哺乳类(褐家鼠)、鸟类(鹊和山斑鸠)、禽类等多种动物,说明其宿主范围较广,但其能否感染人类,尚需进一步研究。
[1]汪天平.人体棘口吸虫病研究进展[J]. 中国寄生虫病防治杂志, 1996, 9(4): 304-307.
[2]黄兵,韩红玉,董辉,等.动物寄生虫与人类健康·重要寄生虫病30种[M].北京:中国农业科学技术出版社,2015: 66.
[3]林金祥, 高依国, 程由注, 等. 人体自然感染日本棘隙吸虫(Echinochasmus japonicus)的发现[J].福建医药杂志, 1982(2): 30-32.
[4]黄兵,董辉,韩红玉,等.中国家畜家禽寄生虫名录(第二版)[M]. 北京: 中国农业科学技术出版社,2014: 47-54.
[5]刘世修,于晓平.朱鹮寄生蠕虫及蠕虫病初步研究[C]//中国野生动物保护协会、中国鸟类学会、陕西省野生动物保护协会.稀世珍禽——朱鹮——'99国际朱鹮保护研讨会文集.北京: 中国林业出版社, 1999: 175-178.
[6]于金玲,于迪,刘孝刚.幼龄豁眼鹅卷棘口吸虫病的诊治[J]. 中国家禽, 2013, 35(22): 54
[7]吴德明, 朱雪明, 唐学恒. 江苏省日本棘隙吸虫病首例报告[J]. 寄生虫学与寄生虫病杂志, 1990 (2): 76-86.
[8]韩红玉, 李榴佳, 董辉, 等. 上海市部分鸟类寄生蠕虫感染情况调查[J].中国动物传染病学报, 2013, 21(6): 43-49.
[9]Noikong W, Wongsawad C, Chai J, et al. Molecular analysis of Echinostome metacercariae from their second intermediate host found in a localised geographic region reveals genetic heterogeneity and possible cryptic speciation[J]. PLOSNeglect Trop D, 2014, 8(4): 1-7.
[10]索勋, 杨晓野, 朱兴全, 等. 高级寄生虫学实验指导[M]. 北京: 中国农业科学技术出版社, 2005: 104-107.
[11]Morgan J A T, Blair D. Relative merits of nuclear ribosomal internal transcribed spacers and mitochondrial CO1 and ND1 genes for distinguishing among Echinostoma species(Trematoda)[J]. Parasitol, 1998, 116(3): 289-297.
[12]Morgan J A T, Blair D. Mitochondrial ND1 gene sequences used to identify echinostome isolates from Australia and New Zealand[J]. Int J Parasitol, 1998, 28(3): 493-502.
[13]Detwiler J T, Bos D H, Minchella D J. Revealing the secret lives of cryptic species:examining the phylogenetic relationships of echinostome parasites in North America[J]. Mol Phylogenet Evol, 2010, 55(2): 611-620.
[14]Kostadinova A, Herniou E A, Barrett J, et al. Phylogenetic relationships of Echinostoma Rudolphi,1809 (Digenea: Echinostomatidae) and related genera re-assessed via DNA and morphological analyses[J]. Syst Parasitol, 2003, 54(3): 159-176.
[15]Georgieva S, Selbach C, Faltynkova A, et al. New cryptic species of the 'revolutum' group of Echinostoma (Digenea: Echinostomatidae) revealed by molecular and morphological data[J]. Parasit Vector, 2013, 6 :64 1-12.
[16]Toledo R, Munoz-Antoli C, Esteban J G. The life-cycle of Echinostoma friedi n. sp. (Trematoda: Echinostomatidae) in Spain and a discussion on the relationships within the 'revolutum' group based on cercarial chaetotaxy[J]. Syst Parasitol,2000, 45(3): 199-217.
[17]王溪云, 周静仪. 江西动物志·人与动物吸虫志[M]. 南昌:江西科学技术出版社, 1993: 85-86.
[18]Detwiler J T, Zajac A M, Minchella D J, et al. Revealing cryptic parasite diversity in a definitive host: echinostomes in muskrats[J]. J Parasitol, 2012, 98(6): 1148-1155.
[19]蒋学良, 周婉丽, 廖党金, 等. 四川畜禽寄生虫志[M]. 成都:四川科学技术出版社, 2004: 268-270.
[20]黄兵, 沈杰, 董辉, 等. 中国畜禽寄生虫形态分类图谱[M].北京: 中国农业科学技术出版社, 2006: 67-68.
[21]成源达, 刘多, 叶立云, 等. 湖南动物志:人体与动物寄生蠕虫[M]. 长沙: 湖南科学技术出版社, 2011: 38-39.
[22]顾昌栋,李敏敏,祝华.北京地区家禽体内棘口科(Echinostomatidae)几种吸虫的初步研究[J]. 动物学报, 1964, 16(1): 39-53.
[23]张峰山, 杨继宗, 潘新玉, 等. 浙江省家畜家禽寄生蠕虫志[M]. 杭州: 浙江省农业厅畜牧管理局, 1986: 30-31.
[24]Kinsella J M. Growth,development,and intraspecific variation of Quinqueserialis quinqueserialis (Trematoda: Notocotylidae)in rodent hosts[J]. J Parasitol, 1971, 57(1): 62-70.
[25]杨健美, 苑纯秀, 冯新港, 等. 日本血吸虫感染不同相容性动物宿主的比较研究[J].中国人兽共患病学报,2012,28(12): 1207-1211.
[26]刘娟, 李雍龙. DNA序列分析在吸虫种株基因差异研究方面的应用[J]. 国外医学寄生虫病分册, 2004, 31 (3): 108-111.
[27]Morgan J A T, Blair D. Nuclear rDNA ITS sequence variation in the trematode genus Echinostoma an aid to establishing relationships within the 37-collar-spine group[J]. Parasitol, 1995, 111(5): 609-615.
SPECIES IDENTIFICATION OF ECHINOSTOMATIDAE (TREMATODA)FROM MAGPIE (PICA PICA) AND ORIENTAL TURTLE DOVE (STREPTOPELIA ORIENTALIS)
LIANG Si-ting1,2,DONG Hui2,ZHU Shun-hai2,HAN Hong-yu2,ZHAO Qi-ping2,WU Di3,ZHAI Qi2,LI Sha2,YANG Si-han2,4,PEI En-le3,HUANG Bing2,5
(1. College of Life and Environment Sciences, Shanghai Normal University, Shanghai 200234, China; 2. Key Laboratory of Animal Parasitology, Ministry of Agriculture, Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 3.Shanghai Department of Wildlife Protection Administration, Shanghai 200023, China;4. College of Animal Science and Technology, Yunnan Agricultural University, Kunming 650201,China;5. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China)
In order to identify species of the parasites, which were collected from magpie (Pica pica) and oriental turtle dove (Streptopelia orientalis), belonging to the family Echinostomatidae (Trematoda), we used the morphology combining with molecular biology. The molecular biology results showed that the mitochondrial NADH dehydrogenase 1 (ND1) gene sequences from parasites found in magpie displayed 99% homology with that found in oriental turtle dove. In the phylogenetic tree, all the ND1 sequences from parasites found in two kinds of birds formed a monophyletic group and their closest relatives included Echinostoma robustum and E. friedi. The morphology results showed that the parasites from the same kind of bird had similar morphological structure, but there were some differences fromthe different kinds of bird. Comparison of the morphological characteristics between the parasites found in magpie and oriental turtle dove to E. robustum or E. friedi indicated that the parasites found in two kinds of birds prefer to be E. friedi. According to the molecular and morphological results, two kinds of birds were infected with the same parasite identified as E. friedi. This is the first report of E. friedi in China and the magpie and oriental turtle dove should be the new host of E. friedi.
Echinostoma; NADH dehydrogenase 1; Echinostoma friedi ; Pica pica; Streptopelia orientalis
S852.735
A
1674-6422(2015)04-0044-09
2015-02-10
上海市野生动植物保护管理站科技项目(HX201203);上海市闵行区高层次人才科研项目(2012RC030)
梁思婷,女,硕士研究生,动物学专业
黄兵,E-mail:hb@shvri.ac.cn
