H9N2亚型禽流感病毒抗原性变异的研究
2015-11-19葛菲菲杨德全鞠厚斌周锦萍
葛菲菲,刘 健,杨德全,李 鑫,鞠厚斌,周锦萍
(上海市动物疫病预防控制中心,上海 201103)
H9N2亚型禽流感病毒抗原性变异的研究
葛菲菲,刘 健,杨德全,李 鑫,鞠厚斌,周锦萍
(上海市动物疫病预防控制中心,上海 201103)
为了解不同年分离的H9N2亚型禽流感病毒(Avian infl uenza virus,AIV)之间的抗原相关性,挑选2002年、2006~2014年在上海市分离的14株H9N2亚型禽流感病毒,通过血凝抑制(hemagglutination inhibition,HI)交叉试验进行抗原性比较和分析。HI试验结果显示,2002年,2006~2014年这14株H9N2亚型AIV不同毒株间已经发生了抗原漂移,划分成4个不同的抗原群,A/Chicken/Shanghai/Y1/2002和A/Chicken/Shanghai/Y1/2006归为一个抗原群,A/Chicken/Shanghai /C/2011独自成为一个抗原群,A/Pigeon/Shanghai/JC1/2013、A/Chicken/Shanghai/1107/2013归为同一个抗原群,其余毒株均为一个抗原群。综上所述,随着时间的推移,H9N2 AIV抗原发生了不同程度的漂变,但是也存在在某个时间段多种抗原群共存的情况。该研究结果从理论上为上海市制定禽流感防控策略,有效防制H9N2 AIV流行提供了科学的指导,为生产H9N2亚型流感免疫与疫苗候选毒株的选择提供参考依据。
H9N2亚型禽流感病毒;交叉HI试验;抗原漂移
H9N2亚型禽流感病毒(Avian influenza virus,AIV)自20世纪90年代以来已经广泛在我国和世界各地流行,不仅给养禽业造成了巨大的经济损失,而且给公共卫生安全造成的隐患不可估量,对人类的健康也构成了巨大的威胁。我国独特的地理环境及养殖模式为AIV感染的发生、传播提供了有利条件,免疫压力及活禽市场的存在又为H9N2 AIV的重组和变异提供了必要条件[1]。目前,H9N2亚型的疫苗已用于常规免疫,在一定程度上控制了H9N2亚型AIV的暴发流行。但是,由于AIV传播快,宿主具有多样性,病毒株血清型众多,不同毒株间毒力差异大,变异性强等特点,造成局部地区仍有流行,且非典型性流行增多,免疫失败也屡见不鲜。Radu等[2]及Kilbourne等[3]指出疫苗株应经常改变,因为老的疫苗株通常仅对新毒株产生部分保护力。1999年,Garcia等[4]证实禽流感暴发期间AIV分离株有很高的变异性,从而导致疫苗无效。Suarez等[5]认为,AIV的变异可引起禽类甚至人类疫苗免疫的失败。刘红旗等[6]研究指出,HA基因的变异可能与频繁的疫苗免疫选择压力有关。本研究通过HI交叉试验来比较分析2002年、2006~2014年上海市分离的H9N2 AIV之间的抗原相关性,探讨其抗原性是否发生漂移,为H9N2亚型禽流感的防制提供参考依据。
1. 材料和方法
1.1 病毒株和基因序列号 A/Chicken/Shanghai/ Y1/2002(GQ 335463~GQ 335470)、A/Chicken/ Shanghai/Y1/2006(GQ 335471~GQ 335478)、A/Duck/Shanghai/C60/2007(KC 768039~KC768046)、A/Chicken/Shanghai/Y1/2007(GQ 335487~ GQ 335494)、A/Chicken/Shanghai/ Y2/2008(GQ 335511~GQ335518)、A/Duck/ Shanghai/C163/2009(KC 768047~KC 768054)、A/Swine/Henan/Y1/2009(KC 768047、KC 768049、KC 768051、KC 768053、KC 768055、KC 768057、KC 768059和KC 768061)、A/ Chicken/Shanghai/A/2010(KJ 726689、KJ 726695、KJ 726701、KJ 7267007、KJ 726713、KJ 726719、KJ 726725和KJ 726731)、A/Chicken/ Shanghai/C/2011(KJ 726691、KJ 726697、KJ 726703、KJ 726709、KJ 726715、KJ 726721、KJ 726727和KJ 726733)、A/Chicken/Shanghai/ C1/2012(KC417046、KC 417049、KC 417052、KC417055、KC 417058、KC 417061、KC 417064和KC 417067)、A/Chicken/Shanghai/C2/2012(KC 417047、KC 417050、KC 417053、KC 417056、KC 417059、KC 417062、K C 4 1 7 0 6 5和K C 4 1 7 0 6 8)、A/P i g e o n/ Shanghai/JC1/2013(KJ128362~128369)、A/Chicken/Shanghai/1107/2013(KJ 726693、KJ 726699、KJ 726705、KJ 726711、KJ 726717、KJ726723、KJ 726729和KJ 726735)和A/ Wild chicken/ Shanghai/C1/2014(KJ 726694、KJ 726700、KJ 726706、KJ 726712、KJ 726718、KJ 726724、KJ 726730和KJ726736),上述14株病毒均为本实验室分离保存。
1.2 主要仪器及试剂 孵化器购自EIFDM8646青岛兴仪电子设备公司;超低温冰箱(MDF- U50V)购自日本SANYO公司;制冰机(FM-120D)购自美国星崎公司);乳化器(FA25 Fluko);离心机(5415D Eppendorf);β-丙内酯购自上海西宝生物科技有限公司;菌检用培养基由本实验室制备。
1.3 SPF鸡与SPF鸡胚 SPF鸡由中国农科院上海兽医研究所提供;SPF鸡胚购自北京梅里亚维通实验动物技术有限公司。
1.4 有限稀释法纯化 对1.1中14株H9N2 AIV分别应用有限稀释法进行纯化,吸取病毒尿囊液50μL加入到含青霉素1000 U/mL、链霉素1000 μg/mL的450 μLPBS中,依次进行10倍系列稀释,然后以不同稀释倍数的病毒液接种9~11日龄SPF鸡胚,每枚100μL,平行3胚。接毒后鸡胚继续在孵化箱中孵育48 h后测定血凝,收取并保存最高稀释倍数的具有最高血凝价的鸡胚尿囊液,用于下一轮纯化。如此连续经过3次纯化后,把最后收取的尿囊液105稀释,以100 μL接毒SPF鸡胚,48 h收取尿囊液,混匀后分装,-80℃保存,分装的H9N2病毒液经鉴定无污染后用于后续实验。为防止传代过程中H9N2 AIV丢失及出现杂病毒的情况,对每一次收取的尿囊液进行血凝学及PCR鉴定,准确无误后用于下一轮纯化。
1.5 毒株的鸡胚半数感染量(EID50)测定 将病毒株用无菌生理盐水作10倍系列稀释,取10-3~10-7个稀释度,各尿囊腔接种10日龄SPF鸡胚3个,每枚0.1 mL。37℃培养48 h后,逐个测定鸡胚尿囊液HA价,HA效价≥4 log2判为感染,按Reed-Muench方法计算每0.1 mL的EID50。
1.6 灭活疫苗的制备 新鲜尿囊液0.5 mL(稀释至106EID50)加入β-丙内酯,并使其充分混合,β-丙内酯最终浓度为0.1%(V/V),置4℃摇床上灭活12 h,37℃摇床上水解2 h。取灭活的尿囊液9.3 mL,逐滴加入0.7 mL Tween-80。然后在搅拌的同时,把尿囊液和吐温的混合物逐渐加入20 mL白油佐剂中,充分乳化0.5 h,待尿囊液和白油充分包容后即为油乳剂灭活疫苗。
1.7 单因子血清的制备 对26日龄雏鸡采血,取血清进行血凝抑制(hemagglutination inhibition,HI)试验。将HI试验为阴性的雏鸡分成14组,分别用上述灭活疫苗肌肉接种4只26日龄雏鸡,一免后2周进行二免,二免后1周翅静脉采血测HI效价,HI效价达到8~10 1og2时,全部扑杀采集血清,4只鸡的血清混合,60℃水浴10 min灭活。
1.8 交叉HI试验 测定14株病毒的HA滴度,各重复4次,取其平均值,而后将其各配制成4个血凝单位。同一条件下用4个血凝单位的各病毒抗原分别测定上述准备的14种单因子血清对这14株H9N2 AIV株的HI效价,操作按GB/T 18936~2003进行。在微量反应板的1~11孔分别加入0.025 mLPBS,第12孔加入0.05 mL PBS。吸取0.025 mL血清加入第1孔内,充分混匀后吸0.025 mL于第2孔内,依次倍比稀释至第10孔,从第10孔吸取0.025 mL弃去。1~11孔均加入含4HAU混匀的病毒抗原液0.025 mL,室温(约20℃)静置至少30 min。每孔加入0.025 mL体积分数为1%的鸡红细胞悬液混匀,轻轻混匀,静置约40 min(室温约20℃),若环境温度太高可置4℃条件下进行。对照红细胞将呈显纽扣状沉于孔底。结果判定以完全抑制4个HAU抗原的血清最高稀释倍数作为HI滴度,最后比较抗原差异。
2 结果
2.1 HI交叉实验 同一条件下用4个血凝单位的各病毒抗原分别测定上述准备的14种单因子血清对这14株H9N2 AIV株的HI效价,比较抗原差异。其HI滴度(数值应为取log2后的值)详见表1。
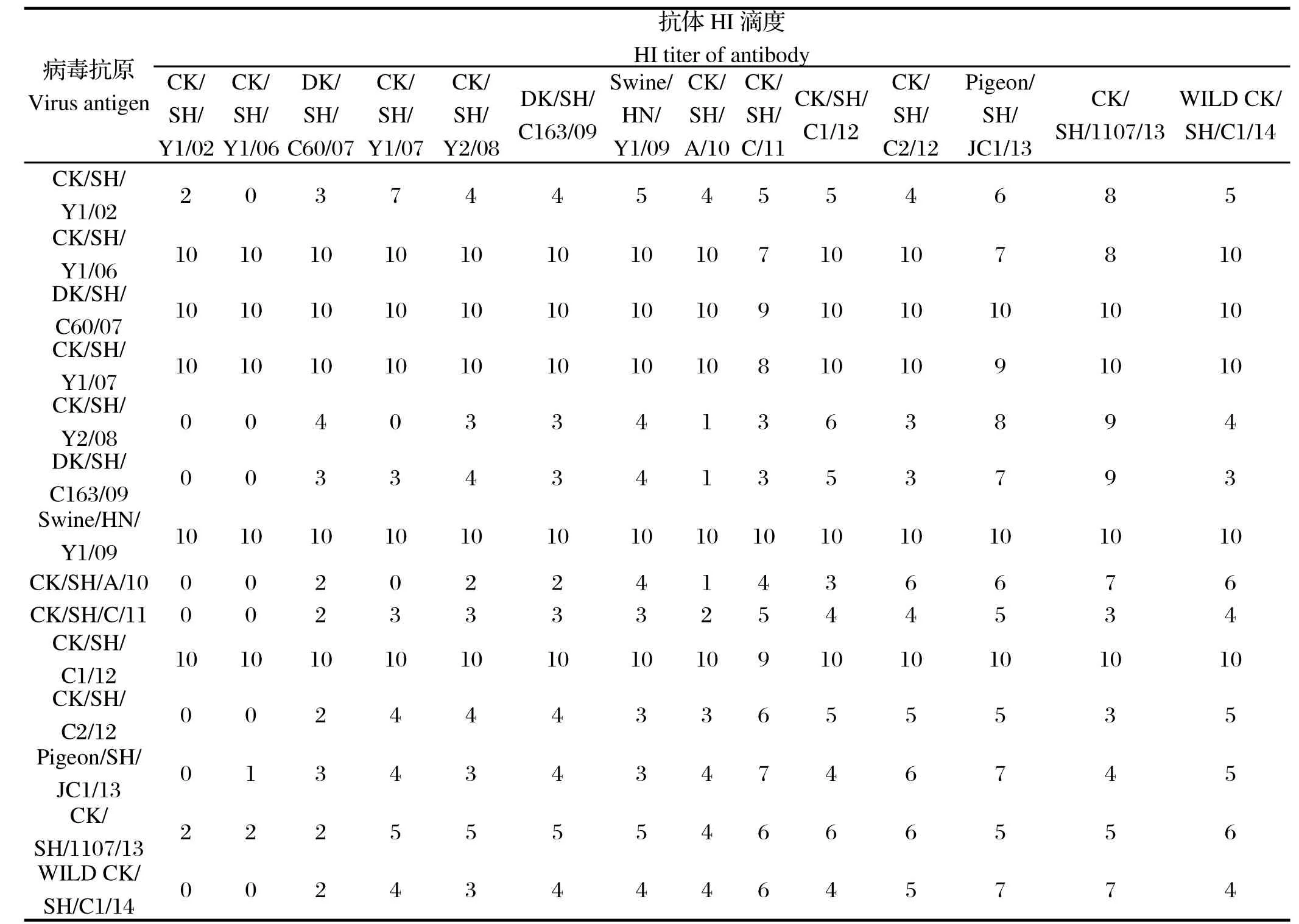
表 1 14株H9N2禽流感病毒毒株 HI交叉试验结果Table 1 Cross HI assay result of H9N2 Aviam infl uenza virus strains
2.2 抗原性结果分析 根据Guan等[7]研究,通过PRIMERversion 7.0 (PRIMER-E,Plymouth,United Kingdom)软件分析HI滴度详见图1,其中R1~R14分别代表了上述14株H9N2 AIV。从检测结果可以发现,A/Chicken/Shanghai /Y1 /2002和A/Chicken/Shanghai/ Y1/ 2006同属于一个抗原群,A/Chicken/Shanghai /C/2011独自成为一个抗原群,A/Pigeon/Shanghai/JC1/2013和A/Chicken/ Shanghai/1107/2013归为同一个抗原群,其余毒株均为一个抗原群。整体来看,H9N2 AIV抗原发生了不同程度的漂变,但是在某个时间段,也会存在多种抗原群共存的情况。

图1 14株H9N2亚型禽流感病毒抗原性聚类图Fig. 1 Antigenic analysis of the fourteen H9N2 subtype Avian infl uenza virus strains
3 讨论
本研究结果表明2002年和2006~2014年上海市分离的H9N2亚型禽流感病毒已发生了抗原漂移,14株H9N2亚型禽流感病毒的基因重组模式[8]可以分为5个不同的基因型,2002年和2006~2008年上海市分离的5株H9N2亚型禽流感毒株分别代表了4个不同的基因型:A/Chicken/Shanghai/Y1/2002、A/Chicken/ Shanghai/Y1/2006和A/Duck/Shanghai/C60/2007各单独为一种基因型,A/Chicken/Shanghai/Y1/2007和A/ Chicken/Shanghai/Y2 /2008属于一种基因型。2009年以后分离的9株H9N2 AIV属于另一个基因型。基因型和抗原性有一定的相关性,但是不明显,可能还与HA基因上的主要抗原位点相关,这还需要进一步的分析。Guan等[9]对2000~2005年中国部分省分离的H9N2 AIV进行了抗原性分析,采用Qa/HK/ G1/97、Dk/HK/Y280/97和Ck/HK/G9/97相关的单抗进行分群。刘金华等[10]也进行了相关的研究,选择1996~2008年分离的H9N2 AIV毒株,进行了交叉HI试验,结果表明分离的毒株至少可以分成5个抗原群(A~E),他们认为这些抗原群和基因群存在一定的相关性,也和病毒的分离时间相关。可见,在工作中应加强对流感病毒监测和研究,应该选择与制苗毒株一致的毒株作监测抗原,将与本地区流行的抗原性相近且免疫原性较好的毒株作为疫苗株,才能有效地控制流感的发生和流行。
[1]宿春虎. 2011-2013年华东地区禽流感病毒流行病学调查及H9N2亚型禽流感病毒的抗原性分析[D]. 扬州∶ 扬州大学, 2014.
[2]Radu D L, Weksler M E, Bona C A, et al. Maintenance of size and function of influenza virus hemagglutin specific transgenic T-cell clone during life[J]. J Cell Mol Med,2001, 5(4)∶ 388-396.
[3]Kilbourne E D, smith C, Brett I, et al. The total influenza vaccine failure o f 1947 revisited∶ major intrasubtypic antigenic change can explain failure of vaccine in post world warlepidemic [J]. Proc Nat Acad Sci USA, 2002,99(16)∶ 10748-10752.
[4]Garcia M, Crawford J M, Latimer J W, et al. Heterogeneity in the haemagglutinin gene emergence of the highly pathogemic phenotype among recent H5N2 avian influenza viruses from Mexico [J]. J Gen Virol,1999,77∶ 1493-1504.
[5]Suarez D L, Schultz-Cherry S. Immunology o f avian influenza virus∶ a review [ J ]. Dev Comp Immunol, 2000,24(2-3)∶ 269-283.
[6]刘红旗, 张评浒, 刘秀梵, 等. 封闭式饲养鸡场H9N2亚型禽流感病毒HA基因在5年内的遗传变异[J].微生物学报,2003, 28(6)∶ 16-21.
[7]Xu K M, Smith J D, Bahl J, et al. The genesis and evolution of H9N2 influenza viruses in poultry from southern China, 2000 to 2005[J]. J Virol, 2007, 81(19)∶10389-10401.
[8]李鑫, 葛菲菲, 刘健, 等. 上海地区H9N2亚型禽流感病毒的遗传演化分析[J]. 微生物与感染, 已接受, 待发表.
[9]Xu K M, Li K S, Smith G J D, et al. Evolution and Molecular Epidemiology of H9N2 Influenza A Viruses from Quail in Southern China, 2000 to 2005[J]. J Virol,2007, 81(6)∶ 2635-2645.
[10]Sun Y, Pu J, Jiang Z, et al. Genotypic evolution and antigenic drift of H9N2 influenza viruses in China from 1994 to 2008[J]. Vet Microbiol, 2010(146)∶ 215-225.
ANTIGENIC DRIFT OF H9N2 SUBTYPE AVIAN INFLUENZA VIRUS STRAINS ISOLATED FROM DIFFERENT YEARS
GE Fei-fei, LIU Jian, YANG De-quan, LI Xin, JU Hou-bin, ZHOU Jin-ping
(Shanghai Animal Disease Control Center, Shanghai 201103, China)
To analysis the antigenic characteristics of H9N2 subtype Avian infl uenza virus (AIV) isolated from Shanghai in 2002, 2006-2014, fourteen isolates were analysed by cross-hemagglutinin inhibition test (HI). The results revealed that antigenic drift had occurred in H9N2 subtype AIV in Shanghai during 2002, 2006-2014. These strains could be classifi ed into four groups. A/chicken/Shanghai/Y1/2002 and A/chicken/ Shanghai/ Y1/2006 belonged to the same antigenic group. One strain A/chicken/Shanghai /C/2011 belonged to the other group. A/pigeon/Shanghai/JC1/2013 and A/ chicken/ Shanghai/1107/2013 belong to the other antigenic group. The remaining virus strains comprised one group. These results indicated that antigenic drift occurred in these years. A variety of antigenically distinct H9N2 AIVs cocirculated in Shanghai during the same period. The result provided scientifi c reference data for the prevention against H9N2 AIVs and the selection of vaccine strains.
H9N2 subtype AIV; cross-hemagglutinin inhibition test ; antigenic drift
S852.659.5
A
1674-6422(2015)05-0010-05
2015-05-05
上海市市级农口系统青年人才成长计划(沪农青字(2014)第2-8号,沪农青字(2015)第2-3号);沪农科攻字(2015)第1-11号
葛菲菲,女,博士,主要从事分子生物学检测与病毒基因变异研究
周锦萍,E-mail:shzjpvet @163.com.
