Li3Ti4Cr MO12负极材料制备及其电化学性能
2015-11-18章冬云马紫峰
李 南, 任 婕, 章冬云, 马紫峰,3
(1.上海应用技术学院材料科学与工程学院,上海 201418;2.上海交通大学化学工程系,上海 200240;3.上海电化学能源器件工程技术研究中心,上海 200240)
Li3Ti4Cr MO12负极材料制备及其电化学性能
李 南1,2, 任 婕1, 章冬云1, 马紫峰1,2,3
(1.上海应用技术学院材料科学与工程学院,上海 201418;2.上海交通大学化学工程系,上海 200240;3.上海电化学能源器件工程技术研究中心,上海 200240)
基于Li4Ti5O12结构,设计双离子取代反应,制备了3种新型锂离子负极材料Li3Ti4Cr MO12(M=Ni、Ca、Mg),这些取代型负极材料具有与钛酸锂相同的晶体结构.使用球磨、喷雾造粒以及固相合成工艺制备出一次粒子为200~300 nm,二次颗粒为多孔球形的新型负极材料Li3Ti4Cr MO12,并对其电化学性能进行了测试.循环充放电试验结果表明,制备的3种材料中,镁铬钛酸锂(Li3Ti4Cr Mg O12)具有较高的放电比容量和较好的循环稳定性,0.2 C下首次放电比容量达158.6 m A·h/g.10次循环后,放电容量为148.1 m A·h/g,充电容量为149.1 m A·h/g,容量保持率和库伦效率均在99%以上,显示了潜在的应用价值.循环伏安(CV)和电化学阻抗谱(EIS)分析表明,上述优良性能来自于Mg、Cr取代后导致的材料界面电阻的下降.
负极材料;钛酸锂;电化学性能;交流阻抗
锂离子电池由于具有高比能量、高功率、高循环寿命、安全性和环境友好等优点,已在便携式电子设备等许多领域得到广泛应用.目前,商品化的锂离子电池负极材料大多采用各种嵌锂碳材料[1-3],但是碳材料作为负极在实际应用中还有一些难以克服的弱点,例如,当电池过充电时,碳电极表面易析出金属锂而引发安全性问题[4].尖晶石型Li4Ti5O12作为一种新型的锂离子二次电池负极材料,在充放电时骨架结构特性为“零应变”[5],与碳材料相比,具有循环性能好、不与电解液反应、安全性能高以及充放电平台平稳等优点,是近几年来备受关注的锂离子电池负极材料之一[5-6].
由于Li4Ti5O12是一种半导体材料,导电性差、密度低等缺点导致其在高倍率下电化学性能较差[7],针对这一情况很多学者开始进行钛酸锂的改性研究[7-13].目前,改善Li4Ti5O12倍率性能的途径主要有:制备小粒径Li4Ti5O12,缩短Li+的迁移路径,从而提高Li4Ti5O12导电性[9];通过添加导电性强的元素,如Ag、Cu、C等制备导电性好的Li4Ti5O12
[10];通过添加与Li+或Ti3+、Ti4+、O2-离子半径相近的离子,如Mg2+、K+、Ta5+、Br-来制备有晶格缺陷的Li4Ti5O12材料,使Li+在电极活性物质中快速嵌入和脱出,从而达到提高Li4Ti5O12导电性的目的.肖志平等[11]采用二步固相反应法合成了镁掺杂的钛酸锂负极材料,一定程度上提高了材料的倍率性能,但是其放电容量不高.Jin等[12]通过固相合成法,制备了尖晶石型Li4Ti5O12纳米颗粒,20 C倍率下放电比容量高达112 m A·h/g.Hany等[13]采用溶胶-凝胶法制备出Ni、Cr双离子取代钛酸锂(Li3Ti4Cr NiO12)材料,其所制备的铬镍钛酸锂在0.5 C倍率下首次放电比容量为156 m A·h/g,接近理论比容量.该材料所展现的较好电化学性能使其有望在动力电池领域实现良好的应用前景.但是其循环稳定性较差,10个充放电循环后比容量衰减了20%,且采用溶胶-凝胶法制备的铬镍钛酸锂周期较长,成本较高,不适合产业化生产.本课题组前期在钛酸锂材料的研究方面也进行了一些尝试,通过各种技术有效提升了该材料的电化学储锂性能和循环特性[14-17].
针对目前已有的溶胶-凝胶法铬镍钛酸锂循环性能差、制备工序复杂等不足,本文设计了3种二价离子M2+(M=Ni、Ca、Mg)和三价离子Cr3+取代锂、钛离子的研究方案(M/Cr取代Li/Ti),采用球磨、喷雾干燥和固相合成的工艺方式制备Li3Ti4Cr MO12(M=Ni、Ca、Mg)新型锂离子负极材料.研究了材料的电化学性能,发现相比于Li3Ti4Cr NiO12,Li3Ti4Cr MgO12材料具有非常优良的电化学性能,具有潜在应用价值.通过循环伏安法(CV)、电化学阻抗谱(EIS)等分析方法确认该优良性能来自于Mg、Cr取代后导致的材料界面电阻下降.
1 实验部分
1.1 Li3Ti4Cr MO12(M=Ni、Ca、Mg)负极材料的合成
按8︰1(n/n)称取TiO2(分析纯)和Cr2O3(分析纯),混合均匀后加入纳米球磨机中进行球磨.根据化学组成的需要,分别加入NiO(分析纯)、CaCO3(分析纯)和Mg O(分析纯),球磨至一定粒度后加入化学计量比的氢氧化锂溶液,继续球磨,控制浆料颗粒尺寸(D50)为200~400 nm.将所得的3种绿色浆料在搅拌状态下进行喷雾干燥,获得前驱体粉料.将前驱体粉料在惰性气体气氛下400°C保温4 h,再升温到900°C保温2 h,随炉冷却至室温即得到所需的Li3Ti4Cr MO12(M=Ni、Ca、Mg)锂离子电池负极材料.
1.2 物相纯度和粉体特征表征
采用日本Rigaku公司生产的D/MAX-2600PC型X射线衍射仪对获得粉体进行物相鉴定.测试采用Cu Kα射线,靶电流30 m A,靶电压40 k V,扫描范围10°~70°,扫描速度2°/min.采用Quanta 200型扫描电子显微镜(SEM)对合成目标产物的颗粒大小和表面形貌进行观察.
1.3 电化学性能测试
将材料组装成CR2016型扣式电池进行充放电循环测试.采用涂膜法制备电极,以N-甲基-2-吡咯烷酮(NMP)为溶剂,按质量比8︰1︰1分别取Li3Ti4Cr MO12(M=Ni、Ca、Mg)负极材料、乙炔黑和聚偏氟乙烯(PVDF),均匀混合后,涂在预处理过的铝箔上,放在真空烘箱中120°C干燥6 h,用冲孔器冲出所需直径的电极片.将所得电极作负极,锂片为正极,在充满干燥氩气的手套箱中,以Celgard 2400微孔聚丙烯为隔膜,以1 mol/L LiPF6/碳酸乙烯酯(EC)、碳酸二甲酯(DMC)(1︰1,V/V)为电解液组装成所需电池,在室温下用LAND电池测试系统对电池进行充放电性能测试,CV特性、EIS使用上海晨华CHI604D电化学工作站进行测试.
2 结果与讨论
2.1 物相纯度与晶体结构表征
3种Li3Ti4Cr MO12(M=Ni、Ca、Mg)负极材料的X射线衍射(XRD)谱线如图1所示.图1(a)为Li3Ti4Cr NiO12的XRD谱图,由于无标准PDF文件相比较,将其与Hany等[13]采用溶胶-凝胶法制备的纯相铬镍钛酸锂的谱线进行了比对,发现两者谱线形状基本一致,只是衍射峰的位置有一些偏离,衍射强度比例有所不同.这表明本文中合成的物质与该文献中合成物质铬镍钛酸锂具有相同的晶体结构.进一步分析发现,谱线的衍射峰位置与钛酸锂标准卡片中的衍射峰位置存在一一对应关系,用钛酸锂的晶体结构完全可以标定所有衍射峰,该标定结构标示于图1中.这一结果表明,实验中设计的Cr/Ni取代Li/Ti获得了成功,图1(a)的谱线是预期的铬镍钛酸锂.该铬镍钛酸锂为尖晶石结构,峰形尖锐,具有均一的立方相,结晶性能良好.图1(b)和(c)为Ca2+/Cr3+、Mg2+/Cr3+取代钛酸锂的XRD谱线.由图可见,合成材料的衍射峰形状基本相同,衍射峰位置有所偏移,衍射强度有所区别,表明同样获得了预期的铬钙钛酸锂和铬镁钛酸锂负极材料,它们具有相同的晶体结构,只是由于取代离子的半径不同,导致其晶格常数有所变化.

图1 Li3Ti4Cr MO12样品XRD对比谱图Fig.1 XRD patterns of Li3Ti4Cr MO12samples
2.2 Li3Ti4Cr MO12(M=Ni、Ca、Mg)的形貌特征
对获得的3种Li3Ti4Cr MO12负极材料的形貌进行了观察.图2(a)~(c)是Li3Ti4Cr NiO12的SEM图片.由图2(a)可见,所得锂离子电池负极材料具有规则的球形外貌特征,少量球形颗粒破碎后产生不规则外貌.图2(b)是其中一个颗粒的放大结果.对其进一步放大后结果如图2(c)所示,表明该球形颗粒由无数极其微小的亚微米颗粒组成.呈现球形多孔结构的形貌特征,亚微米颗粒尺寸为200~300 nm,存在的纳米孔隙可作为电解液与材料交换锂离子的毛细管道,增加电极材料和电解液的接触面积、缩短锂离子的迁移路径,便于离子交换,有利于提高合成材料的电化学性能.图2(d)~(f)、图2(g)~(i)分别为Li3Ti4CrCaO12和Li3Ti4Cr MgO12的SEM图片,与Li3Ti4Cr NiO12形貌特征非常相似,表明通过球磨获得的Li3Ti4Cr MO12负极材料均具有较为接近的外观特征和内部构造.
2.3 Li3Ti4Cr MO12(M=Ni、Ca、Mg)负极材料的电化学性能
对3种负极材料的电化学性能进行了测试,循环充放电结果如图3所示.实验中以金属锂片为正极,Li3Ti4Cr MO12(M=Ni、Ca、Mg)极片为负极组装成2016型扣式电池,在充放电电压1.0~2.0 V、充放电倍率为0.2 C时测试其电化学性能,体现了截然不同的电化学性能.由图3(a)可见,Li3Ti4Cr NiO12具有平坦的充放电曲线,其充放电平台为1.5 V左右,与Hany等[13]报道较为一致,也与标准钛酸锂的放电电压平台相一致,表明镍铬的取代只是轻微地改变了晶体的结构,对Ti4+/Ti3+的电化学过程无太大影响.与Hany等[13]报道不同的是,实验中仅仅观察到100 m A·h/g左右的放电容量,该材料首次放电容量100.4 m A·h/g,10次充放电循环后,容量保持率为99.1%,库伦效率为99.4%.该负极材料表现了一个稳定的充放电特征,但比容量需进一步提高.与镍铬钛酸锂不同,钙铬钛酸锂表现了较高的首次放电容量158.6 m A·h/g,但是随着充放电的进行,容量下降迅速,10次循环后,容量下降到110 m A·h/g左右,容量保持率仅为69.5%.本文中,镁铬钛酸锂具有非常优良的电化学性能,其循环充放电特性如图3(c)所示.该材料首次放电比容量为158.5 m A·h/g,首次充电容量为149.5 m A·h/g,首次库伦效率为94.3%,10次循环后,放电容量148.1 m A·h/g,充电容量149.1 m A·h/g,容量保持率和库伦效率均在99%以上,显示了潜在的应用价值.图3(d)是3种负极材料50次循环时的电化学性能比较,同样揭示了这些材料电化学性能存在的巨大差异性.

图2 Li3Ti4Cr MO12的SEM微观形貌图Fig.2 SEM micrographs of Li3Ti4Cr MO12powders

图3 Li3Ti4Cr MO12电化学性能Fig.3 Electrochemical performance of Li3Ti4Cr MO12powders
2.4 CV分析
为了揭示导致3种负极材料电化学性能差别的内在原因,进行了测试,结果如图4所示.由图可见,CV曲线中显示了2个明显的氧化峰和还原峰,对应Ti3+/Ti4+的氧化和还原过程,峰值对应的电压也标示于图中.氧化还原峰电压值之间的差值ΔV,反应了3种材料制备出的电极极化程度.一般地,ΔV越大,极片极化程度越大,循环稳定性差,导致容量衰减增大.因此,对于性能优良的电极材料,ΔV值越小越好.由图3计算可知,镍铬钛酸锂、钙铬钛酸锂、镁铬钛酸锂的ΔV值分别为0.205、0.363、0.198 V.三者中,镁铬钛酸锂具有尖锐的峰型和最小的ΔV值,预期应有最佳的电化学性能.这与实验中测量获得的电化学性能数据一致.

图4 Li3Ti4Cr MO12的循环伏安曲线Fig.4 Cyclic voltammetry curves of Li3Ti4Cr MO12
2.5 EIS分析
进一步使用EIS对3种极片组装的电池进行了测试,结果如图5所示.3种电池的EIS谱图在高频区和低频区均出现了2个半圆和1条斜率较大的直线.其中,高频区所出现的2个半圆对应电极材料在电化学反应过程中的电荷转移阻抗,与材料的导电性相关.半圆半径越大,电荷转移越困难,相应材料电阻率大,电化学性能也较差.低频区所出现的斜线对应电极材料表面扩散阻力,与锂离子在晶体材料内部的扩散过程相关,可用于锂离子扩散系数计算.斜率越大,扩散阻力越小,电化学性能高.
EIS谱线可用电化学软件Zsimpwin进行拟合.其等效电路公式为

由于图5中3种电池均出现了2个半圆,故拟合中选取了2套电阻和感抗元器件.其中,Rs为电池欧姆电阻;Rct1、Rct2为界面的电荷转移电阻;CPE1、CPE2反映其界面电容;σw是Li+在电解液中半无限扩散所造成的瓦尔堡阻抗;ω是扫描频率.
试验数据的拟合结果如表1所示.通过3种材料的横向比较,发现镁铬钛酸锂电池具有最低的接触电阻和界面电阻.这一结果表明,通过镁和铬的共同加入替代,大大提高了材料的本征电导率,降低电池的内阻,有助于提高电池整体的电化学性能.这些发现与上述容量测试和CV分析结果相吻合.至于为何镁铬的共同取代会导致以上结果,将在今后进一步的研究中使用第一性原理理论计算等方法予以阐述.

图5 Li3Ti4Cr MO12的阻抗谱Fig.5 Electric impedance spectrum of Li3Ti4Cr MO12
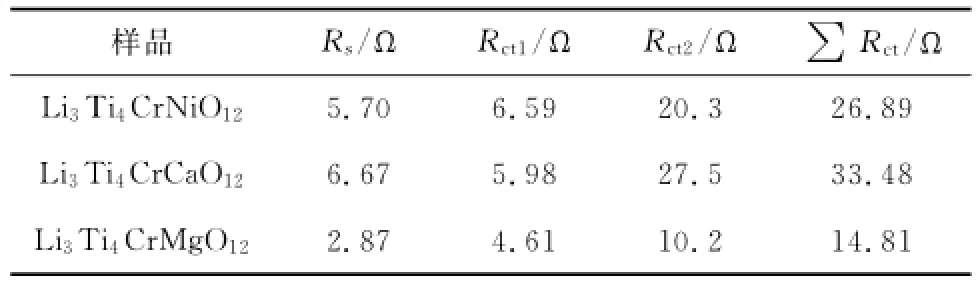
表1 EIS拟合结果Tab.1 Simulation results for the EIS
3 结 语
采用双离子取代方法制备出3种新型钛酸锂基负极材料Li3Ti4Cr MO12,具有与钛酸锂相同的晶体结构.通过球磨和喷雾造粒工艺制备出亚微米尺寸的球形颗粒,有助于减小锂离子迁移距离,增加锂离子扩散和交换,提升材料的电化学性能.循环充放电测试结果表明,镁铬取代的镁铬钛酸锂具有非常优良的比容量和循环稳定性,其初始放电容量为158.5 m A·h/g,接近其理论容量.10次循环后容量稳定在148 m A·h/g左右,库伦效率和容量保持率在99%以上.CV和EIS分析表明该材料优良的电化学特性来自于Mg、Cr取代后导致的材料界面电阻的下降.
[1] 李景虹.先进电池材料[M].北京:化学工业出版社,2004.
[2] Yoshio M,Wang H Y,Fukuda K,et al.Improvement of natural graphite as a lithium-ion battery anode material,from raw flake to carbon-coated sphere[J].J Mater Chem,2004,14(11):1754-1758.
[3] 吴宇平,戴晓兵,马军旗,等.锂离子电池:应用与实践[M].北京:化学工业出版社,2004.
[4] Su D S,Schloegl R.Nanostructured carbon and carbon nano composites for electrochemical energy storage applications[J].Chem Sus Chem,2010,3:136-168.
[5] 李星,唐水花,瞿美臻,等.尖晶石型钛酸锂负极材料的研究现状[J].合成化学,2013,21(1):119-123.
[6] 何泽强.锂离子电池用Li4Ti5O12碳复合材料的制备与电化学性能[J].无机化学学报,2007,23(4):733-737.
[7] Nakayama M,Ishida Y,Ikuta H,et al.Mixed conduction for the spinet type(1-x)Li4/3Ti5/3O4-xLi-Cr TiO4system[J].Solid State Ionics,1999,117:265-271.
[8] 张治安,王姣丽,赖延清,等.非对称电化学电容器负极材料Li4Ti5O12的研究进展[J].材料导报,2008,22(9):26-29.
[9] Raja M W,Mahanty S,Kundu M,et al.Synthesis of nanocrystalline Li4Ti5O12by a novel aqueous combustion technique[J].J Alloys Compd,2009,468(1-2):258-262.
[10] Huang S H,Wen Z Y,Zhu X J,et al.Preparation and electrochemical performance of Ag doped Li4Ti5O12[J].Electrochem Comm,2004,6(11):1093-1097.
[11] 肖志平,肖方明,王英,等.锂离子电池负极材料钛酸锂的掺镁改性[J].电池,2013,3(4):195-198.
[12] Jin Y H,Min K M,Shim H W,et al.Facile synthesis of nano-Li4Ti5O12for high-rate Li-ion battery anodes[J].Nanoscale Res Lett,2012,7(11):10-16.
[13] Hany E S,Mareike F,Colin G,et al. Li3Ti4Ni MnO12and Li3Ti4NiCrO12:new substituted lithium titanium oxides[J].Solid State Sci,2013,22:65-70.
[14] Wang D,Ding N,Song X H,et al.A simple gel route to synthesize nano Li4Ti5O12as a high-performance anode material for Li-ion battery[J].J Mater Sci,2009,44:198-203.
[15] Shi Y,Zhang D,Chang C,et al.Enhanced electrochemical performance of oxygen-deficient Li4Ti5O12-xanode material induced by graphene oxide[J].J Alloys Compds,2015,639(5):274-279.
[16] Yuan T,Li W T,Zhang W M,et al.One-pot spraydried graphene sheets-encapsulated nano-Li4Ti5O12microspheres for a hybrid batcap system[J].Industrial Eng Chem Res,2014,53(27):10849-10857.
[17] Wen R,Yue J,Ma Z F.Synthesis of Li4Ti5O12nanostructural anode materials with high charge-discharge capability[J].Chin Sci Bull,2014,59(18):2162-2174.
(编辑 吕丹)
Preparation and Electrochemical Performance of Li3Ti4CrMO12Anode Materials for Lithium lon Batteries
LI Nan1,2, REN Jie1, ZHANG Dongyun1, MA Zifeng1,2,3
(1.School of Materials Science and Engineering,Shanghai Institute of Technology,Shanghai 201418,China;2.School of Chemical Engineering,Shanghai Jiaotong University,Shanghai 200240,China;3.Shanghai Electrochemical Energy Devices Research Center,Shanghai 200240,China)
Based on the crystal structure of Li4Ti5O12,three new compounds with chemical composition of Li3Ti4Cr MO12(M=Ni、Ca、Mg)were synthesized by replacing Li and Ti ions with Cr and M ions.The newly prepared anodic materials showed similar crystal structure to their mother compound Li4Ti5O12. Porous spheres of the anodic materials with grain size around 200—300 nm were obtained through a combined method of nano grinding and spray drying.The electrochemical tests revealed different results. Among the three kinds of anodic materials,Li3Ti4Cr Mg O12presents the best electrochemical performance. The initial charging capacity attains 158.6 m A·h/g,which is very close to its theoretical capacity.After 10 cycles the discharge capacity remains 148.1 m A·h/g,while the charge capacity is 149.1 m A·h/g. Such cyclic performance creates good capacity retention and high columbic efficiency(>99%)and suggests great potential for industrial application.The subsequent cyclic voltammetry(CV)and electrochemicalimpedance spectroscopy(EIS)measurements further illustrated that the above-mentioned good electrochemical behaviors stemmed from the decline in the interfacial resistance generated by the replacement of Li/Ti with Mg/Cr.
anode material;lithium titanate;electrochemical performance;AC impedance
TQ 73
A
1671-7333(2015)04-0321-06
10.3969/j.issn.1671-7333.2015.04.002
2015-05-09
国家自然科学基金资助项目(21203120);上海市科委能力建设资助项目(14520503100);上海市教委科研创新资助项目(15ZZ095);上海张江国家自主创新示范区专项发展资金(201310-JD-B2-009)
李 南(1991-),女,硕士生,主要研究方向为锂离子电池.E-mail:1515339913@qq.com
马紫峰(1963-),男,教授,博士,主要研究方向为新能源材料.E-mail:zfma@sjtu.edu.cn
